Barnneurokirurgi är en subspecialitet inom neurokirurgin. Barnens neurokirurgiska sjukdomar skiljer sig från de vuxnas med andra diagnoser, patofysiologiska mekanismer, tumörtyper och inte minst annan prognos.
I denna artikel belyser vi de tre vanligaste barnneurokirurgiska tillstånden: hjärntumörer, hydrocefalus samt neuralrörsdefekter inklusive ryggmärgsbråck.
Vi sammanfattar bakgrund, symtombild och initial handläggning samt ger en översikt av neurokirurgisk behandling av sjukdomarna.
Prognosen är oftast god, men samtliga tillstånd är allvarliga och både sjukdom och behandling riskerar att ge livslånga konsekvenser för individen och dess anhöriga.
Barnneurokirurgi är en subspecialitet inom neurokirurgin. Barnens neurokirurgiska sjukdomar skiljer sig från de vuxnas genom andra diagnoser, patofysiologiska mekanismer, tumörtyper och inte minst prognoser. Barnets nervsystem under utveckling och sjuklighet kräver särskild hänsyn både i den kirurgiska och den psykosociala kontexten. Barn i olika utvecklingsfaser behöver olika bemötanden, som också omfattar en hel familj med särskilt krävande möten runt ett svårt sjukt barn och dess föräldrar. Det finns subspecialiserade kollegor vid varje neurokirurgisk klinik i Sverige som tillsammans hanterar hela det barnneurokirurgiska spektrumet, även om det ingår i den neurokirurgiska specialistutbildningen att kunna hantera de vanligaste diagnoserna. De flesta svenska barnneurokirurger har gått ESPN:s (European Society of Pediatric Neurosurgery) 3-åriga kurscykel för en gedigen teoretisk bakgrund i ämnet och certifiering.
I denna artikel belyser vi de tre vanligaste barnneurokirurgiska tillstånden: hjärntumörer, hydrocefalus och neuralrörsdefekter.
Hjärntumörer hos barn
Varje år drabbas ca 100 barn i Sverige av tumörer i det centrala nervsystemet. Tumörer i hjärna och ryggmärg utgör nästan en tredjedel av alla cancersjukdomar hos barn och är den vanligaste orsaken till död i barncancer. Tumörer i centrala nervsystemet hos barn representerar en anatomiskt och biologiskt skiftande grupp av neoplasmer, som kan debutera med både vanliga och ovanliga symtom. De allra yngsta barnen drabbas av tumörer med embryonalt ursprung medan äldre barn, likt de vuxna, drabbas av tumörer som härstammar från gliaceller [1]. Symtombilden varierar, men kan grovt delas upp i s k trycksymtom (förhöjt intrakraniellt tryck orsakat av tumörmassan eller obstruktiv hydrocefalus) och neurologiska bortfallssymtom (orsakat av tumörinfiltration i nervsystemet). Bristande medvetenhet om kliniska tecken och symtom på hjärntumörer kan leda till fördröjd diagnos med försämrad prognos som följd. Besök den brittiska folkbildningskampanjen Headsmart (www.headsmart.org.uk) för en utmärkt genomgång av de vanligaste debutsymtomen i olika åldrar.
En nyupptäckt barnhjärntumör är ett akutfall ur både medicinskt och psykologiskt perspektiv. Neurokirurgi utgör vanligen den första behandlingen efter diagnos och kompletteras med cytostatika och strålning vid behov i nära samarbete med barnneurologer och onkologer.
Den kirurgiska behandlingen individanpassas, och strategin avgörs av tumörens lokalisation, radiologiska utseende och eventuell spridning samt barnets ålder. Oftast är målsättningen att avlägsna tumören i sin helhet och bibehålla neurologisk funktion. Därtill måste ofta förhöjt intrakraniellt tryck orsakat av tumören eller obstruktion av likvorvägar avlastas. Vid tumörer belägna i känsliga centrala områden, som hypotalamusregionen eller hjärnstammen, är risken stor för funktionsbortfall och då avlägsnas tumören fram till gränsen för acceptabla neurologiska bortfall, alternativt utförs tumörbiopsi med efterföljande onkologisk behandling [2]. Accidentella bifynd av tumörliknande förändringar är inte ovanliga, och ibland väljs då exspektans med radiologisk uppföljning.
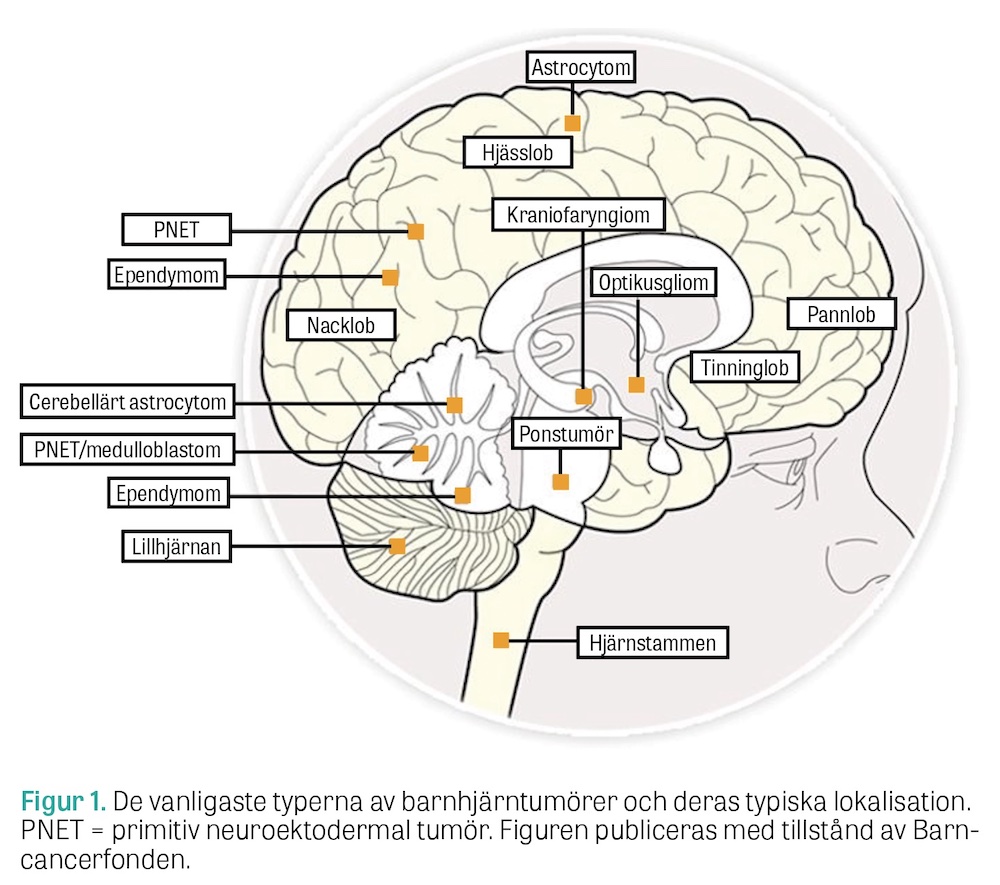
Hälften av alla tumörer i barndomen återfinns infratentoriellt i lillhjärnan eller hjärnstammen, till skillnad från hos vuxna där primära hjärntumörer i bakre skallgropen är mycket ovanliga och lesioner oftast är metastaser från annan primärtumör [3]. Det sparsamma utrymmet i den bakre skallgropen gör dessa tumörer särskilt benägna att ge snabb utveckling av obstruktiv hydrocefalus, hjärnstamskompression och risk för inklämning. Hjärntumör ska misstänkas och utredas skyndsamt med radiologi vid symtom som talar för förhöjt intrakraniellt tryck, såsom huvudvärk, illamående/kräkningar och slöhet, eller ökande huvudomfång och spänd fontanell hos de yngsta barnen. Vid kompression av tumören mot hjärnstammen kan även kranialnervssymtom utvecklas. De vanligaste tumörerna som påträffas i bakre skallgropen är medulloblastom, ependymom och pilocytiskt astrocytom [4]. Prognosen är relaterad till resektionsgraden, och radikal kirurgi eftersträvas om den kan utföras utan omfattande neurologiska bortfall. Nya tekniska hjälpmedel, såsom neuronavigation och intraoperativ MRT, har gett bättre förutsättningar för säker radikal kirurgi. Trots detta kan möjligheten till radikal kirurgi vara begränsad av tumörens växtsätt, där exempelvis invasiv växt i hjärnstammen förhindrar denna möjlighet.
De vanligaste supratentoriella tumörerna hos barn är astrocytom, kraniofaryngiom och germinalcellstumörer. Kraniofaryngiom är en långsamt och lokalt invasivt växande tumör. Lokalisationen i sella turcica och suprasellära regionen gör att barnen kan utveckla hypofyssvikt, synproblem och hydrocefalus. Radikal kirurgi av stora kraniofaryngiom är riskfylld, då hypofysinsufficiens och skador på hypotalamus ofta sker, med personlighetsförändring, apati och obesitas som följd. På grund av riskerna har flera centrum övergått till en strategi med begränsad kirurgi för att avlasta synapparat och likvorobstruktion, följt av strålbehandling [5].
Trots att överlevnaden för barn med hjärntumörer har förbättrats har de en allvarligare sjukdom och följdverkan av behandling än barn med andra tumörformer. Såväl tumörens lokalisation som kirurgisk och onkologisk behandling kan ge upphov till livslång morbiditet, behov av shunt och funktionsbortfall i nervsystemet och endokrina systemet. Detta kan ha tidvis svåra konsekvenser för skolgång, yrkesliv, sociala kontakter och familjeliv under hela livet. Därtill ökar strålbehandling i barndomen risken för utveckling av sekundära maligniteter i det centrala nervsystemet i vuxen ålder [6].
Hydrocefalus hos barn
Hydrocefalus innebär en störning i cirkulationen av cerebrospinalvätska (likvor), antingen genom obstruktion av avflödet eller genom försämrat upptag av likvor, vilket gör att vätska ackumuleras i ventrikelsystemet. Incidensen av hydrocefalus hos barn i Sverige är ca 7/10 000 nyfödda [7]. Obstruktion kan uppstå genom en kongenital missbildning, exempelvis akveduktstenos på grund av cysta eller tumör i 3:e eller 4:e ventrikeln eller intraventrikulär blödning hos prematurfödda. Hos barn <2 års ålder upptäcks hydrocefalus ofta på grund av ökad skalltillväxt, men även på grund av buktande fontanell, skelning (solnedgångsblick) och kräkningar. Hos äldre barn med slutna fontaneller och suturer uppstår ofta symtom på förhöjt intrakraniellt tryck, såsom huvudvärk, kräkning eller skelning. Utan behandling leder tillståndet till hjärnskador och kan ge medvetandesänkning med dödlig utgång. De vanligaste orsakerna till hydrocefalus hos barn i Sverige är medfödda missbildningar i centrala nervsystemet (exempelvis akveduktstenos, intraventrikulära cystor och följder av ryggmärgsbråck), hjärntumör och resttillstånd efter blödning eller infektion i ventrikelsystemet [8].
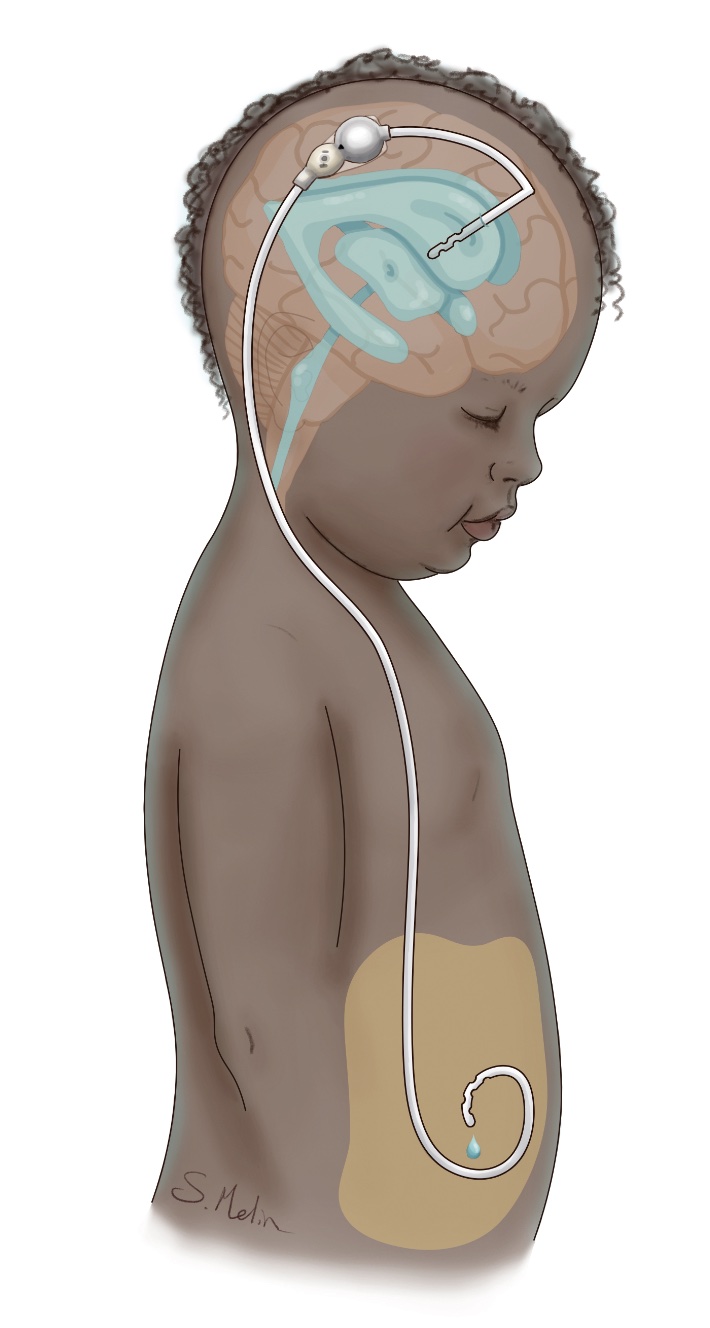
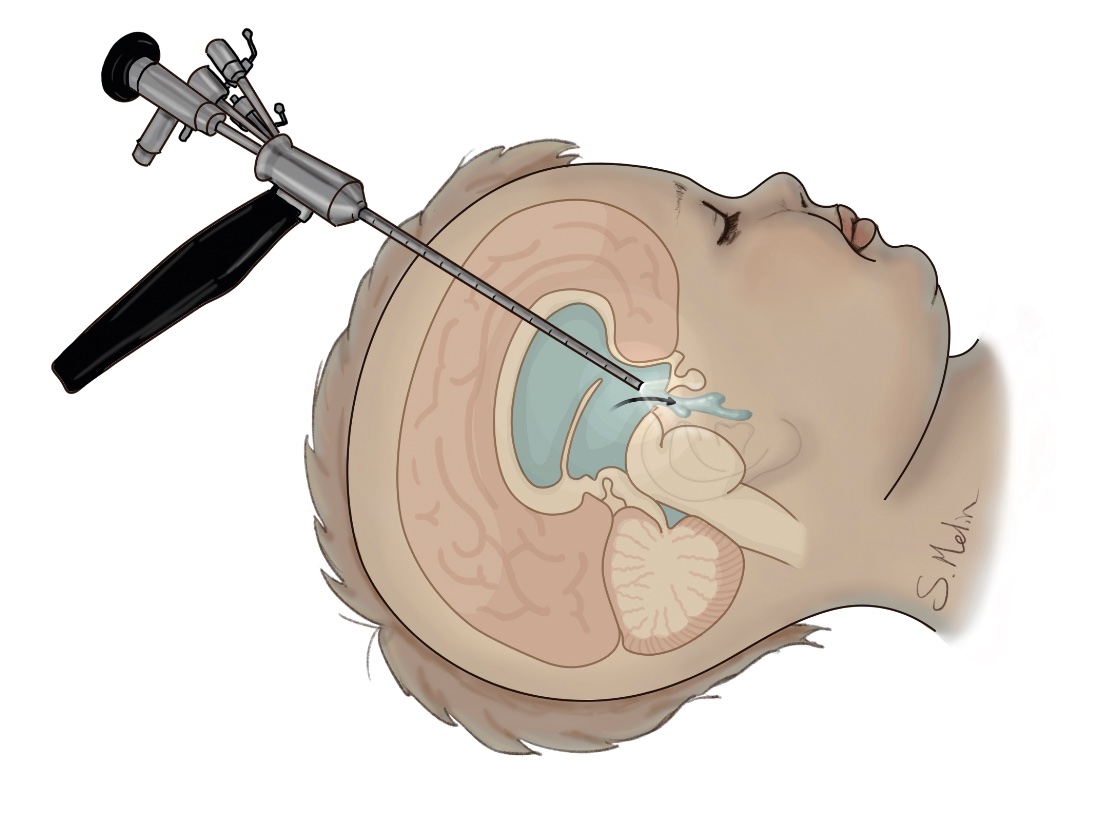
Behandlingen vid hydrocefalus är kirurgisk, och det finns två huvudsakliga tekniker. En metod som använts sedan 1950-talet är shunt, en tunn slang som leder vätskan från hjärnans ventriklar till bukhålan eller hjärtat. Alternativt kan endoskopisk ventrikulocisternostomi (VCS) användas, där en förbindelse skapas i botten på tredje ventrikeln mellan ventrikelsystemet och subaraknoidala cisterner. Båda operationsmetoderna har cirka 50 procents chans att fortfarande fungera efter ett par år [8]. Vid akut hydrocefalus kan man tillfälligt avlasta ventrikelsystemet genom ett externt ventrikeldränage, för att senare antingen göra VCS eller lägga in en shunt. Hos prematurfödda barn med intraventrikulär blödning, där shunt inte kan läggas på grund av blödningens omfattning och då barnet har en låg vikt (<2 kg), kan man lägga en kateter till ventrikeln med en reservoar subkutant, som sedan kan punkteras dagligen [9]. Genom intermittent tappning kan man ofta skjuta på shuntinläggning tills barnet väger >2,5 kg, och i vissa fall kan reservoaren avvecklas utan att man behöver lägga in shunt. VCS är oftast effektiv vid akveduktstenos eller vid obstruktion på grund av tumör eller cysta [10]. Vid infektion, ryggmärgsbråck och blödning hos prematurfödda är chansen att VCS ska fungera liten, och dessa tillstånd brukar behandlas med shunt. De vanligaste orsakerna till reoperation vid shuntbehandling är mekanisk obstruktion eller shuntinfektion, som förekommer hos 5–15 procent av patienterna. Obstruktion beror oftast på stopp i ventrikelkatetern, men även stopp i shuntventil, bukkateter eller shuntavbrott måste uteslutas. Vid misstanke om shuntdysfunktion görs shuntöversikt och datortomografi för att se om det finns shuntavbrott och om ventrikelvidden ökat jämfört med tidigare. Även VCS kan växa ihop, och det har då samma konsekvenser som ett shuntstopp. Vid misstanke om shuntdysfunktion eller slutning av VCS ska neurokirurg kontaktas akut, då tillståndet snabbt kan förvärras och leda till medvetslöshet och allvarliga hjärnskador.
Ventilen är en shuntkomponent som reglerar hur mycket cerebrospinalvätska ska dräneras från ventriklarna. De flesta shuntar som används i Sverige har en ventil som är ställbar med hjälp av en magnet och där motståndet även efter operationen kan justeras enligt det som passar patienten bäst. En oavsiktlig omställning kan dock ske vid lek med kraftiga magneter, och äldre ventiler måste kontrolleras efter MR. Ibland fungerar shunten för bra och ger överdränage, med huvudvärk och trötthet som följd. Dessa symtom kan ibland vara svåra att skilja från shuntdysfunktion, och invasiv mätning av det intrakraniella trycket kan vara värdefull.
Shuntbehandling är oftast livslång, men i vissa fall kan man göra VCS och på så sätt avveckla shunten. Dock är båda behandlingarna att betrakta som symtomatiska och sjukdomen oftast som kronisk. Patienterna behöver i regel återkommande kliniska och radiologiska kontroller upp i vuxen ålder. Prognosen efter behandling för hydrocefalus avgörs i första hand av grundtillståndet, och en stor andel av barnen har neurologiska funktionshinder, epilepsi eller inlärningssvårigheter [7].
Neuralrörsdefekter
Neuralrörsdefekter tillhör de mest allvarliga medfödda missbildningarna som orsakar morbiditet och mortalitet hos barn [11]. Frekvensen av alla typer av neuralrörsdefekter bedöms vara ca 0,92/1 000 graviditeter i Europa [12].
Genesen till neuralrörsdefekter är multifaktoriell och påverkas av både miljöfaktorer, maternell komorbiditet (exempelvis diabetes och obesitas) och genetik. Folsyratillskott har viss effekt på förekomst av neuralrörsdefekter [12, 13].
Neurulationen, processen där nervsystemet börjar bildas, pågår mellan 18:e och 32:a dagen postkonceptionellt, och en störning här leder till neuralrörsdefekter [11]. Spina bifida occulta, det vill säga avsaknad av bakre element på en kota men med intakt hud, meninger och neurala strukturer, är den mest benigna och vanliga neuralrörsdefekten och är i regel asymtomatisk [14]. De övriga neuralrörsdefekterna är en heterogen grupp, som omfattar anomalier på enbart duran (meningocele), lipom (i conus eller filum terminale) och ryggmärgsbråck [15]. Då det är vanligt med sakrala nervrotsengagemang är det viktigt att utreda förekomst av neurogen blåsrubbning hos barnet. Hudtäckta neuralrörsdefekter kan oftast åtgärdas elektivt, och syftet är då att minska risken för neurologiska, urologiska och ortopediska funktionsnedsättningar.
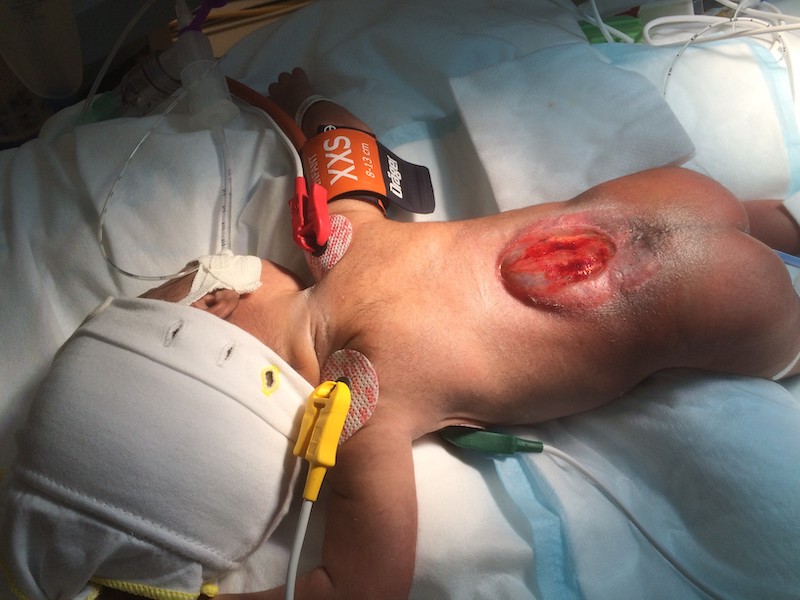
Mer omfattande är det öppna ryggmärgsbråcket, myelomeningocele, som i Sverige oftast diagnostiseras intrauterint. Vid prenatal upptäckt av myelomeningocele erbjuds blivande föräldrar utredning och uppföljning vid regionsjukhus. Vid myelomeningocele saknar en del av ryggmärgen helt täckning av meninger, skelett och hud. Ett öppet ryggmärgsbråck är ett neurokirurgiskt akutfall, och operativ förslutning görs inom ett dygn. Efter förlossningen läggs sterila koksaltkompresser på bråcket och bedömning avseende neurologisk funktion i nedre extremiteter och förekomst av hydrocefalus görs. MRT av huvud och helrygg alternativt ultraljud huvud görs innan barnet förs till neurokirurgisk operationssal för åtgärd. Ca 80 procent av dessa barn kommer även att behöva en permanent shunt på grund av hydrocefalus [16].
Det neurologiska utfallet är beroende av vilken nivå ryggmärgsbråcket ligger på. Barn med sakralt myelomeningocele kan ibland gå med spasticitet, medan i stort sett alla mer kranialt belägna bråck orsakar paraplegi.
Förekomst av neurogen blås- och tarmrubbning, fotdeformiteter och hydrocefalus gör att familjerna knyts till specialiserade team bestående av barnneurolog, barnneurokirurg, barnortoped, barnurolog, uroterapeut och fysioterapeut. Nationella riktlinjer för medicinsk uppföljning av patienter med neuralrörsdefekter är utformade av Svensk neuropediatrisk förening [17]. Omhändertagandet har varit framgångsrikt med stora förbättringar av överlevnad och livskvalitet, varför vuxna med myelomeningocele nu är en växande grupp. I Sverige beräknas 50‒70 graviditeter med myelomeningocele förekomma årligen, men endast 10‒15 barn föds med defekten då majoriteten av fostren aborteras. 90 procent av födda är kända via ultraljudsscreening [18].
Incidensen av barn födda med myelomeningocele har kraftigt minskat i Sverige de senaste decennierna, medan det globalt förblir ett stort hälsoproblem. I västvärlden har intrauterin fosterkirurgi med förslutande av myelomeningocele under andra trimestern vunnit insteg i behandlingsarsenalen vid högspecialiserade centrum, vilket har resulterat i halverat shuntbehov, ökad motorik i nedre extremiteter och en ökad andel patienter som kan gå [16]. Såväl maternella som fetala risker föreligger dock vid denna metod, som inte är etablerad i Skandinavien i dagsläget.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.