Behandling av hjärntumörer görs i samverkan mellan flera medicinska discipliner: neurokirurgi, onkologi, neurologi, neuropatologi, neuroradiologi och rehabiliteringsmedicin.
Symtom som talar för förhöjt intrakraniellt tryck, såsom kraftig huvudvärk, illamående, kräkningar och papillödem, bör leda till snabb utredning och kontakt med neurokirurg.
Förbättrad preoperativ kartläggning av tumören samt angränsande anatomiska och funktionella hjärnområden tillsammans med avancerad mikrokirurgisk teknik, intraoperativ monitorering och visualisering samt nya minimalinvasiva tekniker gör operationer säkrare, och det är i dag möjligt att utföra ingrepp som tidigare ansågs omöjliga eller alltför riskabla.
Utredning och behandling av patienter med hjärntumörer kräver ett multidisciplinärt tillvägagångssätt som inkluderar neurokirurgi, onkologi, neurologi, neuropatologi, neuroradiologi och rehabiliteringsmedicin. Denna artikel fokuserar på det neurokirurgiska omhändertagandet av vuxna patienter med hjärntumörer, exemplifierat med de vanligaste diagnoserna och behandlingsmetoderna.
Epidemiologi och klassifikation
Primära hjärntumörer har sitt ursprung i hjärnan, medan sekundära hjärntumörer är metastaser från tumörer i andra delar av kroppen. Primära hjärntumörer kan vara benigna eller maligna; de benigna växer oftast med tydlig avgränsning mot hjärnvävnaden (t ex meningiom) medan maligna oftast infiltrerar hjärnparenkymet (t ex astrocytom). I Sverige diagnostiseras ca 1 300 patienter med primär hjärntumör varje år, och ännu flera med metastaser [1]. Epidemiologiska bakrundsdata för de vanligaste primära hjärntumörer ses i Tabell 1. Det har skett en betydande utveckling av diagnostiken av tumörer i centrala nervsystemet under de senaste 5–10 åren. Världshälsoorganisationen (WHO) inkluderade officiellt molekylära markörer, utöver histologiska bedömningar, som del av klassifikationssystemet 2016. 2021 fortsatte utvecklingen av WHO:s klassifikation, där t ex isocitratdehydrogenas (IDH)-mutation ger en bättre definition av det som tidigare kallades diffusa låggradiga gliom, men själva graden kan numera vara 2‒4 för IDH-muterade astrocytom och 2‒3 för oligodendrogliom. Denna ändring, med utökad roll för den molekylära diagnostiken och mindre fokus på gradskillnader inom gruppen, ändrar vår tidigare förenklade uppfattning av diffusa lågmaligna gliom grad 2 gentemot diffusa högmaligna gliom grad 3 och 4 [2]. Således finns det numera två olika tumörer av diffus astrocytär karaktär som kan räknas till grad 4: glioblastom IDH-vildtyp och IDH-muterade diffusa astrocytom [3]. En sammanfattning av några viktiga ändringar i WHO:s tumörklassifikation 2021 ses i Tabell 2 [3].
Utvecklingen inom diagnostiken motsvaras hittills inte av liknande framsteg i den systemiska behandlingen. De stora förhoppningarna på individualiserad behandling riktad mot specifika genetiska avvikelser eller användningen av immunterapi har än så länge inte infriats på något avgörande sätt för majoriteten av patienterna [5]. Kirurgi har alltjämt en nyckelroll i behandlingen av de flesta primära hjärntumörer.
Symtom och utredning
Symtomen vid hjärntumör kan antingen vara akuta eller utvecklas långsamt, och patienter kan söka vård via både primärvården och akutsjukvården. Symtom som talar för förhöjt intrakraniellt tryck, såsom kraftig huvudvärk, illamående, kräkningar och papillödem, bör leda till snabb utredning och kontakt med neurokirurg då risk kan finnas för cerebral inklämning, särskilt vid större tumörvolym med tydlig masseffekt och ödem. Detta gäller i synnerhet tumörer i bakre skallgropen som kan leda till sekundär obstruktiv hydrocefalus. Vid välgrundad misstanke finns numera ett standardiserat vårdförlopp, som rekommenderar inneliggande utredning och diskussion om eventuell behandling vid multidisciplinär konferens. Fynd som inger välgrundad misstanke beskrivs i Fakta 1 [6].
Vid misstanke om hjärntumör ska MR hjärna med och utan intravenös konstrast utföras. Vid radiologisk misstanke om ependymom, en tumörtyp med högre risk för spridning via likvorvägar, bör den radiologiska utredningen kompletteras och inkludera MR av spinalkanalen. Vid misstanke om sekundär hjärntumör bör man leta efter primärtumören, vilket ofta inkluderar DT av torax och buk. Vid icke-akuta fall inriktas den initiala handläggningen på symtomlindring, vilket kan innefatta steroider (vid ödem), antiepileptika, antiemetika och protonpumpshämmare (pga steroidbehandling) [6].
Efter diskussion vid multidisciplinär konferens fattas beslut om eventuell vidare kirurgisk behandling i samråd med patienten. Det rör sig här om individuella beslut, där uppskattad risk och vinst vägs mot naturalförloppet. Beslutet baseras till stor del på
- prognos
- den radiologiska bilden/kirurgisk tillgänglighet
- patientens biologiska ålder [6].
Neurokirurgisk utredning och behandling
Neurokirurgisk handläggning av hjärntumörer innefattar biopsi samt palliativa och ibland kurativa behandlingar med resektion, stereotaktisk strålbehandling eller laserablation.
Biopsi. Målet med biopsi är i första hand att säkerställa diagnos, när den är osäker och avvägningen av risk och nytta med vidare behandling inte är lika självklar, exempelvis hos patienter med hög ålder, betydande komorbiditet, dålig prognos (t ex spridd malign sjukdom i hjärnan och/eller kroppen) samt hos patienter med tumörer i kirurgiskt svårtillgängliga delar av hjärnan. Det finns i dag huvudsakligen två olika biopsitekniker. Den första är rambaserad biopsi, där en stereotaktisk ram monteras på patientens huvud. Patienten genomgår en stereotaktisk DT/MR, och därefter beräknas målpunktskoordinater i ett tredimensionellt koordinatsystem. Den andra är en icke-rambaserad biopsiteknik, där ett navigationssystem med eller utan robot används för biopsin. För att bestämma målpunkten används tumörens radiologiska karakteristika, såsom kontrastladdning och i vissa fall metabol aktivitet (t ex PET med aminosyra). Biopsitagning är inte ett komplikationsfritt ingrepp och bör endast utföras om PAD-svar påverkar patientens vidare handläggning [7].
Resektion. En resektion syftar till största möjliga avlägsnande av tumören och till histopatologisk diagnostik med bibehållen funktionsgrad hos patienten. Detta är det neurokirurgiska förstahandsvalet för maligna tumörer hos patienter där ingreppet bedöms möjligt att utföra med en rimlig avvägning mellan risk och nytta. I många fall används mikrokirurgisk eller endoskopisk teknik, där man med bra optik och ljuskällor kan visualisera även svåråtkomliga områden djupt i hjärnan och skallbasen.
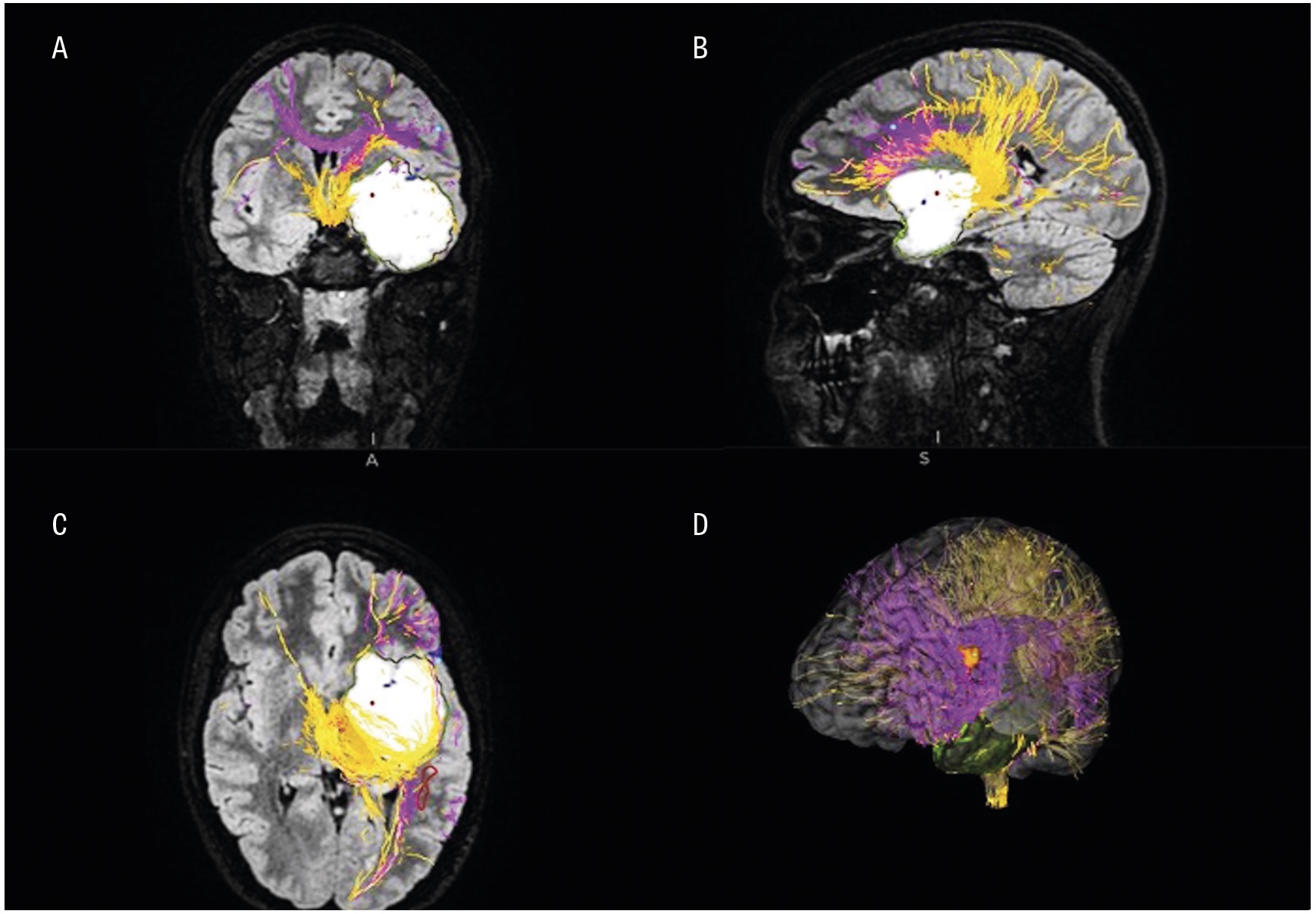
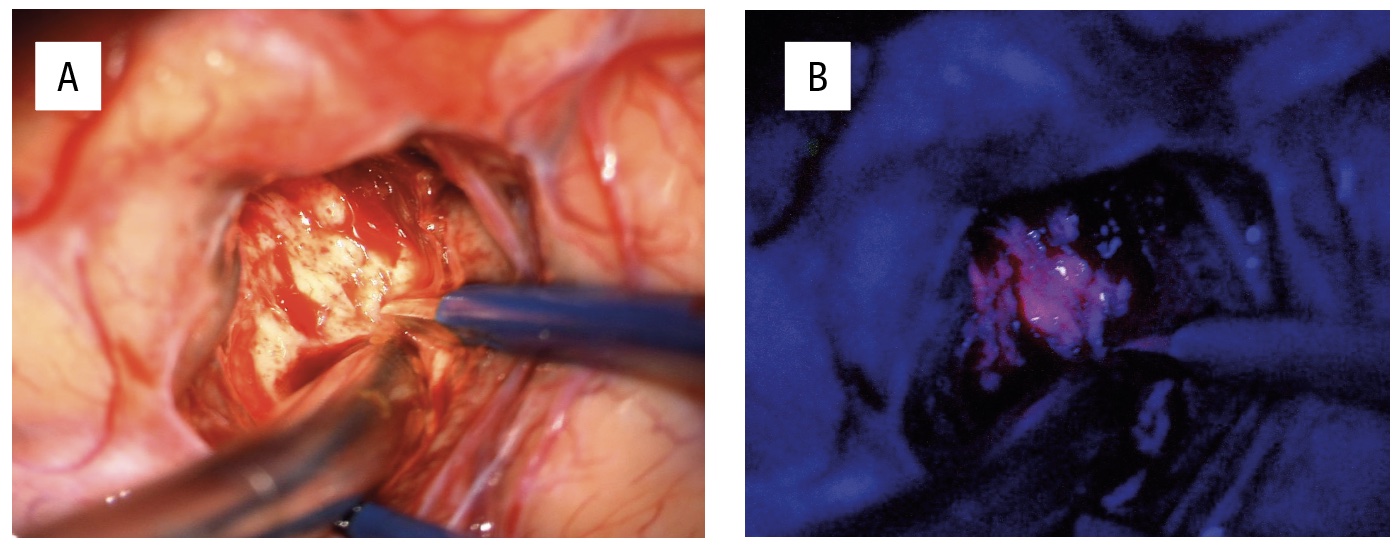
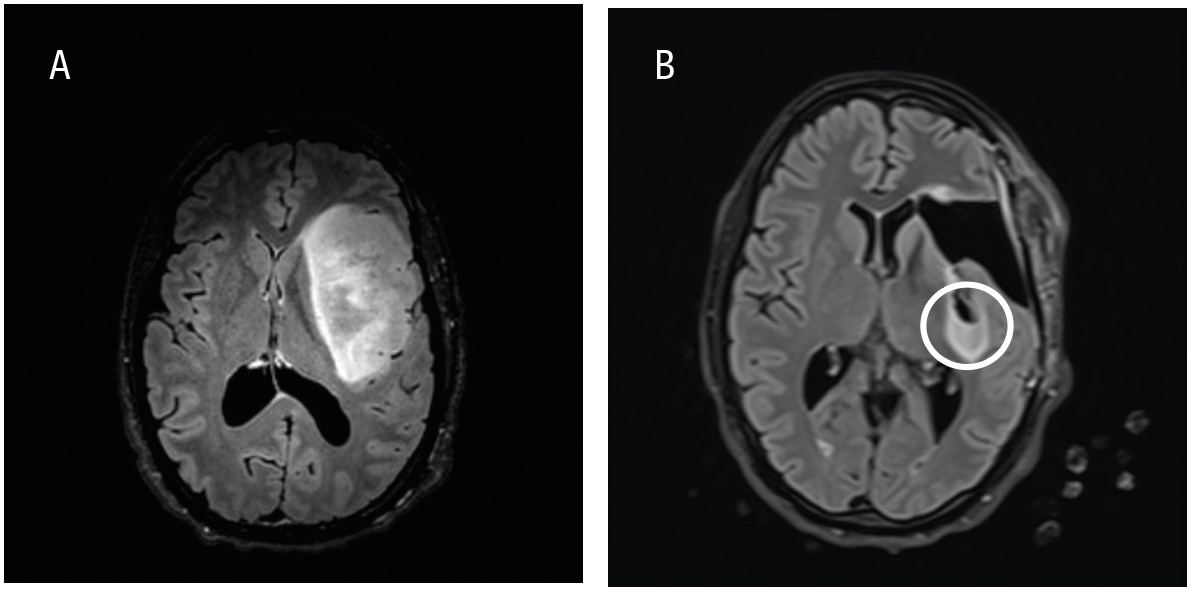
Patienter med infiltrativt växande hjärntumörer kan genomgå preoperativa kompletterande neurofysiologiska och radiologiska utredningar, såsom navigerad transkraniell magnetstimulering [8], funktionell magnetisk resonanstomografi och diffusionstensoravbildning med traktografi, för att kartlägga viktiga kortikala funktioner och subkortikala banor (Figur 1). I dessa fall kan även andra kirurgiska verktyg, såsom navigation, intraoperativt ultraljud, fluorescensteknik med 5-aminolevulinsyra (5-ALA) (Figur 2) samt intraoperativ MR, användas för att optimera precision, säkerhet och avlägsnande av tumörvävnad [9, 10]. För att minska risken för funktionsbortfall vid tumöroperationer i närheten av känsliga hjärnområden finns flera hjälpmedel för intraoperativ övervakning. Dessa inkluderar olika metoder för neurofysiologisk monitorering under generell anestesi (t ex motorisk övervakning), men även operation med lokalbedövning, så kallad vakenkirurgi [11, 12]. Med dessa metoder kan även resektion av riskfyllda och svårtillgängliga tumörer bli möjlig (t ex tumörer i insula, frontala operculum och bakre temporalloben). MR-bild före och efter kirurgi av ett gliom i vänster sidas insula visas i Figur 3.
Vid benigna tumörer kan en komplett tumörresektion resultera i att patienten botas, medan omfattande resektioner hos patienter med maligna tumörer kan förlänga överlevnaden, men sällan som en isolerad behandlingsmetod bota patienten. Då säkerheten och precisionen vid operationer av maligna tumörer har förbättrats övervägs ibland mer radikal kirurgi, så kallad supraradikal resektion, hos vissa selekterade patienter med intentionen att förbättra prognosen utan komplikationer [13, 14].
Stereotaktisk strålbehandling. Stereotaktisk strålbehandling görs i dag vid både neurokirurgiska kliniker (gammakniv) och onkologiska kliniker (linjäraccelerator eller protonstrålning). Behandlingen utförs oftast polikliniskt. Syftet är behandling av ett välavgränsat område upp till en viss storlek (<3 cm i diameter för gammakniv) med hög stråldos och minimal strålning till omkringliggande hjärnvävnad. Gammakniven, som har sitt ursprung vid Karolinska sjukhuset i Stockholm, var den första stereotaktiska strålapparaten i världen. Tekniken bygger på 3-dimensionell identifiering av ett målområde med hjälp av neuroradiologiska bilder.
Laserablation. Laserablation är en så kallad minimalinvasiv procedur, där man för in en laserkateter i tumören med samma teknik som vid biopsi. Behandlingen utförs därefter i en MR-kamera med temperaturövervakning, där vävnaden värms upp och termiskt destrueras med hjälp av ljusenergi. Behandlingen är i dag begränsad till tumörer med mindre volym och är särskilt en möjlighet vid små tumörer djupt i hjärnan som inte är tillgängliga för resektion [15].
Det är inte ovanligt att en kombination av flera metoder ingår i ett behandlingsförlopp, exempelvis hos patienter med skallbasmeningiom, där kompletterande stereotaktisk strålbehandling kan göras efter planerad subtotal resektion.
Historiskt har neurokirurgisk behandling av hjärntumörer varit förenad med stor risk. Numera är perioperativ död så ovanlig att det inte längre är ett relevant utfallsmått vid elektiv hjärntumörkirurgi [16]. Utvecklingen har även gjort att man numera kan avlägsna mer tumörvävnad med samma nivå av bevarad neurologisk funktion [11]. Opererade patienter kan utveckla olika grader av neurologiska bortfallssymtom, kognitiva deficit samt psykologiska och psykiatriska problem, och en postoperativ rehabiliteringsmedicinsk bedömning kan då vara viktig för att snabbt initiera riktad behandling av nytillkomna bortfall.
Efter den kirurgiska behandlingen vårdas patienterna på neurokirurgisk enhet, där bedömning görs avseende behov av rehabilitering och utskrivning till annan medicinsk enhet eller till hemmet. Postoperativ MR-kontroll för att bedöma resektionsgrad av misstänkta maligna förändringar ska utföras efter operation. Vid benigna tumörer görs MR-kontrollen i regel senare och planeras ofta till 3 månader efter operationen, eftersom postoperativa förändringar i MR-bilden gör den radiologiska bilden svårtolkad.
Uppföljning och prognos
Såväl maligna som benigna primära tumörer följs postoperativt radiologiskt och kliniskt. Benigna primära tumörer, huvudsakligen meningiom, följs initialt oftast av neurolog/internmedicinare eller neurokirurg, men kan senare kontrolleras inom primärvården särskilt radikalt exstirperade grad 1-tumörer. Maligna primära hjärntumörer, huvudsakligen gliom, följs av neurolog/neuroonkolog eller onkolog. Adjuvant onkologisk behandling med strålning och/eller cytostatika tillämpas beroende av malignitetsgrad, molekylära kännetecken samt patientens kliniska status och ålder; i dag kan man tack vare molekylära kännetecken för vissa patientkategorier bättre stratifiera den adjuvanta behandlingen [17]. Mer detaljerad information om uppföljning och behandling utöver neurokirurgisk tumörkirurgi beskrivs i det nationella vårdprogrammet och i de europeiska riktlinjerna [6, 18, 19].
Prognosen för patienter med primära hjärntumörer är individuell, och diagnos, malignitetsgrad (WHO grad 1‒4), resektionsgrad samt effekt av eventuell adjuvant onkologisk behandling är avgörande.
På multidisciplinära konferenser diskuteras fortsatta kontroller och behandling, och vid återfall kan reoperation aktualiseras. Detta kräver dock alltid en individuell bedömning, där patientens ålder, funktionsstatus, tidigare svar på onkologisk behandling, tumörlokalisation, histopatologisk diagnos, komplikationsrisk och nyttan av en eventuell reoperation måste övervägas. Reoperation vid maligna tumörer förutsätter också att kompletterande onkologisk behandling finns att tillgå [6].
Diskussion
Det finns många olika kirurgiska behandlingsmetoder för patienter med hjärntumörer. Under det senaste decenniet har en betydande teknisk utveckling ägt rum, som gör det möjligt att behandla patienter med större precision och mindre risk. Förbättrad preoperativ kartläggning av tumören och av angränsande anatomiska och funktionella hjärnområden, avancerad mikrokirurgisk teknik och andra visualiseringstekniker samt nya minimalinvasiva tekniker gör det i dag möjligt att planera och utföra tumöringrepp som tidigare ansågs vara för riskabla.
Samtidigt pågår utvecklingen av nya neurokirurgiska tekniker, exempelvis högintensivt fokuserat ultraljud, där kraftiga ultraljudsvågor riktas mot tumören utan att påverka omkringliggande hjärnvävnad i samma omfattning. En annan möjlig behandling är brakyterapi eller intern strålning, där kirurgen inplanterar en strålkälla direkt i tumören. Tekniken har använts tidigare utan något stort kliniskt genombrott, men tack vare nya isotoper med bättre säkerhet och mindre risk för strålningsrelaterade biverkningar pågår nu flera studier i hopp om att utveckla denna teknik [20]. Sammanfattningsvis utvecklas hjärntumörkirurgin kontinuerligt med förhoppningen att kunna erbjuda framtidens patienter allt bättre och säkrare behandlingsmetoder.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna
Fakta 1. Kriterier för start av utredning enligt standardiserat vårdförlopp [6]
Välgrundad misstanke föreligger vid ett eller flera av följande fynd:
- Epileptiskt förstagångsanfall (fokalt eller generaliserat).
- Debut av fokalt neurologiskt bortfallssymtom (t ex halvsidig förlamning, koordinations-/balanssvårigheter, känselnedsättning, synfältsbortfall eller dysfasi/talpåverkan) progredierande över dagar eller veckor utan andra sannolika förklaringar, som känd multipel skleros eller känd metastaserad cancersjukdom.
- Nytillkommen personlighetsförändring eller kognitiv nedsättning progredierande över veckor eller ett fåtal månader.
- Nytillkommen huvudvärk eller markant förändring i tidigare huvudvärksmönster (särskilt vid förekomst av illamående, kräkningar, staspapill eller andra symtom/fynd talande för ökat intrakraniellt tryck) som progredierar över veckor och där grundlig sjukhistoria och klinisk neurologisk undersökning inte har påvisat andra sannolika förklaringar.
- DT- eller MR-undersökning (utförd på andra indikationer) som föranleder misstanke om primär malign hjärntumör. Om radiologiska fynd talar för meningiom, hypofysadenom eller schwannom ska patienten dock utredas enligt ordinarie rutiner och inte remitteras till standardiserat vårdförlopp.