Ett flertal olika tillstånd i hjärtat ökar risken för ischemisk stroke och TIA.
Primärprevention av ischemisk stroke med orala antikoagulantia är angelägen till exempel vid mekanisk hjärtklaffprotes och förmaksflimmer med förhöjd strokerisk.
Sekundärprevention efter inträffad stroke eller TIA till följd av kardiell emboli är mycket viktig för att förhindra förnyad stroke.
Samtidig förekomst av hjärtsjukdom och andra orsaker till stroke är vanlig.
Slutning av öppetstående foramen ovale är ofta av värde vid ischemisk stroke utan annan påvisbar orsak hos personer 60 år eller yngre.
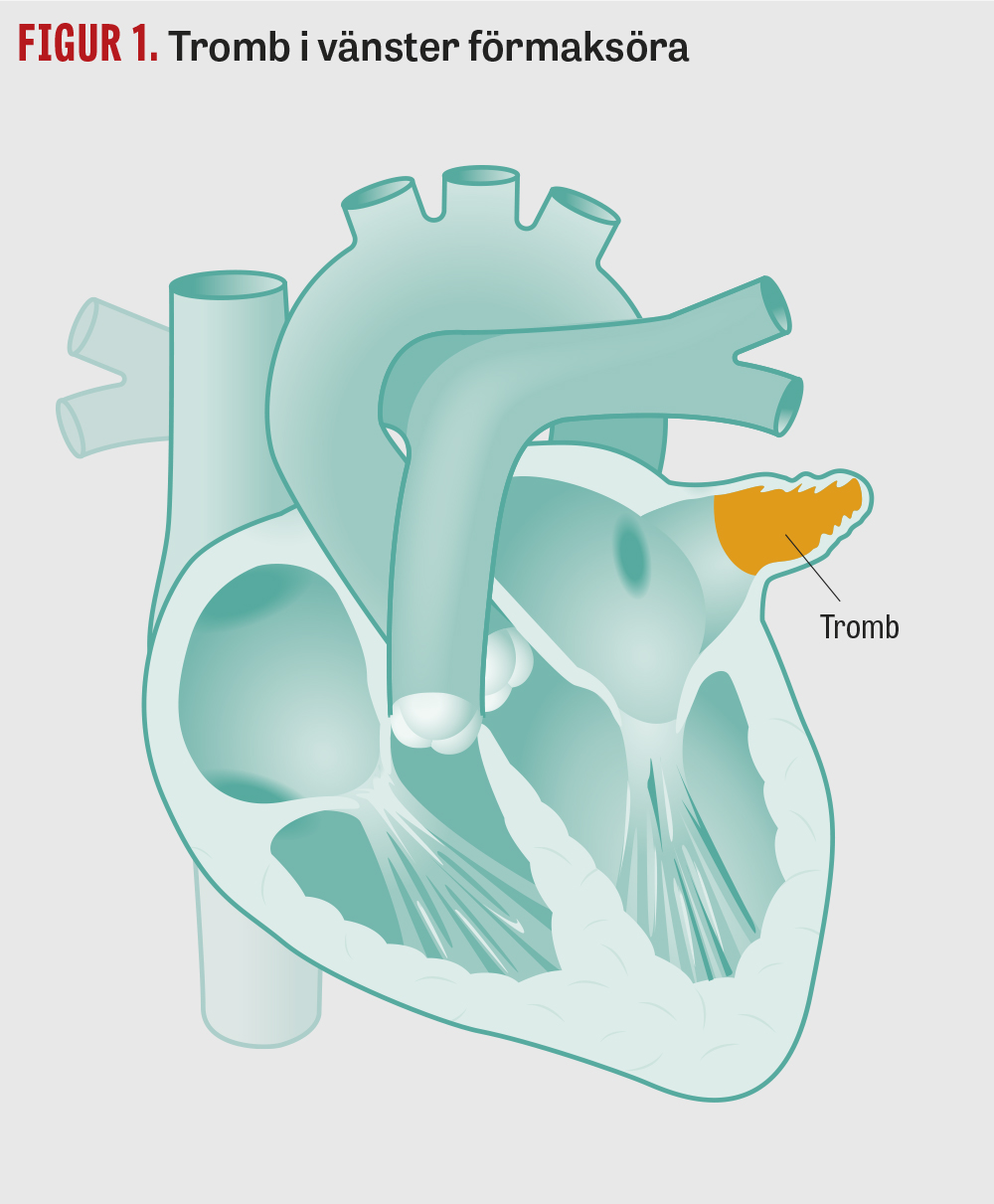
Den vanligaste orsaken till att hjärtsjukdom ger upphov till ischemisk stroke är att en tromb bildas i hjärtats vänstra förmak eller kammare och sedan emboliserar till hjärnan. Olika typer av hjärtsjukdom har associerats med varierande risk; ofta delar man upp tillstånden i större respektive mindre potentiella källor (Fakta 1). Det har angetts att insjuknandet ofta är plötsligt [1, 2] och att det är stora bortfall [1, 3], men man kan inte kategoriskt utesluta kardiell emboli även vid till exempel amaurosis fugax [4] eller tecken på lakunär infarkt (se Fakta 2) i hjärnan [5]. Det är också vanligt att embolisering sker till olika kärlterritorier i hjärnan, såväl inom främre (karotisterritoriet) som bakre (vertebrobasilaristerritoriet) cirkulationen [1].
Förmaksflimmer
Embolisering vid förmaksflimmer bedöms orsaka cirka 20 procent av alla ischemiska stroke hos individer under 80 år och cirka 40 procent hos individer över 80 år [6]. Den vanligaste mekanismen är att det uppstår en tromb i vänster förmaksöra (Figur 1) som sedan emboliserar till hjärnan [7-9].
Diagnostik av förmaksflimmer. Vid insjuknande i TIA eller ischemisk stroke hos patient med sinusrytm är det viktigt att söka efter förekomst av paroxysmalt förmaksflimmer. I akutskedet är, förutom vilo-EKG, övervakning med telemetri eller bandspelar-EKG under 1–3 dygn numera klinisk rutin på de flesta av landets strokeenheter. Denna basutredning kompletteras ibland polikliniskt med handhållen tum-EKG eller ytterligare bandspelar-EKG och i vissa speciellt utvalda fall implanterbar hjärtövervakare (loop-recorder). Längre tids poliklinisk EKG-screening med plåster kan vara ett ytterligare alternativ, och effekten testas för närvarande i en nationell randomiserad studie i Sverige (https://afspice.com).
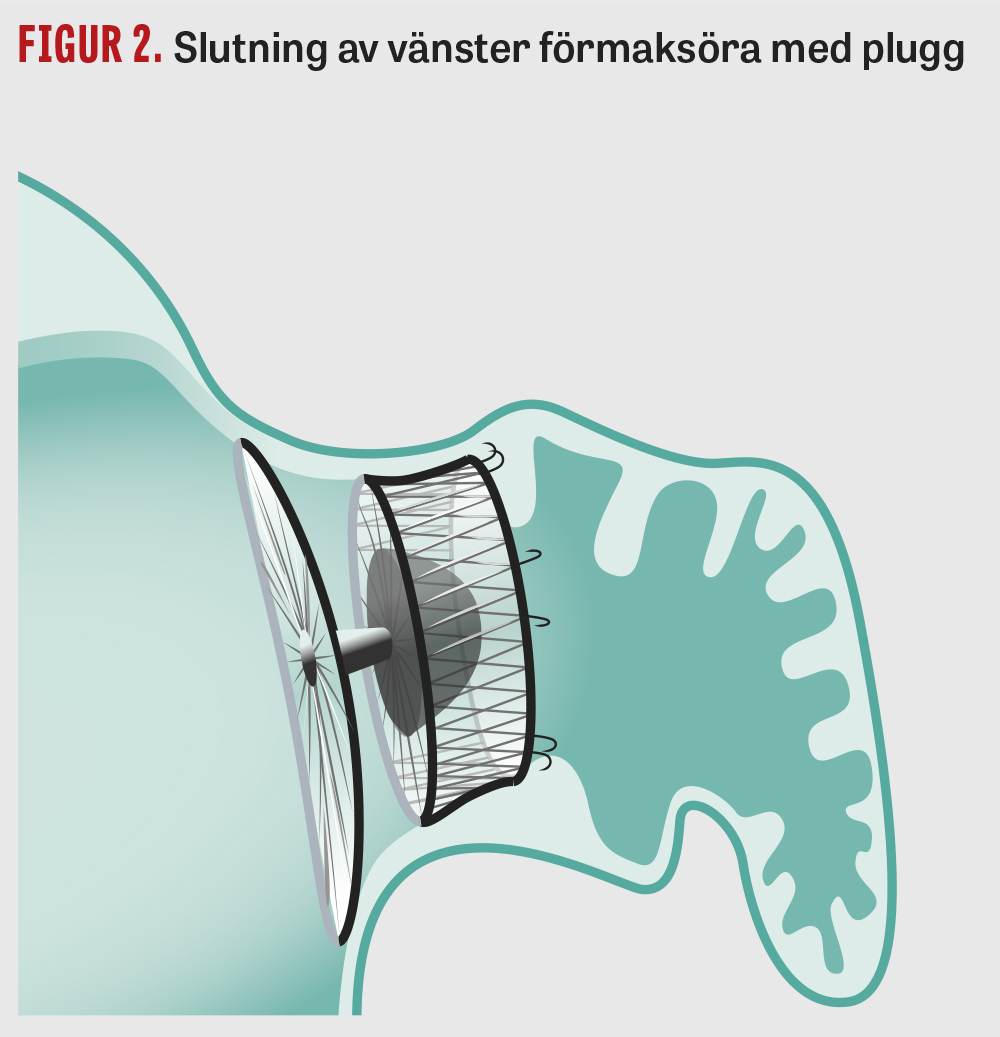
Riskbedömning vid förmaksflimmer. Risken för embolisering till hjärnan vid förmaksflimmer varierar beroende på ett antal faktorer. Vanligtvis brukar man använda beslutsstödet CHA2DS2-VASc [10] för att bedöma risken. Tabell 1 visar CHA2DS2-VASc och ungefärlig risk. Andra metoder för riskbedömning har också föreslagits, till exempel ABC-metoden [11]. Risk för kardioembolisk stroke föreligger både vid kroniskt förmaksflimmer och vid paroxysmalt förmaksflimmer [12]. Behandling med antitrombotiska läkemedel medför ökad risk för allvarliga blödningar. För blödningsrisk hos patienter med förmaksflimmer används ofta HAS-BLED [13] (Tabell 2), där en hög blödningsrisk (HAS-BLED = 4–6) emellertid inte i sig utgör kontraindikation för behandling med antikoagulantia. I den pågående ABC AF-studien utvärderas om behandlingsrekommendationer baserade på ABC-riskskattning med biomarkörer för stroke och blödning kan minska risken för stroke och död jämfört med standardbehandling vid förmaksflimmer (https://www.ucr.uu.se/abcafstudy/).
Antitrombotisk behandling vid förmaksflimmer. Vid konstaterat förmaksflimmer finns en stark rekommendation för oral antikoagulantiabehandling (OAK) om CHA2DS2-VASc-poäng är 2 eller högre hos män och 3 eller högre hos kvinnor [12]. OAK kan också vara aktuellt vid CHA2DS2-VASc-poäng 1 hos män och 2 hos kvinnor, men indikationen är svagare och individuell bedömning behövs [12]. Användning av icke-vitamin K-antagonist (NOAK) rekommenderas framför warfarin om det inte finns speciella omständigheter [12, 14, 15]. Trombocythämmare, såsom acetylsalicylsyra (ASA) och klopidogrel, används vanligtvis ej.
En specialsituation är att patienter med förmaksflimmer ibland har samtidig ischemisk hjärtsjukdom, då trombocythämmarbehandling skulle kunna vara av värde, men kombinationen av behandling med antikoagulantia och trombocythämmare kan öka risken för allvarlig blödning, varför det är oklart när kombinationsbehandling kan ges. Det kan övervägas i utvalda fall, till exempel hos personer med pågående aktiv ischemisk hjärtsjukdom eller nylig PCI-behandling (perkutan koronarintervention) med stentning [12, 16]. Förekomst av cerebral småkärlssjukdom eller cerebrala mikroblödningar kan öka blödningsrisken, men utgör i sig inte en kontraindikation för antikoagulantiabehandling vid förmaksflimmer [12, 16]. Det är inte helt ovanligt att patienter med förmaksflimmer insjuknar med ischemisk stroke i samband med att antikoagulantiabehandlingen tillfälligt satts ut. Man bör därför noga överväga om och hur länge det är rimligt sätta ut antikoagulantiabehandling vid olika typer av åtgärder. Okomplicerad tandextraktion kan till exempel genomföras under pågående antikoagulation [17].
Nyligen publicerade resultat visar att det ofta kan vara säkert att sätta in behandling med NOAK till patienter med förmaksflimmer tidigt (inom 4 dagar) efter insjuknande i ischemisk stroke [18].
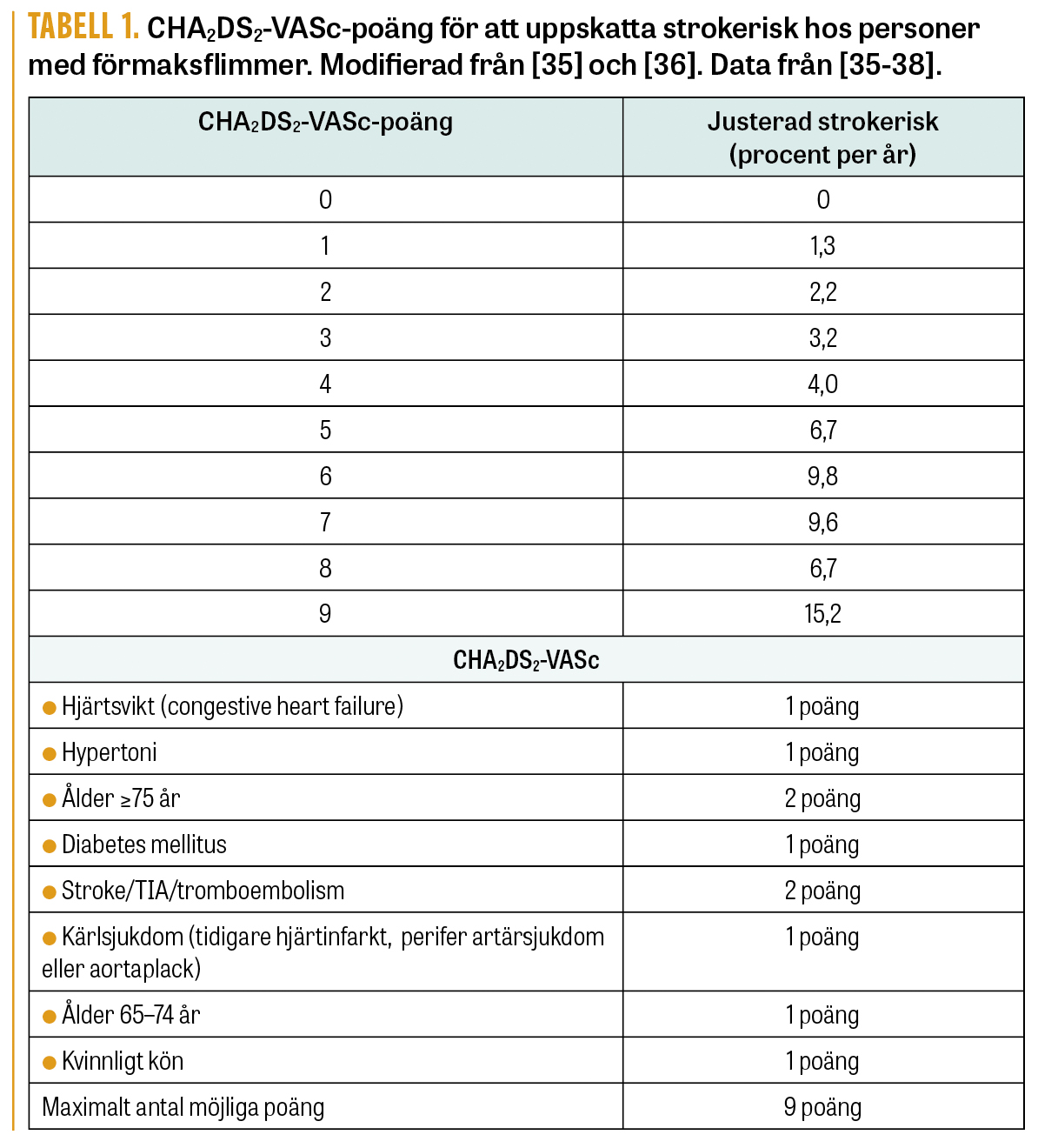
Slutning av vänster förmaksöra vid förmaksflimmer. Om kontraindikation för antikoagulantiabehandling föreligger har det föreslagits att endovaskulär slutning av vänster förmaksöra, så kallad förmaksöreplugg, kan vara en alternativ åtgärd (Figur 2) vid förmaksflimmer [14]. Graden av kontraindikation för antikoagulantiabehandling vid förmaksflimmer och blödning kan variera. Vid intracerebral blödning är exempelvis risken för ny blödning större vid cerebral amyloid angiopati (se artikel om hjärnblödning i detta tema) än vid hypertonirelaterad blödning där blodtrycket bringats under kontroll. Forskningsstudier pågår för närvarande för att utvärdera behandling med slutning av vänster förmaksöra vid förmaksflimmer. Även i Sverige pågår randomiserade studier av förmaksöreplugg vid förmaksflimmer och ischemisk stroke (https://classic.clinicaltrials.gov/ct2/show/NCT03642509) respektive vid förmaksflimmer och intracerebral blödning (https://classic.clinicaltrials.gov/ct2/show/NCT02830152). Inklusion av patienter i studier kring dessa tillstånd är att rekommendera.
Lipidsänkande behandling efter stroke på grund av förmaksflimmer. Vi känner inte till RCT-studier som specifikt undersöker frågan kring lipidsänkning efter stroke vid förmaksflimmer. Dock anger Socialstyrelsen i sina riktlinjer att »hälso- och sjukvården bör erbjuda behandling med statin till personer med ischemisk stroke eller TIA« [19].
Akut hjärtinfarkt
Omkring 2–3 procent av dem som får akut stroke har rapporterats ha samtidig akut hjärtinfarkt [14, 20]. Ett diagnostiskt problem är dock att såväl akut ischemisk [21] som hemorragisk stroke kan ge stegrade troponinnivåer trots avsaknad av akut koronart syndrom. Den bakomliggande mekanismen har föreslagits vara ett ökat katekolaminpåslag med påverkan på kardiomyocyter [21]. Risken för trombbildning i vänster kammare är ökad, framför allt vid transmural anterior hjärtinfarkt [22]. Behandling med OAK i upp till 6 månader efter akut hjärtinfarkt med påvisad tromb i vänster kammare på hjärtat har rekommenderats [23]. Det är möjligt att NOAK kan vara ett alternativ till warfarin i denna situation [24].
Mekanisk hjärtklaffprotes
Mekanisk hjärtklaffprotes i aorta- eller mitralisklaffposition utgör en stor risk för cerebral emboli. För patienter med mekanisk hjärtklaffprotes rekommenderas antikoagulantiabehandling med warfarin [25]. En studie som jämförde dabigatran med warfarin avbröts i förtid på grund av fler komplikationer bland dem som behandlades med dabigatran [25].
Hjärtsvikt
Patienter med hjärtsvikt har ökad risk för ischemisk stroke. Denna ökade risk ses vid såväl hjärtsvikt med nedsatt ejektionsfraktion (HFrEF) och hjärtsvikt med bevarad efjektionsfraktion (HFpEF) [26]. Det är omdiskuterat huruvida, och i så fall när, patienter i sinusrytm med hjärtsvikt och nedsatt ejektionsfraktion ska behandlas med oral antikoagulantiabehandling (warfarin), trombocythämmare eller kombinerat OAK och trombocythämmare [14, 27]. Det finns dock ej stöd för att rutinmässigt ge antikoagulantiabehandling till dessa patienter [27] – en minskad risk för ischemisk stroke sker på en bekostnad av ökad risk för allvarliga blödningar varför en individuell bedömning är nödvändig.
Öppetstående foramen ovale
Förekomst av öppetstående foramen ovale (PFO) är vanligt förekommande i befolkningen (ca 20–25 procent) och relaterad till en något ökad risk för stroke.
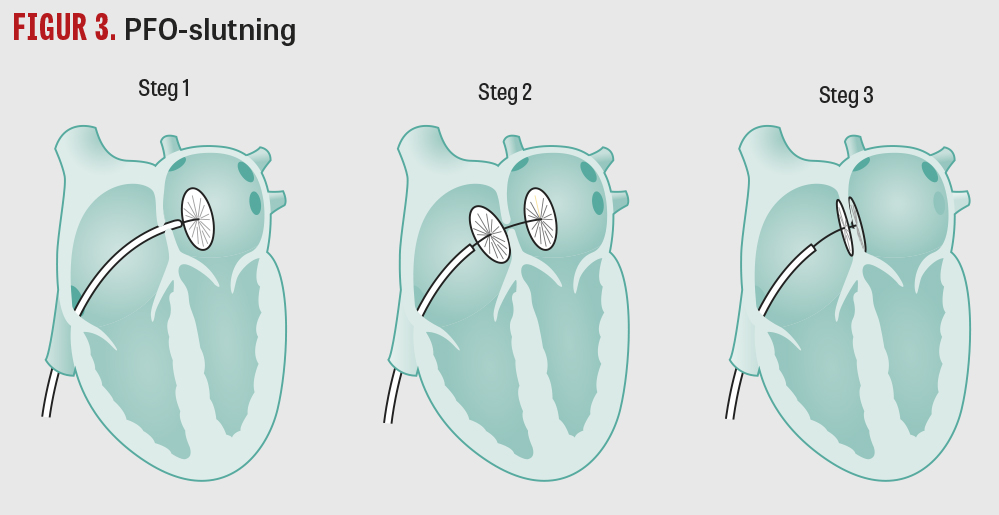
Under 2017 publicerades flera studier som visade att det kan vara av värde att endovaskulärt sluta PFO (Figur 3) hos personer 60 år eller yngre med ischemisk stroke utan annan tydlig orsak som till exempel lakunär infarkt, storkärlssjukdom, eller förmaksflimmer [28-30].
Socialstyrelsens nationella riktlinjer för vård vid stroke rekommenderar att hälso- och sjukvården erbjuder endovaskulär slutning av PFO till personer med kryptogen stroke med öppetstående foramen ovale (PFO) och påpekar att åtgärdens effekt är visad på patienter upp till och med 60 år [19].
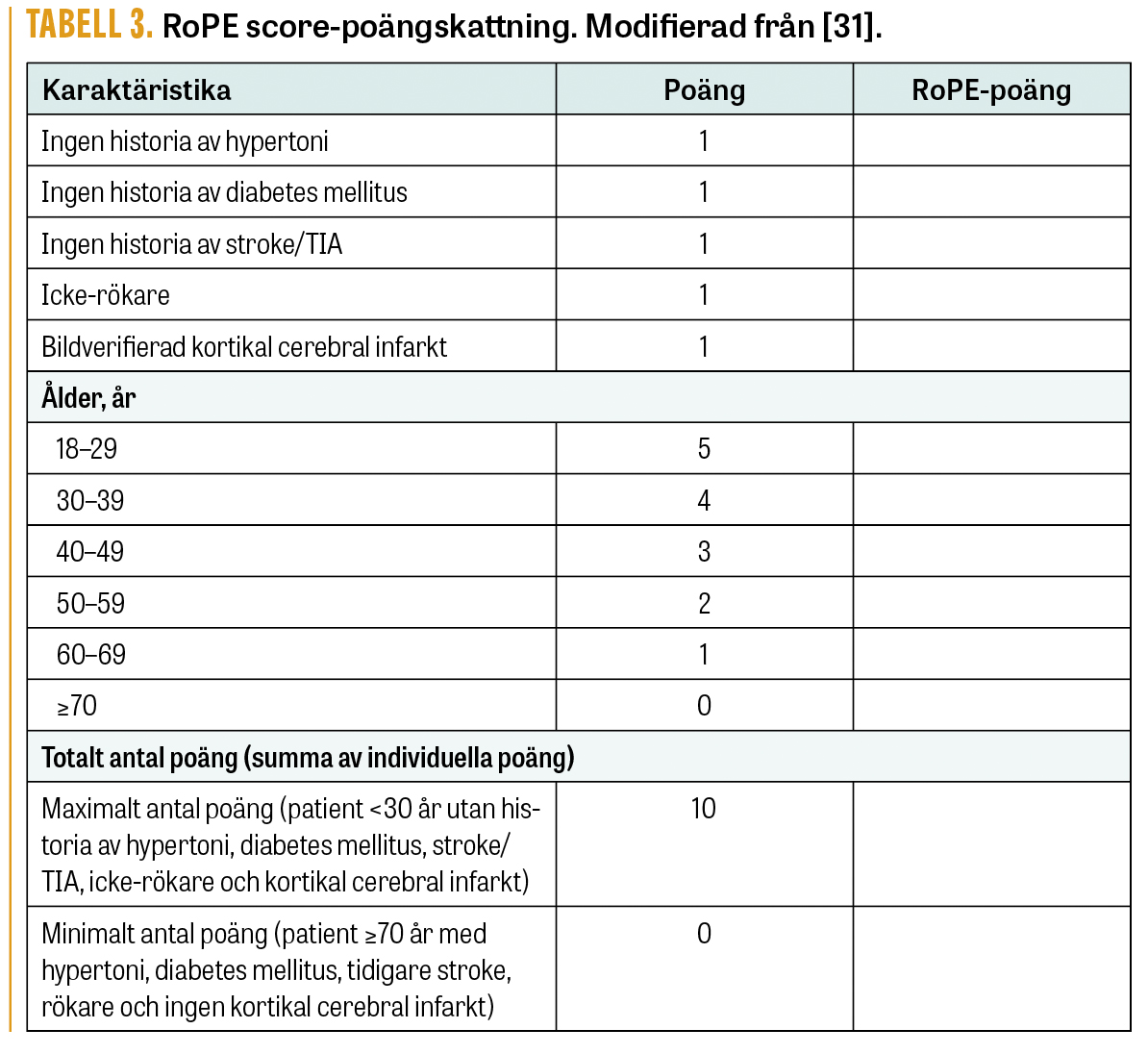
Man kan använda den så kallade RoPE-skalan (risk of paradoxical embolism) för att bedöma betydelse av PFO vid ett strokeinsjuknande (Tabell 3) [31]. Således finns indikation för slutning av PFO hos personer 60 år eller yngre när kriterier enligt de utförda studierna uppfyllts, och eventuellt kan åtgärden övervägas för personer vid 61–65 års ålder efter individuell bedömning i enstaka fall.
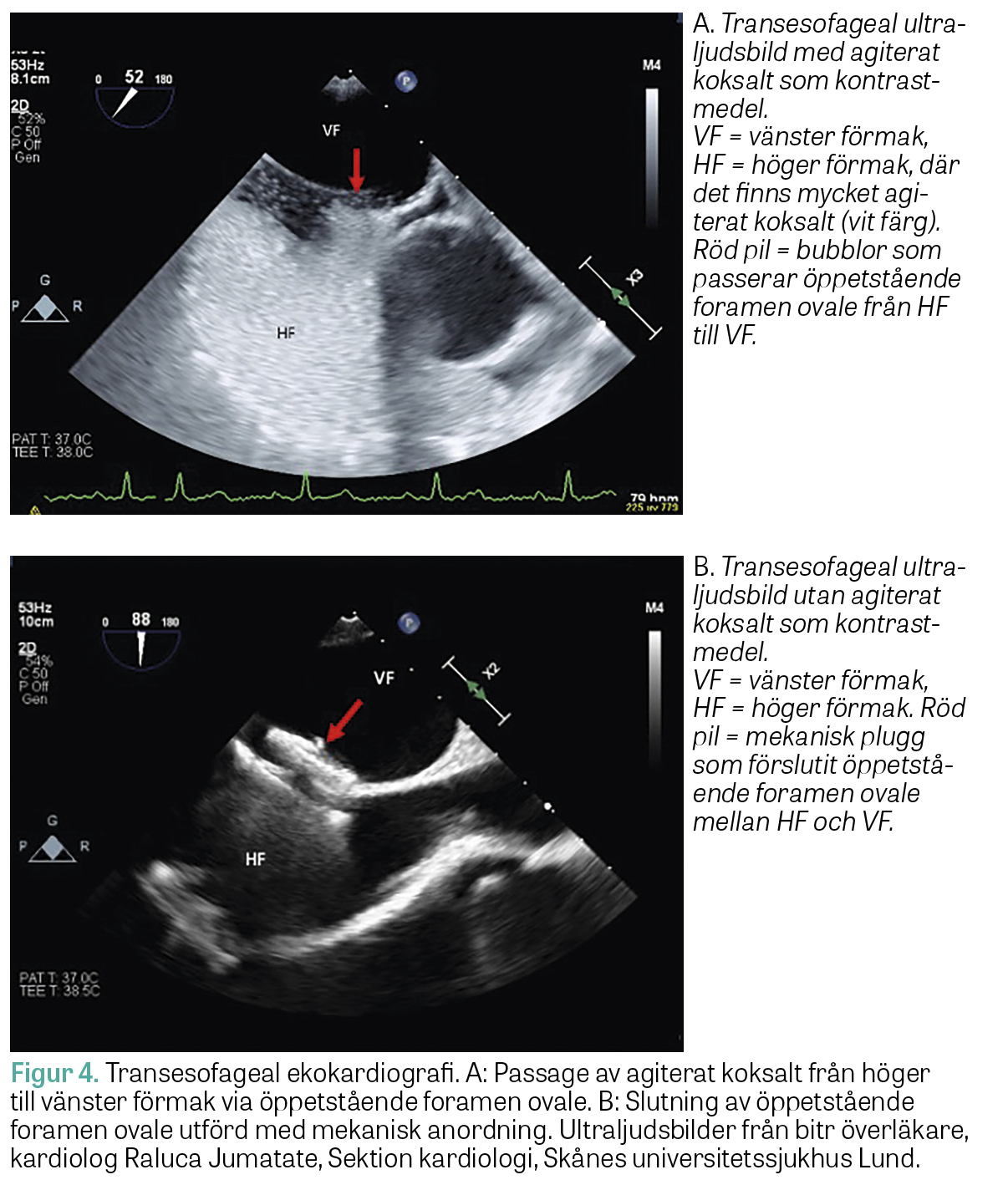
Många faktorer behöver beaktas – detaljerade riktlinjer för utredning och handläggning finns beskrivet av Svenska regioner i samverkan, Nationellt system för kunskapsstyrning Hälso- och sjukvård [32]. Förekomst av PFO kan diagnostiseras med transtorakal ekokardiografi. Vanligen genomförs undersökningen med intravenös »agiterad« koksaltinjektion då små mikrobubblor kan ses övergå till vänster förmak inom 2–5 hjärtslag. Ibland ses övergång endast i samband med valsalvamanöver. Transesofageal ekokardiografi brukar inte användas som screeningmetod för detta utan används företrädesvis för att bedöma anatomiska förhållande hos patienter där slutning av PFO övervägs (Figur 4). Nyttan av slutning av PFO har inte visats i randomiserade kontrollerade studier för patienter med TIA utan förekomst av bildverifierad cerebral infarkt eller för personer utan stroke, men metoden har föreslagits som alternativ i mycket speciella situationer (till exempel för professionella dykare) [33].
Efter slutning av PFO brukar patienter rekommenderas behandling med trombocythämmare såsom ASA, till exempel 160 mg × 1 ASA i 6 månader efter slutning, följt av 75 mg × 1 därefter.
Sammanfattning
Ett flertal olika tillstånd i hjärtat kan relateras till ischemisk stroke. Aktuella studier visar att individualiserad utredning och handläggning är av största vikt för att minska riskerna för nya insjuknanden.
Potentiella bindningar eller jävsförhållanden: Arne G Lindgren har forskningsanslag från Hjärt–lungfonden, Vetenskapsrådet, ALF, Frimurarestiftelsen Eos Lund, Lunds universitet, Region Skåne och National Institutes of Health, har varit nationell prövningsledare i Navigate-ESUS-studien och PACIFIC-Stroke-studien, medförfattare av riktlinje för handläggning av kryptogen stroke (slutning av PFO) publicerad av Nationellt system för kunskapsstyrning Hälso- och sjukvård samt erhållit arvode för rådgivande kommitté/föreläsningar från Astra Zeneca, Bayer, Bristol-Myers Squibb, Pfizer och Portola Pharmaceuticals. Per Wester har forskningsanslag från Hjärt–lungfonden, Vetenskapsrådet, ALF och Frimurarstiftelsen i Umeå, var faktagruppsordförande vid framtagande av Socialstyrelsens strokeriktlinjer, är huvudprövare i Strokeclose-studien, strokeansvarig i studien AF-Spice och medlem i styrgrupp i studierna Timing och Occlusion-AF samt har erhållit arvode för »clinical event committee« i Portico-studier från Abbott.
Fakta 1. Potentiella källor, modifierad efter [34].
Större potentiella källor
- Förmaksflimmer (ej ekokardiografidiagnos)
- Färsk (<3 mån) hjärtinfarkt
- Tromb i vänster förmak/kammare
- Dilaterad kardiomyopati (EF ≤35 procent)
- Mitralisstenos
- Myxom
- Mekanisk klaffprotes
- Infektiös endokardit
- Icke-infektiös endokardit
Mindre potentiella källor
- Öppetstående foramen ovale (PFO)
- Förmaksseptumaneurysm
- Mitralklaffprolaps
- Mitralringsförkalkning
- Förkalkad aortastenos
- Spontan ekokontrast
- Annan (AV-block II, pre-excitation etc)
Fakta 2. Stroke på grund av lakunär infarkt
Stroke på grund av lakunär infarkt kan definieras som stroke där bildgivande diagnostik visar fynd som vid ischemisk skada, belägen inom en enstaka cerebral penetrantartärs område med lokalisation överensstämmande med kliniska symtom som ofta är av typen lakunärt syndrom [5]. Utan bildgivande diagnostik är det svårt att helt säkerställa att en patients stroke beror på lakunär infarkt. Mekanismen för lakunär infarkt anses oftast bero på lokal småkärlssjukdom i penetrantartären, men möjligheten till andra mekanismer till exempel kardiell emboli anses också kunna föreligga [5].