Intracerebrala hematom (ICH) utgör var 7:e till 8:e stroke och har en dödlighet kring 34 procent inom 3 månader.
Cirka 85 procent orsakas av småkärlssjukdom och resterande 15 procent har varierande orsaker, såsom kärlmissbildning eller fistel, kavernom, tumör eller cerebral venös trombos.
Målet vid akut handläggning är att minska risken för fortsatt hematomexpansion, stabilisera patienten och utreda etiologin.
Tidig prognostisering, inom 24 timmar efter debut, har ofta otillräcklig precision. Internationella riktlinjer rekommenderar att man väntar med eventuella behandlingsbegränsningar till 24–48 timmar efter insjuknandet.
Indikationer för intensivvård i akutskedet är bredare än indikationer för neurokirurgi och bör bedömas separat.
Neurokirurgi är livräddande i selekterade fall, men effekten på funktionsmässigt utfall är i dagsläget osäker.
Trots flera randomiserade prövningar är nyttan av kirurgi vid ICH fortsatt omdiskuterad, förutom vid hydrocefalus och expansiva lillhjärnsblödningar, och det är vanskligt att fastslå entydiga behandlingskriterier.
Spontant intracerebralt hematom (ICH) utgörs av en blödning i hjärnans parenkym eller ventrikelsystem utan föregående trauma. Varje år får cirka 3 000 personer ICH i Sverige, och medelåldern vid insjuknande är 73 år [1]. Orsakerna till ICH kan grovt delas upp i mikrovaskulär (85 procent) och makrovaskulär (15 procent) genes.
ICH med mikrovaskulär genes uppstår efter en ruptur av hjärnans små ändartärer och arterioler. De vanligaste etiologierna vid denna genes är arterioloskleros relaterad till kronisk hypertoni och andra cerebrovaskulära riskfaktorer samt cerebral amyloid angiopati. Högt blodtryck är den starkaste riskfaktorn för mikrovaskulär ICH oavsett lokalisation, men är särskilt kopplat till blödningar i basala ganglier, talamus, hjärnstam och cerebellum. Cerebral amyloid angiopati ger inlagring av amyloid beta-protein i väggen i kortikala och leptomeningeala artärer, som försörjer storhjärnans bark och subkortikala vitsubstans, och är en viktig orsak till ytliga (lobära) blödningar. Andra riskfaktorer för cerebral småkärlssjukdom, såsom diabetes mellitus, högt alkoholintag, rökning och vissa genetiska varianter (apolipoprotein E epsilon 4 och epsilon 2 med flera), höjer också risken för ICH, liksom manligt kön och stigande ålder.
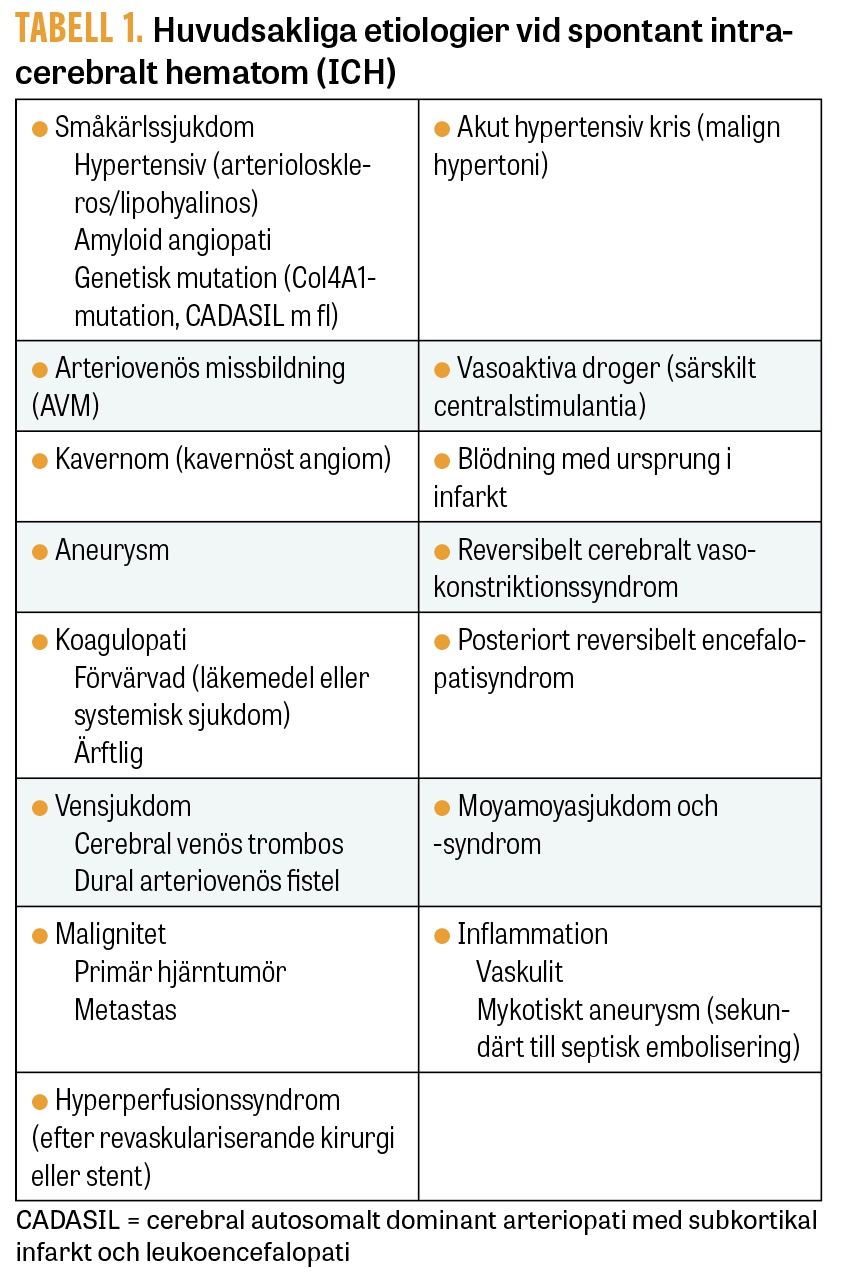
Makrovaskulära orsaker till ICH inkluderar kärlanomalier, såsom arteriovenösa missbildningar samt fistlar, kavernom och aneurysm, men också metastaser och primära hjärntumörer. Makrovaskulära orsaker till ICH är vanligare hos yngre patienter (<70 år). Ytterligare orsaker till ICH är cerebral venös trombos, reversibelt cerebralt vasokonstriktionssyndrom, vaskulit och centralstimulerande droger. Tabell 1 sammanfattar huvudsakliga etiologiska kategorier vid ICH.
Patofysiologi och prognos
Under 1970-talet formulerade neurologen C Miller Fisher hypotesen om uppkomsten av hematom orsakade av småkärlssjukdom. Blödningen inleds med ruptur av en sjuk småartär eller arteriol med en diameter kring 0,2 mm eller mindre. Blodutgjutningen skjuver av ytterligare sköra småkärl i närheten, vilket bidrar till att hematomet ökar i storlek [2]. Hastigheten och omfattningen av blödningen är en funktion av bland annat storleken på det första rupturerade kärlet, hur sköra närliggande småkärl är, hemostasens effektivitet och det systemiska blodtrycket. Hos var tredje patient expanderar blödningen mellan den första akuta avbildningen och uppföljande radiologi, som sker inom ett dygn [3]. Stora hematom kan ge en intrakraniell tryckstegring eftersom den intrakraniella volymen är begränsad. Blödningar som komprimerar eller bryter igenom till ventrikelsystemet kan försämra likvorcirkulationen, med hydrocefalus och intrakraniell tryckstegring som följd. Infratentoriellt kan även mindre ICH ha påtaglig masseffekt på grund av begränsat utrymme i bakre skallgropen.
Trots att ICH utgör en mindre del av strokeinsjuknanden globalt (10‒30 procent) står sjukdomen för en oproportionellt hög andel av den strokerelaterade mortaliteten och morbiditeten [4]. I Sverige avlider cirka 34 procent inom 90 dagar [5]. Viktiga prognostiska faktorer inkluderar hög ålder, blödningsstorlek (prognostiskt relevanta gränsvärden är <30 ml, 30‒60 ml och >60 ml), medvetandegrad vid ankomst till sjukhus, blödningslokal, ventrikelgenombrott, hydrocefalus samt komorbiditeter, såsom diabetes typ 2 och ischemisk hjärtsjukdom [6, 7]. Flera studier har visat att prognostisering i det urakuta skedet har dålig precision och att behandlingsbegränsningar under första dygnet riskerar att bli en självuppfyllande profetia med dåligt utfall som resultat [8, 9]. Därför rekommenderar amerikanska och tyska behandlingsriktlinjer att man väntar med att ta ställning till eventuella behandlingsbegränsningar tills det gått 24‒48 timmar från insjuknandet, om det inte finns entydiga tecken på dålig prognos [10, 11].
Diagnostik och etiologi
Patienter med ICH insjuknar ofta plötsligt och har en snabb utveckling av fokalneurologiska bortfall. Medvetandesänkning och akut huvudvärk har traditionellt kopplats till tillståndet, men saknas hos många patienter, och symtomen förekommer även vid ischemi. Initial anamnes bör täcka tidpunkten för insjuknande och förlopp, eventuellt trauma, läkemedel som påverkar koagulation (inklusive tid för senaste intag), hypertoni, övrig samsjuklighet och funktionsnivå i vardagen. Hos alla patienter utförs skattning av symtom enligt National Institutes of Healths strokeskala och medvetandegrad enligt Glasgow coma scale eller Reaction level scale 85.
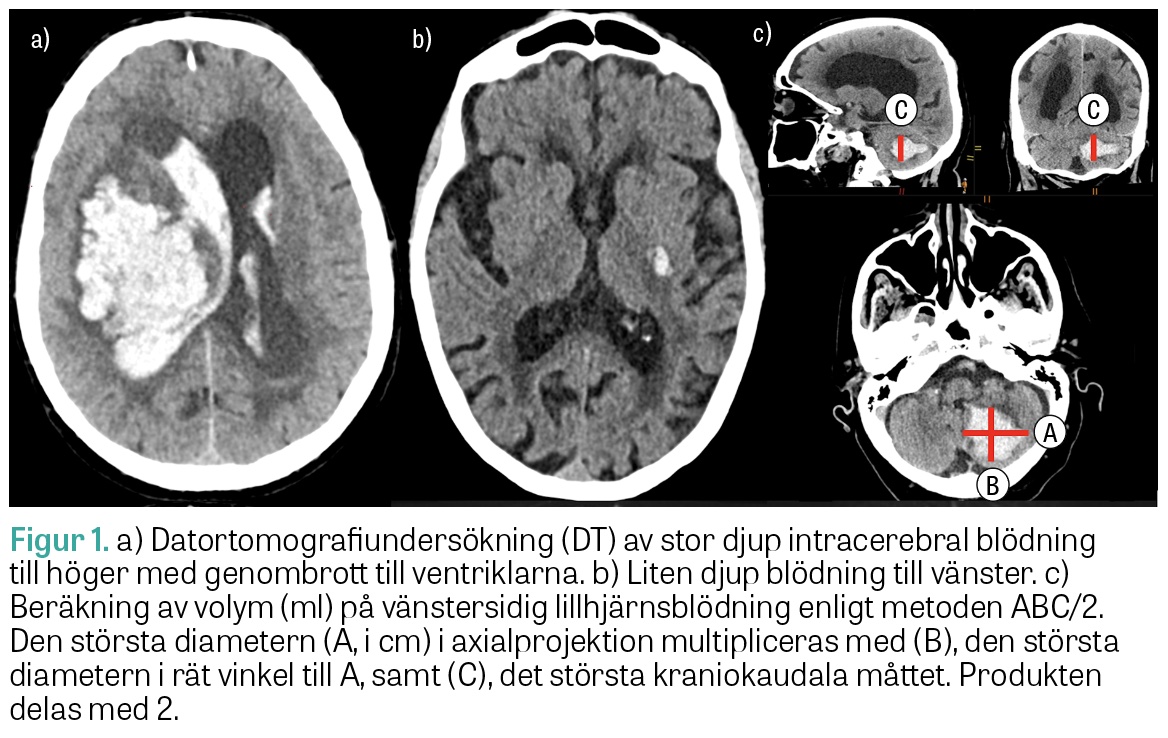
Datortomografi (DT) och magnetresonanstomografi (MRT) har hög sensitivitet och specificitet för ICH, och DT är oftast förstahandsmetod i akutskedet. Utlåtandet bör innehålla information om blödningens lokalisation, utbredning, volym (ofta används metoden ABC/2, se Figur 1), ventrikelgenombrott, påverkan på angränsande strukturer, medellinjeöverskjutning och radiologiska tecken på hydrocefalus samt degenerativa vitsubstansförändringar och äldre parenkymskador som kan ge etiologisk vägledning.
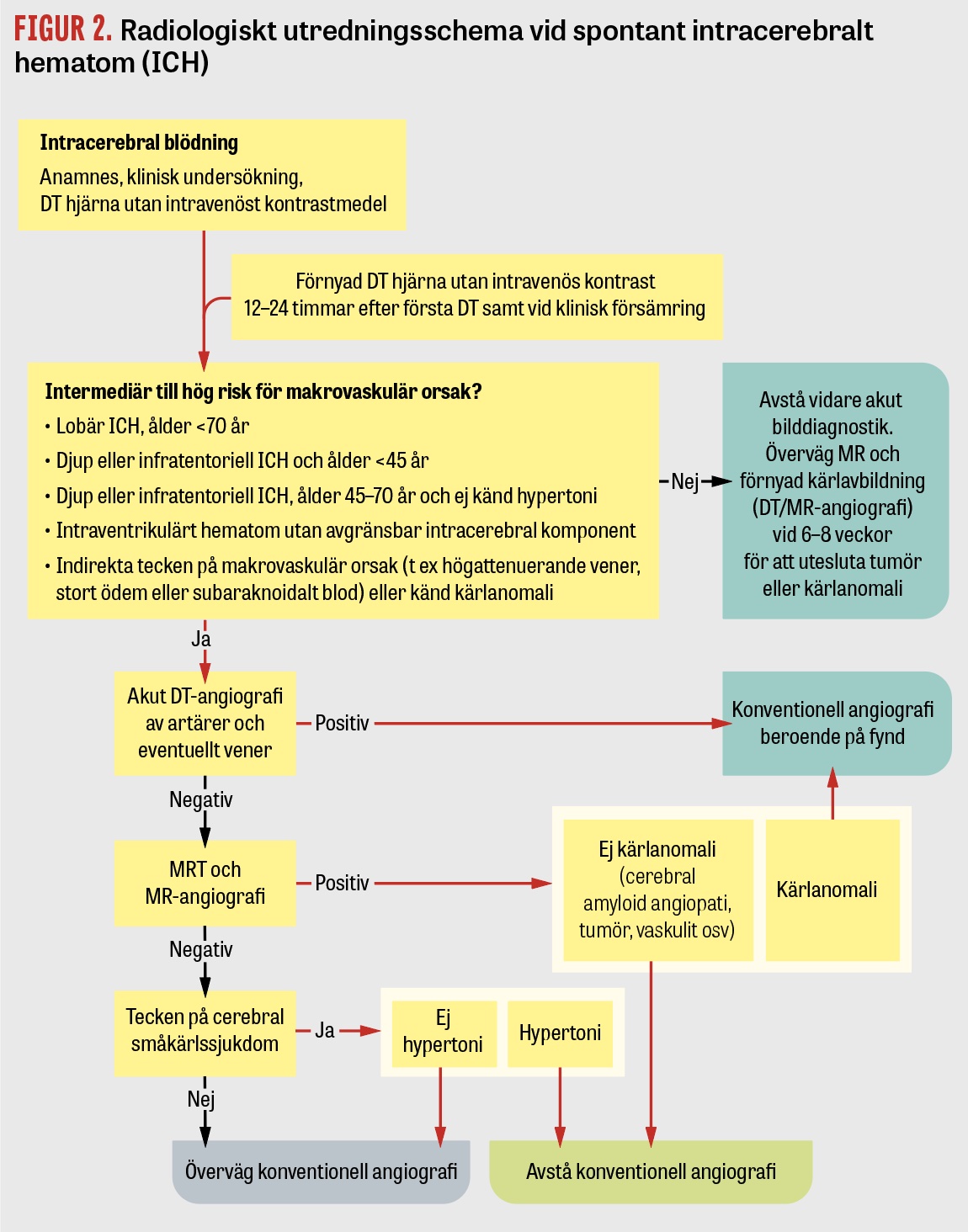
För att akut utesluta makrovaskulära och andra viktiga orsaker till ICH är kompletterande radiologi ofta indicerad, sammanfattat i Figur 2. DT-angiografi i artärfas visar arteriell patologi, medan DT med kontrastmedel i venös fas (venografi) utförs vid misstanke om cerebral venös trombos. Konventionell angiografi (kateterburen digital subtraktionsangiografi) är indicerad om DT-angiografi visar tecken på arteriovenös missbildning, arteriovenös fistel eller aneurysm och i vissa fall som led i vaskulitutredning.
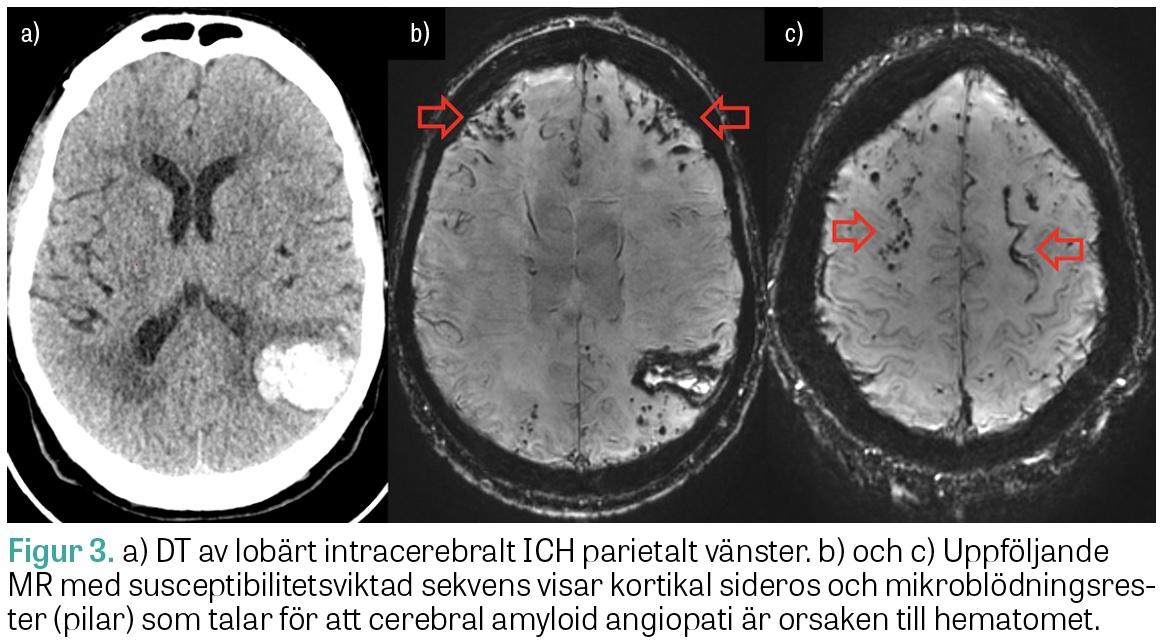
MRT är motiverad subakut (under de första dygnen) om DT-angiografi varit negativ men patienten bedöms ha intermediär till hög risk för makrovaskulär, malign eller venös orsak till ICH. Om den akuta/subakuta utredningen har varit negativ kan MRT hjärna vara motiverad efter 6–8 veckor, då blödningen till stor del resorberats, för att identifiera eventuell tumör eller kärlanomali som initialt kan ha döljts av hematomet samt för att kartlägga mikroangiopatiska fynd förenliga med exempelvis cerebral amyloid angiopati.
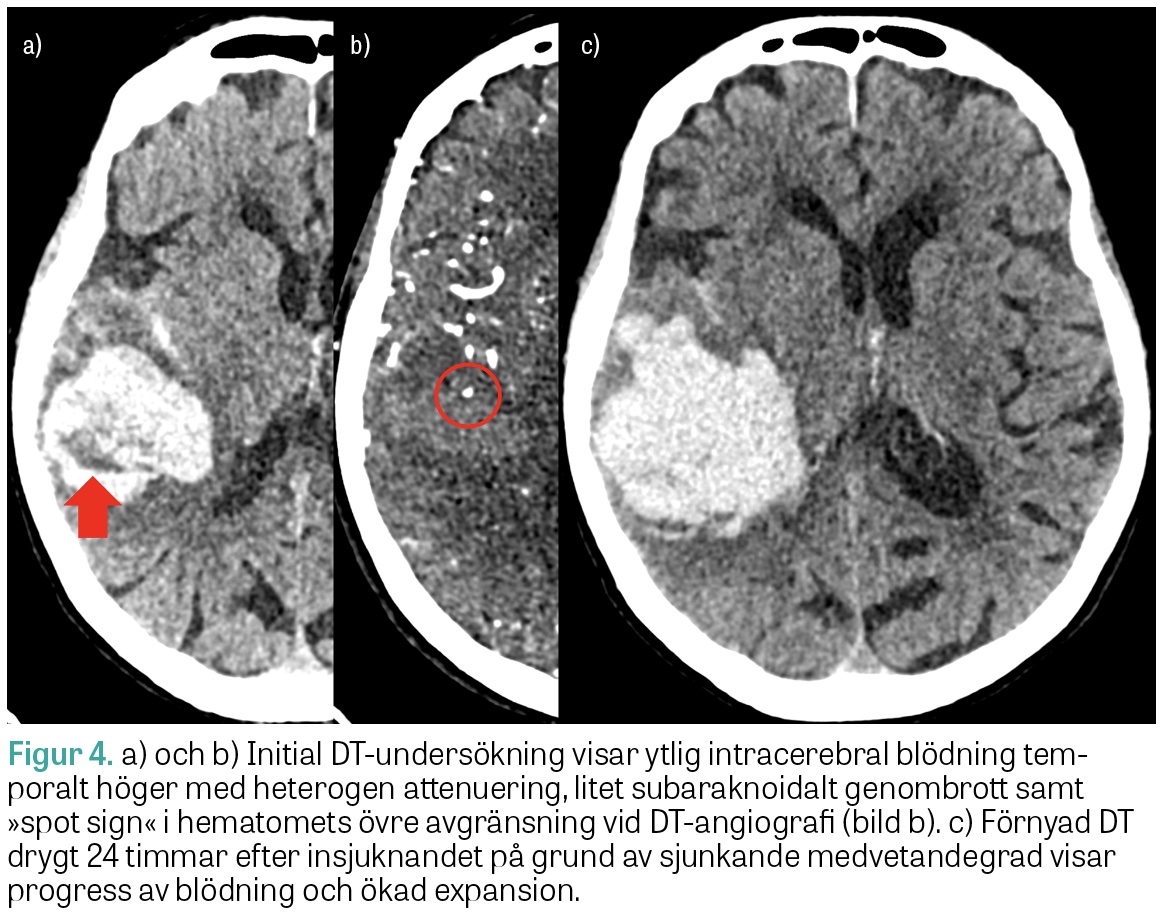
ICH med heterogen attenuering och oregelbundna marginaler på DT har ökad risk för expansion under det första dygnet (Figur 3). Även så kallat »spot sign« på DT-angiografi, det vill säga kontrastmedelsutträde i hematomet, har hög specificitet för blödningsexpansion men låg sensitivitet och utesluter inte risken för expansion. Fynd på DT eller DT-angiografi förknippade med hög risk för fortsatt hematomexpansion kan bidra vid bedömning av lämplig vårdnivå och vid ställningstagande till överföring till universitetssjukhus för övervakning inför eventuell neurokirurgi.
Ny DT utan kontrast bör utföras akut vid klinisk försämring, och en uppföljande DT-kontroll är generellt motiverad 12–24 timmar efter den initiala undersökningen för att se om hematomet har expanderat och om det finns begynnande hydrocefalus, då båda dessa påverkar fortsatt prognos.
Behandling
Målet vid akut handläggning av ICH är att minska risken för hematomexpansion och stabilisera patienten för att öka möjligheten till överlevnad. Indikationerna för intensivvård (eller neurointermediär vård, om den är tillgänglig) är bredare än för neurokirurgi och bör bedömas separat. De kan utgöras av medvetslöshet eller snabbt sjunkande medvetandegrad, bristfälligt upprätthållen fri luftväg, mycket högt blodtryck som inte stabiliseras av initial behandling eller andra uttalade ABC-problem. De flesta patienter har fördel av systemisk optimering under kontinuerlig övervakning i 24–48 timmar. Under tiden hinner väsentlig prognostisk information (inklusive en DT-kontroll) samlas in, och anhöriga ges tid att ansluta. Detta möjliggör att prognostisering, beslut om fortsatt vårdnivå och information till närstående kan utföras under ordnade former, dagtid och av en van specialistläkare. Om ingen indikation för intensivvård eller neurokirurgisk vård föreligger ska patienter med ICH vårdas på strokeenhet, då detta påtagligt minskar mortaliteten jämfört med vård på allmän vårdavdelning [12]. Nyligen har initialt omhändertagande på intermediärvårdsnivå (helst med akutneurologisk profilering, som har byggts upp på flera sjukhus i landet) visats vara associerat med bättre överlevnad och funktion, även i jämförelse med sedvanlig strokeenhetsvård [13].
Läkemedelsbehandling
Den akuta läkemedelsbehandlingen av ICH står på tre ben: optimering av koagulation, blodtryckssänkning och lindring av symtom (illamående, smärta, oro och urinstämma). Systemet för akut strokelarm behöver vara anpassat även för ICH. Särskilt gäller det sjuksköterskeresurser, då flera läkemedel ofta behöver beredas och administreras på kort tid samtidigt som patienten övervakas och symtom lindras.
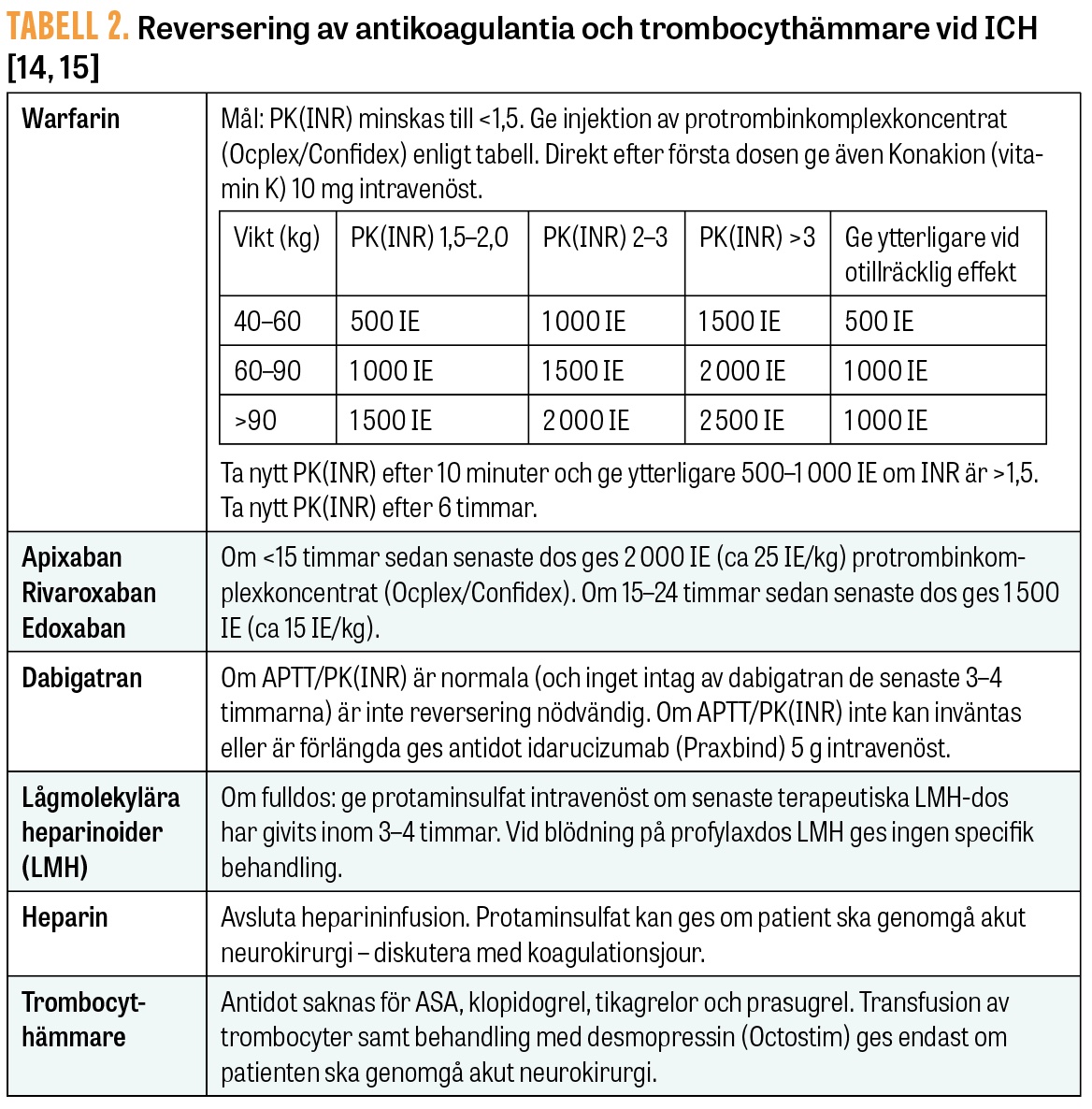
Koagulation. Cirka 24 procent av patienter med ICH insjuknar under pågående behandling med antikoagulantia, såsom warfarin eller direktverkande orala antikoagulantia (NOAK) [1]. Hematomen hos dessa patienter växer snabbare och har sämre prognos. Behandling med motmedel ges urakut, enligt Tabell 2, efter att hematomet påvisats med DT. Reverseringen inleds skyndsamt, och ju tidigare hemostasen förbättras, desto bättre är utsikterna att bromsa expansionen [3].
Vid behandling med warfarin tas kapillärt PK(INR) med patientnära analysmetod för att vinna tid. I venöst blod tas blodstatus, PK(INR), APTT, kreatinin och elektrolyter, glukos och leverstatus, och vid anti-faktor Xa-behandling tas om möjligt även fXa-aktivitet eller specifik läkemedelskoncentration.
Akut symtomlindring. Många patienter med ICH mår illa, har ont i huvudet och är oroliga, även motoriskt, och det är vanligt med urinstämma. Detta kan bidra till ökat blodtryck, som är associerat med hematomexpansion. Symtomlindringen börjar redan i akutrummet eller datortomografen. Många gånger behövs en kombination av intravenöst ondansetron/metoklopramid, titrering med små dossteg (à 1–2 mg) av morfin och KAD vid urinstämma. Patientens stress av att uppleva ett akut larmförfarande, med snabba förflyttningar och flera deltagande personer, dämpas med ett lugnt tilltal och medvetenhet i personalgruppen.
Blodtryck. Majoriteten av patienter med ICH har ett akut förhöjt systoliskt blodtryck (SBT), vilket är starkt kopplat till risk för hematomexpansion [16]. Randomiserade prövningar och metaanalyser har visat god säkerhet vid akut blodtryckssänkning till målnivån 140 mm Hg hos patienter med initialt SBT på 150–220 mm Hg. Detta minskar hematomexpansionen, men har inte visat effekt på dödlighet och bara blygsam effekt på funktion [17]. Studierna har begränsats av att behandling påbörjats relativt sent (3–4 timmar efter debut) och att de flesta inkluderade patienter haft små till medelstora hematom (median 10–11 ml). En post hoc-analys av Atach-2-studien har visat att det kan finnas en positiv effekt på funktionsutfall om behandling inleds inom 2 timmar från debut [18]. Samtidigt bör SBT inte sänkas med mer än 60 mm Hg den första timmen eller mer än 90 mm Hg de första 12 timmarna, på grund av ökad risk för njursvikt [17, 19]. ICH-riktlinjer från American Heart Association (2022) ger en svagt positiv rekommendation att sänka akut SBT på 150–220 mm Hg till målnivån 140 mm Hg och upprätthålla det i intervallet 130‒150 mm Hg. Samtidigt ger man en starkare rekommendation att inleda blodtrycksbehandling inom 2 timmar efter debut, att nå målnivå inom 1 timme och undvika hög blodtrycksvariabilitet [10]. Detta liknar rekommendationerna från Europeiska strokeorganisationen (2021), som anger målintervallet 110‒140 mm Hg i minst 1 dygn inom 6 timmar från symtomdebut och betonar vikten av att starta SBT-sänkande behandling så snart som möjligt efter debut, idealt inom 2 timmar [20]. Hos patienter med tecken på förhöjt intrakraniellt tryck, vilka kan bli föremål för neurokirurgi, bör blodtryckssänkning göras med försiktighet, och ett något högre initialt målintervall för SBT kan vara rimligt. Hos patienter med mikroangiopatisk ICH är det av största betydelse att eventuell kronisk hypertoni kommer under nogsam behandling och uppföljning även efter akutfasen för att förebygga återinsjuknande.
Neurokirurgi
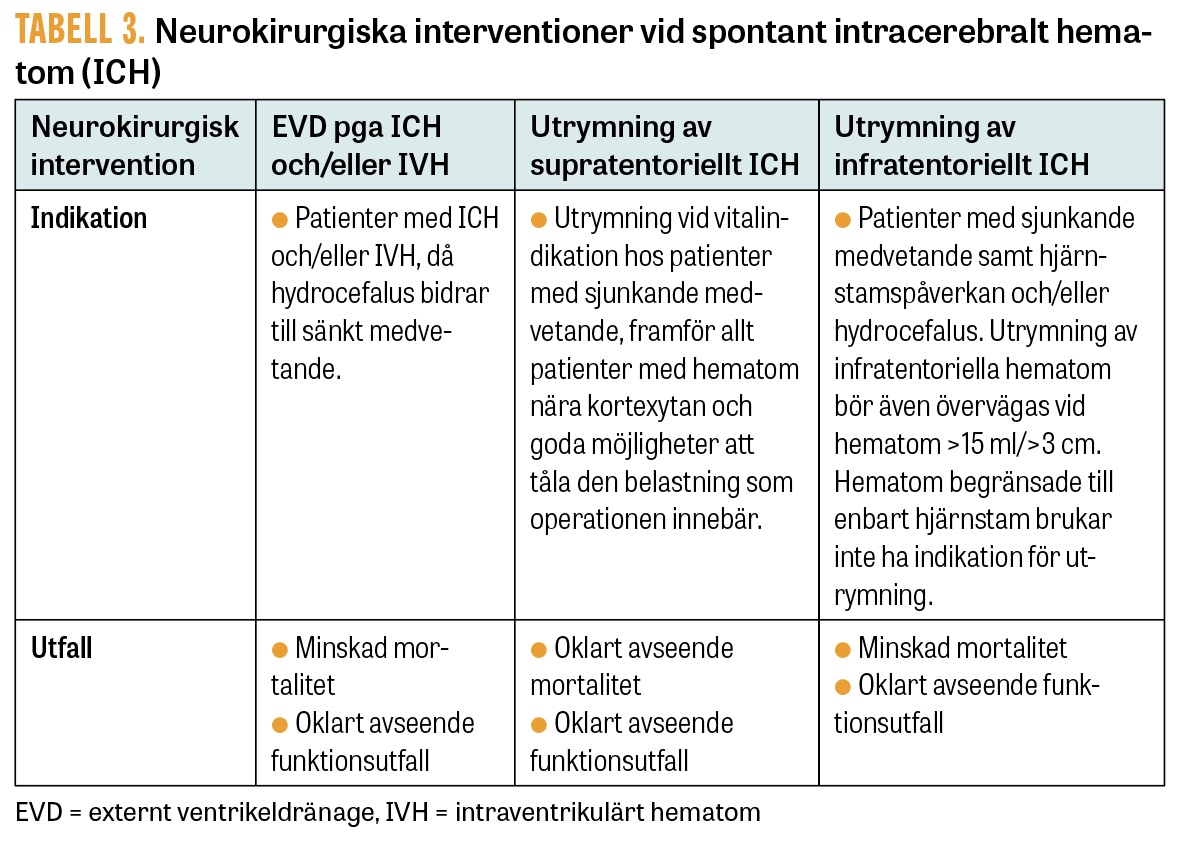
Den neurokirurgiska behandlingen vid ICH består huvudsakligen av ventrikeldränage för avlastning av hydrocefalus samt av utrymning av supratentoriella eller infratentoriella hematom. Trots flera randomiserade prövningar är nyttan av kirurgi vid ICH fortsatt omdiskuterad, förutom vid hydrocefalus och expansiva lillhjärnsblödningar, och det är vanskligt att fastslå entydiga behandlingskriterier.
Ventrikeldränage har i retrospektiva material visats ha effekt på mortalitet hos patienter där hydrocefalus bidrar till sänkt medvetande. Effekten på funktionsutfall är dock oklar. Ventrikeldränage eller intraparenkymatös mätare för tryckmonitorering är omdiskuterade hos patienter med sänkt medvetande, och evidensen för rutinmässig användning är svag.
Utrymning av supratentoriella hematom har i randomiserade prövningar inte visats ha signifikant effekt på vare sig mortalitet eller funktionsutfall, även om man har sett en trend mot minskad mortalitet vid utrymning av större hematom (>30 ml) nära kortexytan. Socialstyrelsens riktlinjer för vård vid stroke (2020) ger åtgärden den medelhöga prioritetsgraden 4 (på en 10-gradig skala), det vill säga att behandlingen kan erbjudas [21].
Vid utrymning av expansiva lillhjärnshematom har man i retrospektiva material sett minskning av mortalitet hos patienter som sjunker i medvetande och har hjärnstamspåverkan och/eller hydrocefalus, samt vid hematom >15 ml/>3 cm i diameter. Samtidigt är effekten på funktionsutfall oklar. Det bör dock noteras att funktionsutfallet efter ICH i lillhjärnan i genomsnitt blir bättre än vid till exempel centrala supratentoriella ICH och att livräddande kirurgi vid cerebellära hematom generellt kan erbjudas på vidare indikationer och vid högre ålder. Detta speglas i Socialstyrelsens riktlinjer, som ger åtgärden prioritetsgrad 2, det vill säga att behandlingen bör erbjudas [21].
Indikationer och utfall av nämnda interventioner sammanfattas i Tabell 3. Utöver dessa studeras även lovande interventioner, såsom minimalinvasiv endoskopisk hematomutrymning med eller utan lokal fibrinolys och användning av fibrinolytisk terapi för att lösa upp intraventrikulära hematom, men här är evidensen ännu otillräcklig för användning inom rutinsjukvård. Även hemikraniektomi har i små studier visat sig att ha en effekt på mortalitet hos selekterade patienter, men evidensen är sparsam och inte heller denna metod kan i dag betecknas som helt etablerad inom rutinsjukvården.
I nuvarande svaga evidensläge är det vanskligt att ge entydiga kirurgiska rekommendationer vid ICH. I slutändan kommer beslut om neurokirurgisk intervention att avgöras av blödningens kirurgiska tillgänglighet, radiologi, patientspecifika kliniska omständigheter och den sparsamma evidens som finns.
Vid fynd av annan blödningsorsak än småkärlssjukdom, antingen i urakut skede eller vid uppföljande radiologi bör neurokirurg eller regional stroke-/neurologbakjour konsulteras ‒ den sistnämnda särskilt vid misstanke om »icke-kirurgisk« etiologi, såsom cerebral venös trombos, reversibelt cerebralt vasokonstriktionssyndrom eller vaskulit.
Utredning och behandling av bland annat aneurysm, arteriovenösa missbildningar och fistlar med flera etiologier har genomgått en stark utveckling och lett till flera möjliga högspecialiserade behandlingar. Beslut om lämplig strategi fattas multidisciplinärt i dialog med neurokirurg, interventionell och diagnostisk neuroradiolog och i tillämpliga fall vaskulärt inriktad neurolog.
Sammanfattning
ICH är en allvarlig sjukdom med hög mortalitet och morbiditet. Modern handläggning syftar till att stabilisera och symtomlindra, förebygga fortsatt expansion av blödningen genom koagulationsoptimering och blodtryckssänkning samt utreda orsak med moderna radiologiska metoder. I utvalda fall avlastas högt intrakraniellt tryck och masseffekt med neurokirurgi, där nya metoder är under utveckling. Indikationer för intensivvård respektive neurokirurgi bör bedömas separat. Eftersom prognostisering i urakut skede är osäker rekommenderar internationella riktlinjer att man väntar med ställningstagande till eventuella behandlingsbegränsningar tills det gått minst 24 timmar. Omhändertagande inom intermediärvård (helst med neurologisk inriktning) kan minska dödlighet vid ICH och ge bättre funktionsutfall.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
(uppdaterad 2023-09-12)