I Sverige behandlas i dag 17 procent av patienter med akut propporsakad stroke med reperfusionsbehandling.
Akut stroke utreds med DT hjärna och DT-angiografi, med tillägg av perfusions-DT hos patienter i sent tidsfönster eller med okänd tid för insjuknande.
Intravenös trombolys ges till patienter med debuttid <4,5 timmar som visar funktionsnedsättande neurologiska symtom och saknar kontraindikationer.
Endovaskulär trombektomi ges som tillägg till intravenös trombolys till tidigare funktionsoberoende patienter med debuttid <24 timmar, funktionsnedsättande neurologiska symtom och påvisad kärlocklusion och då DT hjärna uteslutit en redan etablerad infarkt motsvarande hela det drabbade kärlterritoriet.
Reperfusionsbehandling har lett till ett paradigmskifte inom behandlingen av akut ischemisk stroke, som gått från låg prioritet på landets akutmottagningar till att nu kräva urakut omhändertagande med högeffektiva behandlingar. Begreppet reperfusionsbehandling omfattar intravenös trombolys, som är en kraftigt blodförtunnande propplösande behandling, och arteriell endovaskulär trombektomi, som är ett kateterburet ingrepp för mekanisk borttagning av blodproppen.
Intravenös trombolysbehandling
Intravenös trombolysbehandling ges vid funktionsnedsättande neurologiska symtom och har varit grundpelaren i reperfusionsbehandling vid akut ischemisk stroke sedan den första randomiserade studien publicerades 1995 [1]. I studien sågs effekt på funktionsutfall för patienter behandlade med intravenöst alteplas (rekombinant human vävnadsplasminogenaktivator) inom 3 timmar, och 2008 bekräftades effekt även i tidsfönstret 3–4,5 timmar [2]. Efterföljande metaanalyser visade att patienter som behandlades med trombolys fick bättre funktionsutfall oavsett ålder och strokens initiala svårighetsgrad, men också att behandlingen har bäst effekt om den ges tidigt efter insjuknandet [3-5]. Vid mycket lindriga neurologiska symtom ses ingen säker effekt av intravenös trombolys. Strokens svårighetsgrad mäts med National Institutes of Healths strokeskala, där högre poäng betyder svårare stroke. För att fatta beslut om trombolys behövs DT hjärna, med vilken man kan utesluta radiologiska kontraindikationer, såsom intrakraniell blödning eller större etablerad infarkt. Nyare studier har också visat att en selekterad grupp med räddningsbar vävnad som påvisats med avancerade bildgivande metoder, såsom magnetkameraundersökning (MR) eller perfusions-DT, får gynnsam effekt av trombolysbehandling upp till 9 timmar efter att patienten senast sågs utan strokesymtom [6, 7]. Dessa studier har lett till att 2021 års europeiska riktlinjer för stroke rekommenderar trombolysbehandling 4,5–9 timmar efter insjuknandet hos patienter med räddningsbar vävnad som inte ska genomgå trombektomi [8]. Även för patienter som vaknar med symtom och där insjuknandetiden är okänd finns stöd för behandling med trombolys om man kan påvisa räddningsbar vävnad [9, 10]. De svenska nationella riktlinjerna för strokesjukvård utfärdade av Socialstyrelsen uppdaterades avseende trombolysbehandling senast 2019 och omfattar därför inte ovanstående rekommendationer.
Alteplas versus tenekteplas
Läkemedlet alteplas binder till fibrinkomponenten i blodproppen och startar en fibrinolytisk kaskad som leder till att blodproppen löses upp. Sedan läkemedlet godkändes för indikationen stroke på 1990-talet har det varit förstahandsval vid intravenös trombolys. Tenekteplas är en genetiskt modifierad variant av alteplas och binder mer specifikt till fibrin. Det har längre halveringstid än alteplas och kan därför ges som en bolus i stället för en 60-minuters infusion. Flera randomiserade studier har jämfört de två läkemedlen mot varandra i oselekterade strokepopulationer och funnit likvärdig effekt [11, 12]. Ytterligare två randomiserade studier har jämfört läkemedlen hos patienter med påvisad storkärlsocklusion och funnit högre grad av rekanalisering och bättre funktionsutfall med tenekteplas än alteplas [13, 14]. I europeiska riktlinjer för stroke rekommenderas nu tenekteplas över alteplas hos patienter med storkärlsocklusion som kan bli aktuella för trombektomi [8]. Inte heller denna rekommendation finns ännu i de svenska riktlinjerna, men tenekteplas har införts utanför godkänd indikation på flera håll i Sverige. Produktionen av tenekteplas är för närvarande kraftigt begränsad, och läkemedlet är restnoterat i stora delar av Europa inklusive Sverige.
Endovaskulär trombektomi
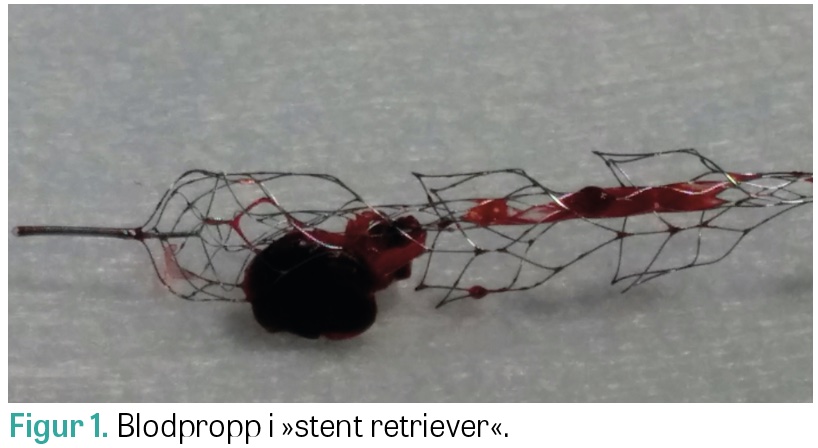
Parallellt med utvecklingen av vård och medicinsk behandling av stroke på 1990-talet utvecklades också den interventionella neuroradiologin. De första kateterburna behandlingsförsöken för akut ischemisk stroke gjordes med hjälp av intraarteriell trombolys, som injicerades i direkt anslutning till blodproppen, ofta i kombination med mekanisk manipulation. Instrumentet Merci, som liknade en korkskruv, var det första i sitt slag som var specifikt utvecklat för trombektomi [16]. Det var inte helt lätt att använda, vilket medförde att man runt 2010 i stället började prova med en avlösbar stent, ursprungligen avsedd som stöd vid coiling av bredbasiga intrakraniella aneurysm. I stället för att lösa av stenten från den ledare som den var fastsatt vid placerade man den över blodproppen i artären, lät stenten trycka sig in i blodproppen och drog sedan ut stenten och blodproppen med hjälp av ledaren [17]. I och med detta kan man säga att första generationens »stent retriever« hade skapats. Med denna nya teknik blev mekanisk trombektomi betydligt lättare att utföra med framgång, vilket ledde till att antalet behandlingar ökade kraftigt (Figur 1). Metoden var emellertid inte testad i randomiserade studier, och de tre första som jämförde trombektomi med bästa medicinska behandling 2013 var alla negativa [18-20]. De kritiserades emellertid för att ha varit baserade på felaktiga antaganden och för att använda ålderdomlig teknik vid trombektomierna. På grund av dessa tillkortakommanden genomfördes nya randomiserade studier, och bara två år senare, år 2015, publicerades fem avgörande studier som skingrade alla tvivel om huruvida trombektomi var en effektiv behandling av akut stroke [21-25]. Studierna, varav flera avslutades i förtid, visade att trombektomi med »stent retriever« utförd inom 6 timmar från symtomdebut som tillägg till medicinsk behandling hos patienter med ocklusion av den intrakraniella delen av arteria carotis interna eller arteria cerebri medias proximala segment gav ett överlägset bättre funktionsutfall än enbart bästa medicinska behandling. Antalet som behövde behandlas för att en patient skulle uppnå ett gott funktionsutfall (number needed to treat) var endast 2,6. Analogt med trombolysstudierna fann man dock ingen skillnad i överlevnad mellan de två olika behandlingarna. För att fatta beslut om trombektomi inom 6 timmar behövs kärlavbildning med DT-angiografi som påvisar en kärlsocklusion åtkomlig för intervention. Cirka 24 timmar efter trombolys och trombektomi görs en kontroll-DT (alternativt MR) av hjärnan för att estimera den ischemiska skadans utbredning och kartlägga eventuella blödningskomplikationer.
Patientselektion med hjälp av avancerad diagnostik
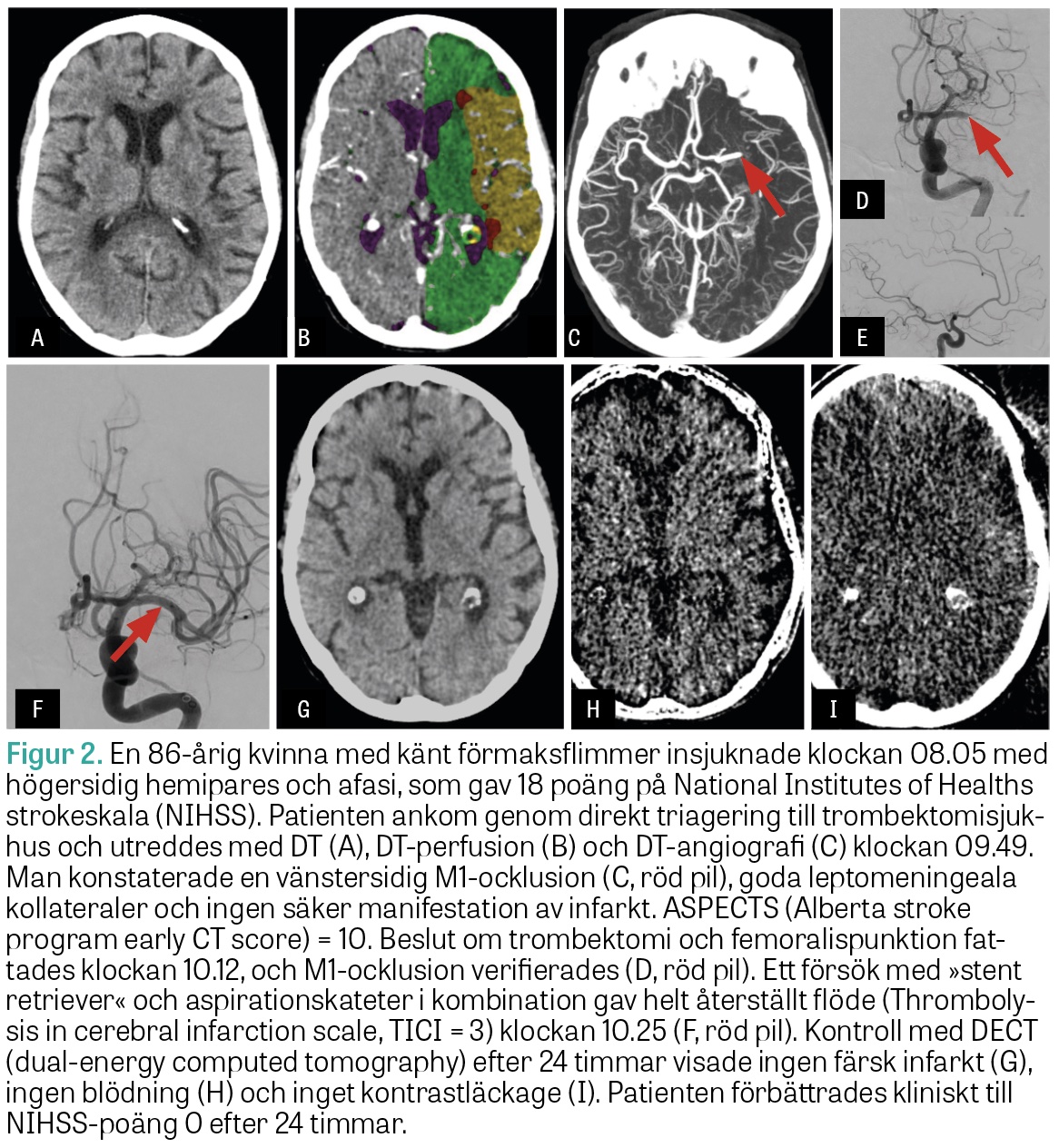
Med hjälp av MR-teknik eller perfusions-DT kan man skilja på vävnad med irreversibel ischemi (infarcerad vävnad) och vävnad som är ischemisk, men ännu inte infarcerad, det vill säga räddningsbar. Hur snabbt infarktutvecklingen sker är högst individuellt och beror på flera saker. De viktigaste är blodproppens lokalisation, hur bra kollateralcirkulation patienten har och hur högt blodtrycket är. Kollateralcirkulationen i hjärnan utgörs dels av de främre och bakre kommunikanterna, dels av förekomsten av små kollateralkärl i hjärnhinnorna och ytligt kortikalt (leptomeningeala respektive piala kollateraler). Dessa kan aktiveras om hjärnan utsätts för ischemi och hjälpa till med blodförsörjningen till det ischemiska området. Hos patienter med väl utvecklad kollateralcirkulation går infarktutvecklingen långsamt, och dessa patienter kan ha räddningsbar vävnad flera dygn efter insjuknandet. År 2018 publicerades två randomiserade kontrollerade studier som använde konceptet att påvisa räddningsbar vävnad med perfusions-DT eller MR (Figur 2). Bägge studierna visade mycket goda resultat vid trombektomi i ett sent tidsfönster [27, 28]. I dag rekommenderar därför såväl europeiska som svenska riktlinjer att man gör en utredning med perfusions-DT för att hitta patienter som är lämpliga för trombektomi 6–24 timmar efter insjuknandet.
Trombektomi vid basilaristrombos
Basilarisocklusion är en mer ovanlig och mycket allvarlig stroketyp med hög dödlighet. Symtomen varierar från fokala hjärnstamssymtom till koma. De två första randomiserade studierna som jämförde trombektomi som tillägg till medicinsk behandling med enbart medicinsk behandling vid basilarisocklusion visade ingen skillnad mellan behandlingarna [29, 30]. Studierna var dock påverkade av selektionsbias och långsam rekrytering. Under 2022 publicerades ytterligare två randomiserade studier av trombektomi vid basilarisocklusion [31, 32]. Båda studierna utfördes i Kina med överväldigande fördelaktiga resultat för trombektomigruppen upp till 24 timmar efter insjuknandet, och för första gången i trombektomisammanhang även med en klar överlevnadsfördel. På grund av tillståndets allvarlighetsgrad har trombektomi rekommenderats i såväl svenska som europeiska riktlinjer, även innan det fanns vetenskapligt stöd i form av randomiserade studier.
Teknisk utveckling och blodproppens sammansättning
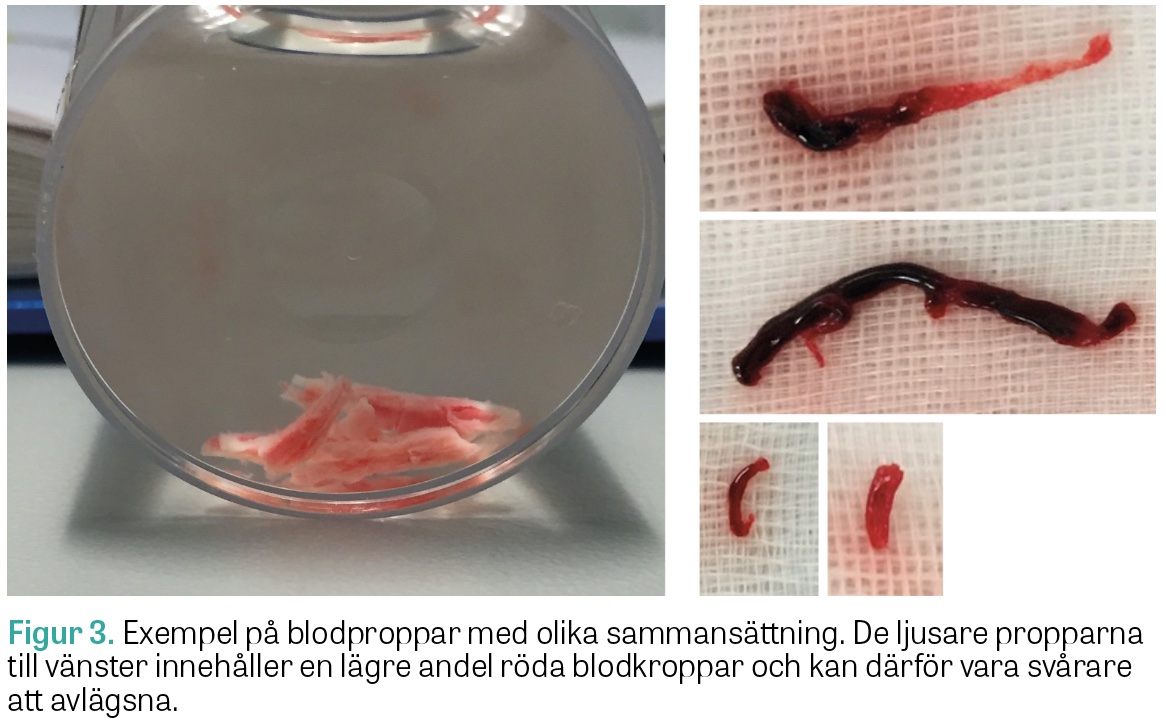
Det sker en snabb utveckling av material och tekniska tillvägagångssätt vid trombektomi. Blodproppens sammansättning skiljer sig mellan patienter, bland annat beroende på olika strokeetiologier, och denna sammansättning spelar stor roll för möjligheten att rekanalisera artären [33]. De proppar som innehåller en mindre andel röda blodkroppar och har ett högre innehåll av fibrin och blodplättar är mer kompakta och typiskt svåra att fånga i »stent retrievers« eller aspirera (Figur 3). Nya »stent retrievers« har utvecklats just för denna typ av blodproppar. Cerebrala blodproppar i Europa är till cirka 90 procent kardioemboliska eller resultat av artär till artär-embolisering, vanligtvis från en avancerad karotissjukdom med arteriosklerotiska plack och stenos. Detta skiljer sig från patienter med akut hjärtinfarkt, där förhållandet är det motsatta: cirka 90 procent orsakas av lokala förträngningar och plackbildningar. I asiatiska länder, som exempelvis Indien, Kina, Japan och Sydkorea, är däremot lokal arterioskleros även i hjärnans kärl (intracranial atherosclerotic disease, ICAD), betydligt vanligare och orsakar uppemot 35–50 procent av alla ischemiska stroke i dessa länder [34].
Särskilda patientgrupper
I de inledande randomiserade trombektomistudierna var fokus på »proof of concept«, vilket innebar att man valde en snäv patientpopulation med hög premorbid funktionsnivå och bara diskreta tidiga infarktförändringar före ingreppet. Detta har inneburit att man har saknat egentligt vetenskapligt stöd för patientgrupper som inte uppfyller dessa snäva kriterier. Patienter med funktionsberoende före stroke, med mycket kort förväntad överlevnad eller med mycket lindriga symtom behandlas i dag bara undantagsvis med trombektomi. Nyligen publicerades studier som visade att även patienter med stora tidiga ischemiska förändringar, vilka kan vara delvis reversibla, hade nytta av trombektomi [35-37]. En viktig synpunkt i detta sammanhang är att funktionsutfallet i studier tidigare ofta dikotomiserats, då ett bra resultat definierats som att patienten vid uppföljning efter 3 månader är oberoende i sitt dagliga liv. Men ett sådant utfallsmått kan inte visa om det finns en positiv behandlingseffekt även om oberoende inte uppnåtts. Det är förstås bättre för en patient att vara begränsat beroende av hjälp från andra än att vara sängbunden och helt utlämnad åt assistans.
Trombolys i tillägg till trombektomi
Nyttan av att administrera intravenös trombolys till patienter med storkärlsocklusion som anländer direkt till ett trombektomicentrum har ifrågasatts, men studier har inte kunnat påvisa att det är bättre att avstå från trombolys än att ge den före trombektomi [38, 39]. Därför lyder rekommendationen fortsättningsvis att patienter som inte har någon kontraindikation ska behandlas med trombolys som tillägg till trombektomi, även om de anländer direkt till ett trombektomicentrum.
Reperfusionsbehandling vid stroke i Sverige
År 2021 behandlades 17 procent av alla patienter med akut ischemisk stroke i Sverige med reperfusionsbehandling: 13 procent med trombolys och 6 procent med trombektomi (3 procent fick båda behandlingarna). Detta är en ökning från totalt 4 procent 2010. Socialstyrelsens mål är att ≥20 procent ska behandlas med reperfusionsbehandling.
Intravenös trombolys ges i dag på alla de 72 akutsjukhusen i Sverige. Det finns dock stora geografiska variationer mellan regionerna (från 8 till 22 procent trombolysbehandling), vilket tyder på att behandlingen underutnyttjas på flera håll. De senaste åren har det inte skett någon ökning av andelen patienter som får trombolys. De allra flesta propplösande behandlingarna ges i tidsfönstret <3 timmar, och ytterst få ges efter 4,5 timmar. En utmaning med att öka andelen trombolyser är att endast 40 procent av patienterna med akut stroke anländer till sjukhuset inom 4,5 timmar [40]. Runt om i landet arbetas det intensivt för att öka antalet patienter som får reperfusionsbehandling och minska tiden till behandling, både prehospitalt och hospitalt. Flera regioner har telestrokenätverk som beslutsstöd till sjukhus som saknar läkare med särskild strokekompetens, och många har system där ambulansen stannar hos patienten tills beslut om eventuell sekundärtransport har fattats. Man arbetar också med kompetensutveckling, exempelvis träning i simuleringsmiljö, och det finns sjukhus som använder sig av mjukvara med artificiell intelligens för att förkorta tiden för radiologisk bedömning.
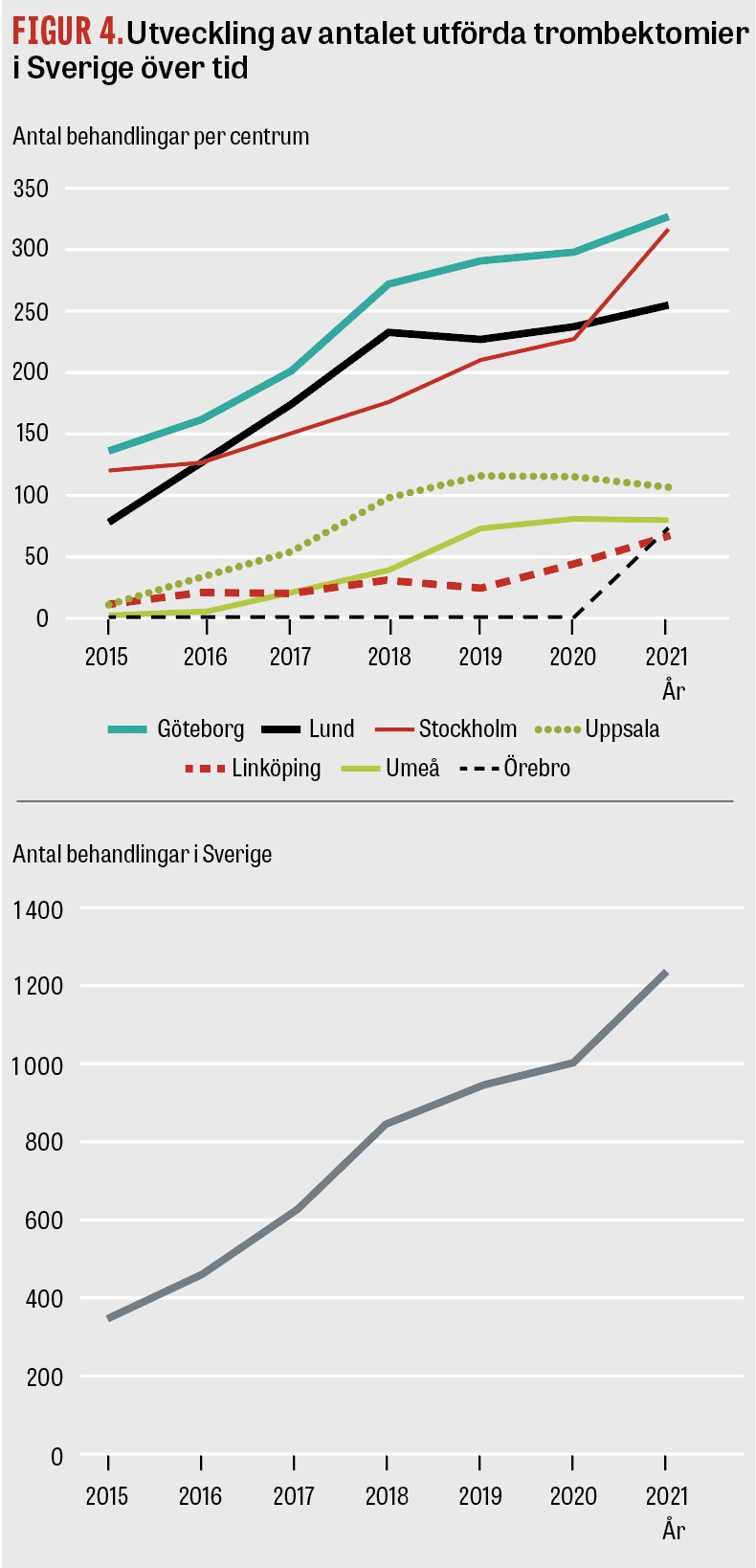
Trombektomibehandling ges i dag på de 7 universitetsklinikerna i Sverige. Patienterna triageras till trombektomicentrum på olika sätt i landet beroende på geografiska och lokala strukturella förutsättningar. Inom vissa regioner använder ambulanspersonalen prehospitala strokeskalor för att känna igen och bedöma svårighetsgraden av en stroke, och dessa kan därefter ligga till grund för triagering antingen till närmaste sjukhus eller direkt till ett trombektomicentrum. På många håll i landet är transporttiderna långa, och i de fallen utförs bilddiagnostik och intravenös trombolys på närmaste sjukhus före sekundärtransport till trombektomicentrum. I storstadsregionerna Stockholm och Västra Götaland direkttriageras patienterna av jourhavande strokeneurolog (med hjälp av ambulanspersonalens bedömning) till trombektomicentrum utan att stanna på närmaste sjukhus i de fall ocklusion av ett centralt kärl i hjärnan är sannolik och avståndet är acceptabelt. Antalet trombektomibehandlingar i Sverige har ökat från knappt 400 per år till drygt 1 100 mellan 2015 och 2021 (Figur 4). Behandlingar i det förlängda tidsfönstret (6–24 timmar) står för en betydande del av ökningen och motsvarade en tredjedel av alla behandlingar 2020 [41]. Tillgången till trombektomi är klart ojämlik över landet, och antalet behandlade varierar från 1 till 9 procent av samtliga patienter med ischemisk stroke, beroende på i vilken region patienten är bosatt [40]. Hinder för att öka antalet trombektomier är att det i dag finns få utbildade neurointerventionister, att många patienter med allvarlig stroke kommer till sjukhus först när skadan redan är etablerad och att framför allt akut kärlutredning med DT-angiografi inte görs i tillräcklig utsträckning.
Resultaten från genomförda trombektomier i svensk rutinsjukvård motsvarar resultaten från randomiserade studier, både vad gäller dödlighet och funktionsutfall [41-43], trots att svenska patienter i genomsnitt är 5 år äldre än de som deltog i studierna. Resultaten står sig både för det tidiga och sena tidsfönstret i främre cirkulationen, men också för basilaristrombos.
Framtidsperspektiv
Den akuta reperfusionsbehandlingen av ischemisk stroke fortsätter att utvecklas, både medicinskt och mekaniskt. Förbättrad trombolys med tenekteplas har redan nämnts, och kanske kan även neuroprotektion få en renässans; tidigare experimentella studier visade ofta lovande resultat, men effekten uteblev i kliniska studier, alternativt visade de på oacceptabla biverkningar. En intressant pågående studie (Escape-next-studien; Clinicaltrials.gov: NCT04462536) jämför nerinetid, en hämmare av kväveoxid, med placebo före trombektomibehandling hos patienter som inte fått samtidig trombolys.
En annan möjlighet är att farmakologiskt attackera andra komponenter i blodproppen än fibrinet. Blodpropparna vid en ischemisk stroke innehåller utöver röda och vita blodkroppar, fibrin och blodplättar även en mindre mängd andra ämnen, som exempelvis von Willebrand-faktor och så kallade NET (neutrophil extracellular traps), som håller ihop blodproppen så den blir svårare att lysera [44]. Båda dessa ämnen kan angripas farmakologiskt med tillgängliga läkemedel, som i djurexperimentella studier har visat en tydligt ökad trombolytisk effekt, framför allt i kombination med alteplas [45, 46]. Kanske kan framtidens strokepatienter behandlas med en sådan intravenös cocktail?
För den mekaniska behandlingen sker en utveckling i flera olika riktningar. En försöker minska tiden till rekanalisering genom att ta patienten direkt till trombektomicentrumets kärllaboratorium utan föregående DT- eller MR-undersökning. Man har i studier visat att detta leder till både kortare tid till rekanalisering och förbättrat utfall [47].
En annan inriktning, utöver förbättrade tekniker, är att försöka optimera det kliniska resultatet av trombektomin. Man har länge känt till att patienter i tekniskt lyckade fall, där man snabbt uppnår rekanalisering och allt pekar på ett gott kliniskt utfall, inte förbättras som förväntat. En orsak till detta kan vara att man under själva proceduren förlorar små bitar av blodproppen, som fortsätter med blodströmmen och ockluderar mindre artärer och kapillärer. Resultatet blir en nedsatt mikrovaskulär reperfusion av hjärnvävnaden, som har benämnts »no-reflow« [48]. I den nyligen avslutade randomiserade Choice-studien fick därför patienterna antingen alteplas eller placebo givet intraarteriellt efter en avslutad och till synes helt lyckosam trombektomi, med tanken att alteplas helt eller delvis skulle kunna lysera sådana små mikroembolier och förbättra den mikrovaskulära reperfusionen [49]. Resultatet visade mycket riktigt att patienterna som fått alteplas hade ett signifikant bättre kliniskt utfall vid uppföljande kontroll efter 3 månader.
Slutligen har det överväldigande positiva utfallet för trombektomi vid ocklusion av ett centralt kärl i hjärnan väckt frågan om indikationen inte ska utökas till att även omfatta små eller medelstora kärl. Detta är förstås inte självklart, då den förväntade vinsten oftast är mindre när det hotade området i hjärnan är mindre omfattande. Risken för komplikationer, framför allt i form av allvarlig blödning, är sannolikt större när kärlet är smalare och lokaliserat mer distalt. För detta ändamål används därför mindre och ofta specialdesignade instrument samt särskilda tekniska åtgärder, och flera hänsyn beaktas. Ett flertal studier pågår för närvarande (Distal-studien; Clinicaltrials.gov: NCT05029414 och Escape-MEVO-studien; Clinicaltrials.gov: NCT05151172) för utvärdering av framför allt säkerheten vid sådan mer distal trombektomi, som i dag övervägs när patienten har begränsade men allvarliga symtom som medför en betydande funktionsnedsättning, exempelvis global afasi.
Sammanfattning
Reperfusionsbehandling med intravenös trombolys och mekanisk trombektomi vid akut ischemisk stroke har utvecklats mycket snabbt under de senaste decennierna, och effekten av trombektomi saknar nästan motstycke inom modern medicin. Trombolys erbjuds patienter med funktionsnedsättande neurologiska symtom, med tillägg av trombektomi om det finns en åtkomlig kärlocklusion. Den radiologiska utredningen omfattar DT hjärna och DT-angiografi, och i det sena tidsfönstret selekteras patienter med tillägg av perfusions-DT.
Frekvensen av reperfusionsbehandlingar har stadigt ökat inom landet, men betydande skillnader kvarstår mellan olika regioner. Det finns potential för en ytterligare generell ökning av andelen som får reperfusionsbehandling till ≥20 procent och en utjämning av dagens ojämlikheter. Utvecklingen fortgår för trombolys och trombektomi. Vi kommer i framtiden sannolikt att ha tillgång till både mer effektiva läkemedel och optimerade endovaskulära tekniker, och olika kombinationer av dessa metoder kan ge ett ytterligare förbättrat kliniskt utfall.
Läs även:
Författarintervjun med Teresa Ullberg.
Potentiella bindningar eller jävsförhållanden: Teresa Ullberg har tagit emot lön för expertgruppsuppdrag av Socialstyrelsen och Astra Zeneca samt talararvoden från Siemens Healthineers. Tommy Andersson är konsult för Anaconda, Cerenovus, Optimize Neurovascular och Rapid Medical och har aktier i Ceroflo.