Intensiv behandling direkt vid diagnosen av metastaserad sjukdom förlänger livet, och kombinationsbehandling är ny standard.
Strålbehandling av primärtumören förlänger livet vid begränsad spridning.
Sjukvården behöver fokusera mer på att hantera biverkningar av cancerbehandlingen, då många kommer att leva länge med sin behandling.
Precisionsmedicin gör sitt inträde även här: testning av BRCA1/2 styr behandling med PARP-hämmare.
Andelen av alla män som årligen diagnostiseras med spridd prostatacancer var 2022 11,3 procent, motsvarande cirka 1 300 män. Hos män 80 år eller äldre var andelen så stor som 30,5 procent. Det finns en viss regional skillnad i landet. Prostatacancer har en affinitet för spridning till skelett och lymfkörtlar, även om spridning till lunga och lever också förekommer, ofta sent i förloppet. Standardutredning är skelettskintigrafi och datortomografi (DT).
Positronsemissionstomografi med DT (PET-DT) med prostataspecifikt membranantigen (PSMA) som spårämne blir allt vanligare och dominerar som grundlag för stadieindelning i vissa regioner. Undersökningen är känslig och kan påverka andelen som diagnostiseras med metastaserad sjukdom.
De senaste 15 åren har det skett en kraftig utveckling av behandlingen av spridd prostatacancer. Såväl det primära omhändertagandet vid nydiagnostiserad avancerad sjukdom som efterföljande behandlingsmöjligheter har i de senaste studierna ökat genomsnittsöverlevnaden från 2–3 år till 5–6 år. Den ökande komplexiteten ställer stora krav på specialiserad vård, samarbete mellan urologi och onkologi och större onkologisk kompetens.
Primär behandling
Hörnstenen i behandling av spridd prostatacancer, kemisk eller kirurgisk kastration, ger ofta en snabb symtomlindring och remission av sjukdomen. Så småningom progredierar sjukdomen och blir kastrationsresistent. Mediantiden till kastrationsresistent sjukdom är omkring 1 år, men variationen är stor och god sjukdomskontroll kan bestå under många år.
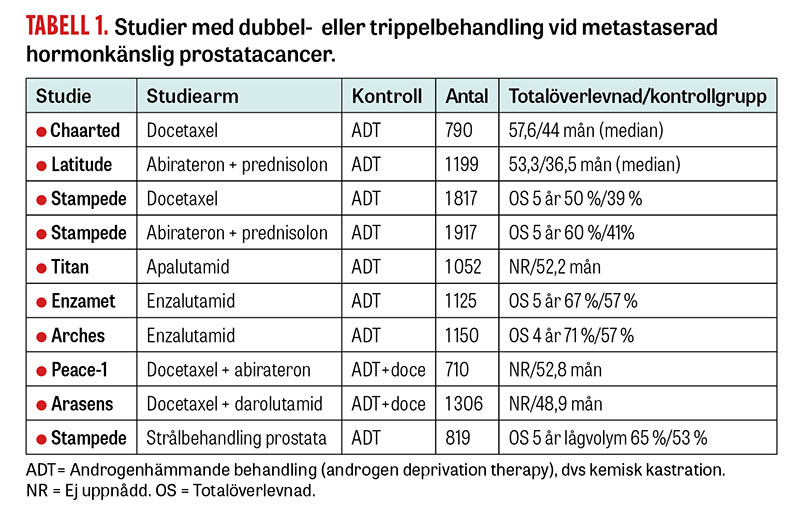
År 2015 kom ett paradigmskifte, då en studie [1] randomiserade män med nydiagnostiserad metastaserad prostatacancer till enbart kastration eller kombinationen kastration med 6 behandlingsomgångar med cytostatika (docetaxel). Studien visade att tillägget av docetaxel kunde förlänga den totala överlevnaden med mer än 1 år jämfört med enbart kastration.
Efter detta har fler studier av någon av de nya androgenhämmande behandlingarna abirateron kombinerat med prednisolon, enzalutamid eller apalutamid [2-4] som tidigt tillägg till kastration visat sig ge en förlängd överlevnad som kan räknas i år i stället för, som när de används i ett senare läge, i månader. En samstämmig konklusion är att enbart kastration inte är en adekvat behandling.
Nyligen har två studier undersökt om ytterligare intensifiering, med tillägg av en androgenhämmare till dubbletten kastration och docetaxel, kan öka överlevnaden ytterligare. Dessa studier har lagt till abirateron respektive darolutamid [5, 6]. Bägge studier visar att en trippelkombination är bättre än kombinationsbehandling med kastration + cytostatika. Ännu saknas studier som jämför trippelbehandling med en kombination av kastration och hormontillägg.
Med utgångspunkt från teorin att metastasering fortsatt sker från primärtumören, och att kontroll hindrar vidare spridning, har studier gjorts där strålbehandling getts mot primärtumören hos patienter med metastasering [7, 8]. Vid begränsad spridning, vilket definieras som 1–4 metastaser i skelettet och/eller lymfkörtlar utanför lilla bäckenet, kan man med strålbehandling mot primärtumören se en 12-procentigt ökad överlevnad vid 5 års uppföljning. Hos män med mer omfattande spridning i skelettet eller till inre organ, såsom lunga och lever, påverkar behandling av primärtumören inte förloppet (se Tabell 1).
Det nationella vårdprogrammet rekommenderar i dag att patienter med nydiagnostiserad spridd prostatacancer ska diskuteras på multidisciplinär konferens, där sjukdomens utbredning och symtom samt patientens samsjuklighet och ålder beaktas. Vid begränsad metastasering rekommenderas kombinationsbehandling med hormoner och lokal strålbehandling mot primärtumören. Vid mer avancerad sjukdom bör patienter erbjudas dubbel- eller trippelbehandling.
Data från Nationellt prostatacancerregister visar att cirka hälften av patienterna med metastaserad sjukdom får kombinerad behandling [9]. Då många patienter är äldre med samsjuklighet kan inte alla förväntas tåla intensiv behandling, men andelen bör ökas. Undantag är patienter som har omfattande samsjuklighet och begränsad spridning med få eller inga cancerrelaterade symtom, vilka i stället kan behandlas med perorala androgenhämmare för att besparas kastrationsrelaterade biverkningar.
Biverkningar
Risken för hjärt- och kärlbiverkningar har länge varit känd vid enbart kastration, och risken ökar med intensifierad hormonell behandling. Kardio-onkologiska riktlinjer har utarbetats av European Society of Cardiology [10]. Baserat på riktlinjerna har det tillkommit en ny rekommendation i det nationella vårdprogrammet med innebörden att alla patienter bör få en genomgång av sina kardiovaskulära riskfaktorer och ställningstagande till eventuell intervention.
Kastrationsbehandling ökar osteoporosrisken, och kombinationsbehandling med kortison höjer den ännu mer. Samtliga män som erhåller kombinationsbehandling bör få osteoporosprofylax parallellt. Hos övriga med enbart kastrationsbehandling bör bentätheten utvärderas initialt och efter 2–3 år, om profylax inte har getts. Ett alternativ är årlig infusion med zoledronsyra tillsammans med D-vitamin och kalcium eller denosumab subkutant var 6:e månad. Båda dessa preparat har också indikationen att förhindra skelettrelaterade händelser när cancern är i kastrationsresistent skede. De högre doser som då ges ökar risken för osteonekros i käkbenet, varför patientens tandstatus först bör värderas av tandläkare.
Kastrationsresistent sjukdom
Definitionen av kastrationsresistent prostatacancer är stigande PSA eller tillkomst av nya eller växande metastaser trots kastrationsvärden på testosteron i plasma (<0,5 ng/ml). Det rekommenderas ändå, kanske kontraintuitivt, att fortsätta kastrationsbehandlingen, då äldre studier har visat att det är en nackdel att låta testosteronnivån normaliseras. Ny radiologisk utredning bör göras för att värdera utbredning och metastasmönster.
När prostatacancerpatienter når ett kastrationsresistent skede har de numera ofta avverkat ett, ibland två, behandlingsalternativ. Nästa möjliga behandlingssteg styrs därför dels av den primära behandlingen, dels av sjukdomsrelaterade faktorer och komorbiditet.
Cytostatika är ett alternativ om de inte har givits initialt. Docetaxel, som ges varannan eller var tredje vecka, är då förstahandsval. Om patienten i det tidiga skedet har behandlats med docetaxel kan ett annat cytostatikum, kabazitaxel, användas. Båda har liknande biverkningar: anemi, neutropeni, illamående, diarré och trötthet. Då påverkan på leukocyter är så vanlig är det viktigt att överväga granulocytkolonistimulerande faktor (G-CSF) som profylax för att undvika neutropen feber, en potentiellt livshotande biverkan.
Två av de hormonellt verkande preparaten har behandlingsindikationen kastrationsresistent prostatacancer: abirateron och enzalutamid. Biverkningar inkluderar hjärta–kärl, fatigue, leverpåverkan och ökad risk för fall och frakturer. Preparaten uppvisar korsresistens, och det rekommenderas inte att använda dem i sekvens då nyttan är mycket liten. Många patienter har redan initialt stått på kombinationsbehandling med hormoner och därför är sådana mindre användbara i det kastrationsresistenta skedet.
Målstyrd behandling
Ett nytt tillskott i arsenalen är biomarkörstyrd behandling i form av PARP-hämmare. Hämmare av enzymet poly(adenosinfosfat-ribos)-polymeras (PARP) försämrar reparationen av DNA-enkelsträngsbrott. Tumörer med DNA-reparationsdefekter är särskilt känsliga för behandlingen, framför allt de med BRCA1/2-mutationer. PARP-hämmare är sedan tidigare godkända för behandling av ovarial- och bröstcancer med påvisad BRCA-mutation. Både konstitutionella och somatiska mutationer förekommer, varför testningen behöver ta hänsyn till båda möjligheterna. Testning kan göras med blodprov på vita blodkroppar för konstitutionell mutation eller på cirkulerande tumör-DNA (ctDNA) eller tumörvävnad. I de studier som gjorts på PARP-hämmare och prostatacancer påvisas BRCA-mutation hos cirka 10 procent av patienterna; således måste många genomgå testning för att finna dem som har nytta.
Inför testningen bör patienten informeras om att man undersöker en potentiellt ökad ärftlig risk för cancersjukdom. Vid påvisad konstitutionell mutation rekommenderas onkogenetisk utredning.
Radionuklider
Radium-223 är en alfa-sönderfallande isotop som ges som injektion. Den används bara hos patienter med enbart skelettmetastaser. Radium liknar kalcium, binder in i benvävnaden och avger där strålning. Alfastrålning har en mycket kort räckvidd, varför radium är enkelt att hantera ur strålskyddssynpunkt och behandling ges polikliniskt. Man uppnår i median en överlevnadsvinst om cirka 4 månader och en minskning av skelettrelaterade symtom. Biverkningarna är måttliga, varför även skörare patienter kan behandlas. Det är svårt att utvärdera effekten då PSA sällan påverkas och då effekten på skelettmetastaser är svår att utvärdera oavsett behandling. Nivån och eventuell förändring av alkaliskt fosfatas i serum kan vara till viss hjälp i utvärderingen.
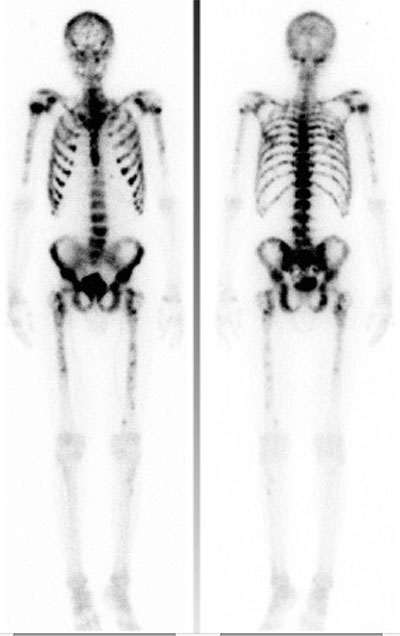
Lutetium-177-PSMA har de senaste åren fått stor uppmärksamhet som ett möjligt tillskott i behandlingsarsenalen. Det är en målstyrd behandling såtillvida att man inför behandling gör en PSMA-PET-DT för att se om tumörerna tar upp spårämne, vilket är en förutsättning för att kunna ge behandling. En majoritet av prostatacancerceller uttrycker PSMA, medan uttrycket är minimalt i normala prostataceller. I en stor studie med patienter som tidigare fått flera tidigare behandlingar gavs 4–6 omgångar med 7,4 GBq lutetium-177-PSMA-617, vilket jämfördes med bästa möjliga palliativa omhändertagande [11]. För denna tungt behandlade grupp kunde man visa 4 månader längre överlevnad med isotopbehandlingen. De vanligaste biverkningarna var muntorrhet, trötthet och illamående (se Figur 2).
I processen för ordnat införande av nya terapier har Tandvårds- och läkemedelsförmånsverket gjort en hälsoekonomisk utvärdering. Den beräknade kostnaden per vunnet kvalitetsjusterat levnadsår har bedömts vara för hög. I dagsläget söker sig patienter utomlands för att erhålla denna behandling på egen bekostnad.
Framtiden
Metastasinriktad lokalbehandling
Radiologins utveckling, med allt känsligare metoder för att upptäcka metastaser och nya tekniker för att leverera strålbehandling med hög precision, inbjuder till att försöka rikta behandlingen mot metastaser med så kallad stereotaktisk strålbehandling. Det innebär höga doser vid få tillfällen. Några mindre randomiserade studier har kunnat visa att detta kan fördröja tiden till behov av systemisk behandling.
I en av studierna styrde man behandlingen med ledning av konventionell radiologi, men PSMA-PET-DT gjordes på alla som fick stereotaktisk behandling. Efteråt kunde man visa att resultatet blev avsevärt bättre om man lyckats få med alla PET-positiva lesioner i behandlingen än om någon lesion missats.
En annan form av metastasinriktad behandling är kirurgi, oftast i form av dekompression av medulla på grund av metastas i kotkropp. Det kan ge omedelbar symtomlindring och bevara funktion. Stabiliserande kirurgi av långa rörben vid hotande fraktur används sällan, men är en möjlighet.
Mer målstyrd systemisk behandling
Trots de stora framsteg som skett med utveckling av nya behandlingar och ökad kunskap kring primärhandläggning av spridd sjukdom så är kunskapen kring behandlingsprediktiva faktorer begränsad. Spridd prostatacancer är en heterogen sjukdom med väldigt varierande förlopp, och vi saknar ännu medel för att anpassa behandlingen efter tumörspecifika egenskaper. Det som styr är i stället trubbiga mått såsom tumörutbredning och samsjuklighet. PARPhämmare är det första exemplet på riktad terapi. Probio-studien (https://www.probiotrial.org/) är en biomarkörstyrd flerarmad studie som syftar till att via analys av ctDNA välja den lämpligaste behandlingen. Sannolikt kommer kunskapen att öka och leda till en alltmer individualiserad behandling.
Potentiella bindningar eller jävsförhållanden: Camilla Thellenberg Karlsson har föreläst i samarbete med Janssen, Astra Zeneca och Amgen.