Ökad molekylär kunskap ger nya möjligheter för individanpassad behandling av prostatacancer.
Både genetiska defekter och expressionsmönster kan ge prognostisk och behandlingsprediktiv information.
Det finns olika subtyper av prostatacancer, med olika biologi, som behandling kan anpassas till.
Det finns olika klassificeringar av dessa subtyper; deras värde för rutindiagnostik bör undersökas i kliniska studier.
För att mer effektiv behandling av metastaserad prostatacancer ska kunna utvecklas behöver metastasers biologi och heterogenitet undersökas ytterligare.
De flesta patienter med prostatacancer diagnostiseras med en sjukdom som är lokaliserad enbart till prostatan. För dem finns botande behandlingar, såsom operation eller strålning. Men när sjukdomen spridit sig, metastaserat, blir behandlingslandskapet mer komplicerat. Här finns förnärvarande ingen botande behandling. Det understryker behovet av nya, mer effektiva terapier riktade mot kliniskt etablerade metastaser men även mot mikrometastaser med potential att växa. I parallella artiklar presenteras de behandlingsalternativ som finns tillgängliga i dag, och ännu fler lär komma. Viktigt blir då att reda ut i vilken ordning och kombination och i vilken fas av sjukdomen olika behandlingar bör ges, allt med syftet att optimera effektivitet och minimera biverkningar. Önskvärt vore att kunna erbjuda individualiserad behandling baserad på de mekanismer som driver tumör-/metastastillväxt i det enskilda fallet genom så kallad precisionsmedicin.
Under senare år har moderna tekniker möjliggjort detaljerad molekylär kartläggning av såväl medfödda genetiska varianter som förändringar (mutationer) uppkomna i tumörer. Vissa genetiska förändringar ökar risken att utveckla prostatacancer, samtidigt som andra förmodligen bidrar till utveckling av subtyper med olika aggressivitetsgrad och sjukdomsförlopp. Tyvärr kan dessa subtyper inte förutsägas genom etablerade diagnostiska variabler. För att möjliggöra mer precisa förutsägelser behövs specifika biomarkörer.
Molekylära förändringar med potential att fungera som biomarkörer kan identifieras på DNA-, RNA- och proteinnivå. Ännu har endast ett fåtal biomarkörer, nått kliniken, medan många har undersökts i forskningsstudier och visats ge tilläggsinformation till de kliniska variabler som i dag används för att bedöma risk och fatta beslut om behandling. Vilka är då dessa biomarkörer, och hur kan de bäst tillämpas i klinisk praxis?
Biomarkörer i kliniken i dag
Genetiska studier har påvisat samband mellan vissa mutationer och ökad risk att utveckla prostatacancer. I dagsläget rekommenderas täta kontroller med PSA-testning från 40 års ålder för alla män med misstänkt ärftlighet för prostatacancer. Detta involverar män med en far eller bror och ytterligare en förstagradssläkting med prostatacancer. Dessutom bör genetisk utredning erbjudas yngre män med lågt differentierad och/eller metastaserad prostatacancer eller om det finns misstanke om andra ärftliga cancersyndrom i släkten. De vanligaste mutationerna som kan öka risken för män att drabbas av prostatacancer återfinns i generna för BRCA2 och HOXB13. Gener som kan vara relevanta att undersöka med tanke på andra ärftliga cancersyndrom inkluderar BRCA1, MSH2, MSH6 och TP53.
BRCA1 och BRCA2 kodar för två proteiner som är viktiga för att celler ska kunna reparera skador på DNA. Mutationer i dessa gener ger försämrad förmåga att reparera DNA-skador, vilket i sin tur ger en ökad risk för cancerutveckling. Patienter med mutationer i BRCA1/2 visar särskilt god respons på behandling med PARP-hämmare, och enligt det nationella vårdprogrammet utförs därför sekvensering av BRCA1/2 på en betydande andel män som beslutsstöd inför behandling av metastaserad, kastrationsresistent prostatacancer.
Lovande genetiska biomarkörer
Inom sjukvården introduceras nu en genpanel som omfattar över 500 gener kopplade till cancer. Denna information kommer i framtiden att kunna användas för att vägleda behandlingsval vid olika cancerformer, inklusive prostatacancer. Vidare genomförs en omfattande biomarkördriven klinisk studie (Probio) [1], där patienter med metastaserad prostatacancer selekteras för olika behandlingsstrategier baserat på mutationer i specifika gener. Bland de gener som utvärderas inom Probio ingår androgenreceptorn, de tidigare nämnda BRCA1/2 och TP53. Inom Probio-studien undersöks generna via analys av så kallade vätskebiopsier i form av cirkulerande tumör-DNA (ctDNA) isolerat via blodprov. Vätskebiopsier är enkla att ta, även vid upprepade tillfällen, och anses därför vara ett gott substitut för vävnadsbiopsier, framför allt vid provtagning av patienter som har ett flertal metastaser.
Alla precisionsmedicinska metoder har begränsningar, och användandet av ctDNA kräver att tumörbördan är tillräckligt stor för att möjliggöra sekvensering eller riktad PCR-analys. Dessutom är ctDNA-analysen begränsad till att primärt undersöka mutationer, vilket exkluderar epigenetiska förändringar som styr hur gener används utan att ändra själva DNA-sekvensen. Dock pågår snabb utveckling på området. Metoder som mäter genaktivitet (metyleringsspecifika och kromatinbaserade analyser) kommer förmodligen att möjliggöra fler användningsområden för ctDNA inom precisonsmedicin.
Molekylär subtypning ger biologisk insikt
Tumörers egenskaper är en produkt av genetiska och epigenetiska förändringar i cancercellerna, men påverkas också av den omgivande mikromiljön. Därför är det viktigt att förstå att cancercellers omgivning kan se påtagligt olika ut beroende på om de befinner sig i prostata, benmärg, lever, lunga eller någon annanstans. För att förstå vad som driver metastastillväxt är det således viktigt att studera just metastaser. En ytterligare aspekt är att vi ännu inte har full förståelse av hur vanligt det är att tumörer innehåller blandningar av celler med olika molekylära egenskaper. Genom molekylär karakterisering av primärtumörers och metastasers sammantagna egenskaper kan betydelsefull kunskap om lämplig behandling erhållas från såväl cancerceller som från omkringliggande celler, vilken kan användas för att bedöma prognos och vägleda behandlingsval.
I Sverige används för närvarande inga molekylära analyser för att ge prognostisk information eller föreslå behandlingsmetoder vid diagnos av prostatacancer, trots att ett flertal test har utvecklats och finns kommersiellt tillgängliga. Exempelvis har Prolaris (Myriad Genetics) och Oncotype Dx (Exact Sciences) utvecklats som genexpressionspaneler för analys av biopsivävnad med syfte att förutsäga behov av kurativ behandling (operation eller strålning) och därigenom öka säkerheten vid beslut om aktiv monitorering [2, 3]. Decipher (Veracyte) är ett annat test som använder information från genuttryck och rekommenderas för analys av biopsivävnad tagen vid diagnos eller vävnad från radikal prostatektomi för att fatta beslut om tilläggsbehandling [4]. Prostatype-testet (Prostatype Genomics), utvecklat av svenska forskare, har även det visat prognostisk potential för patienter efter operation [5]. Det bör noteras att det finns få studier om hur dessa test kan förutspå behandlingssvar vid mer avancerade former av prostatacancer.
Samtliga nämnda test bygger på expressionsanalyser utförda på vävnad tagen från primärtumörer, och det finns vissa utmaningar förknippade med dem. Testen kräver att vävnad skickas till centrala laboratorier för analys, något som är både kostsamt och logistiskt krävande. Vid prostatacancer, som oftast är multifokal, är det dessutom inte självklart vilka tumörfokus – det förmodat farligaste eller alla – som ska analyseras för att få det mest användbara svaret. Slutligen krävs kliniska studier för att fastställa vilket mervärde testen skulle ge om de införlivades i rutindiagnostik.
Utöver ovan beskrivna kommersiella test har flera lovande klassifikationssystem framkommit i forskningsstudier, av vilka tre särskilt intressanta är: PAM50, PCS1–3 och MetA–C. Dessa klassifikationssystem baseras på transkriptionsprofiler i vävnad och är inte enbart prognostiska utan beskriver även biologiska skillnader mellan olika så kallade subtyper av prostatacancer [6-8].
På vissa sätt liknar PAM50, PCS1–3 och MetA–C varandra, eftersom de grupperar tumörer i tre subtyper efter egenskaper såsom hög/låg cellproliferation, hög/låg luminal celldifferentiering och hög/låg androgenreceptoraktivitet, egenskaper som i sin tur är tydligt kopplade till prognos. Enligt forskningsstudierna skulle dessa klassifikationssystem kunna användas för att selektera patienter med förväntad god respons på behandling riktad mot androgenreceptorn (PCS2, lumA/B, MetA) eller förmodad dålig respons på densamma (PCS1, basal, MetB/C), där de senare följaktligen är i stort behov av ytterligare behandling.
Utifrån beskrivna tumörbiologiska egenskaper kan man spekulera om huruvida de mest aggressiva subtyperna (PCS1, lumB, basal, MetB) borde visa god respons på tilläggsbehandling med kemoterapi eller med nyare behandlingmodaliteter såsom PARP-hämmare och immunterapi, medan PCS2, lumA och MetA nog svarar tillräckligt bra på anti-androgenbehandling. I framtiden bör ännu mer subtypsspecifika behandlingsalternativ utvecklas för ytterligare förbättrade resultat.
Metastassubtyper (MetA–C) för prognos och behandling
Till skillnad från PAM50 och PCS1–3, som bygger på genexpressionsmönster i primärtumörer, är MetA–C framtaget genom studier av expressionsmönster i metastaser. Därför förutspår vi att just MetA–C är det klassifikationssystem som har störst potential att ge tillförlitlig information för att vägleda val av behandling vid metastaserad prostatacancer.
Metastassubtyperna MetA–C identifierades ursprungligen genom omfattande profilering av 72 benmetastaser insamlade vid Umeå universitetssjukhus [8]. Relevansen av MetA–C-klassificering bekräftades senare genom analys av ytterligare prov från Umeå och Göteborg samt via klassificering av två amerikanska kohorter [9].
Hittills har över 700 metastasprov klassificerats baserat på MetA–C, och resultaten är tydliga: patienter med den vanligaste subtypen, MetA (cirka 70 procent), har relativt låg proliferation, hög androgenreceptoraktivitet och gynnsam prognos efter kastrationsbehandling och annan behandling som ges för att stänga av androgenreceptorn, medan MetB-patienter (cirka 20 procent) har hög proliferation, låg androgenkänslighet och särskilt dålig prognos. MetC-patienter (cirka 10 procent) har en intermediär prognos.
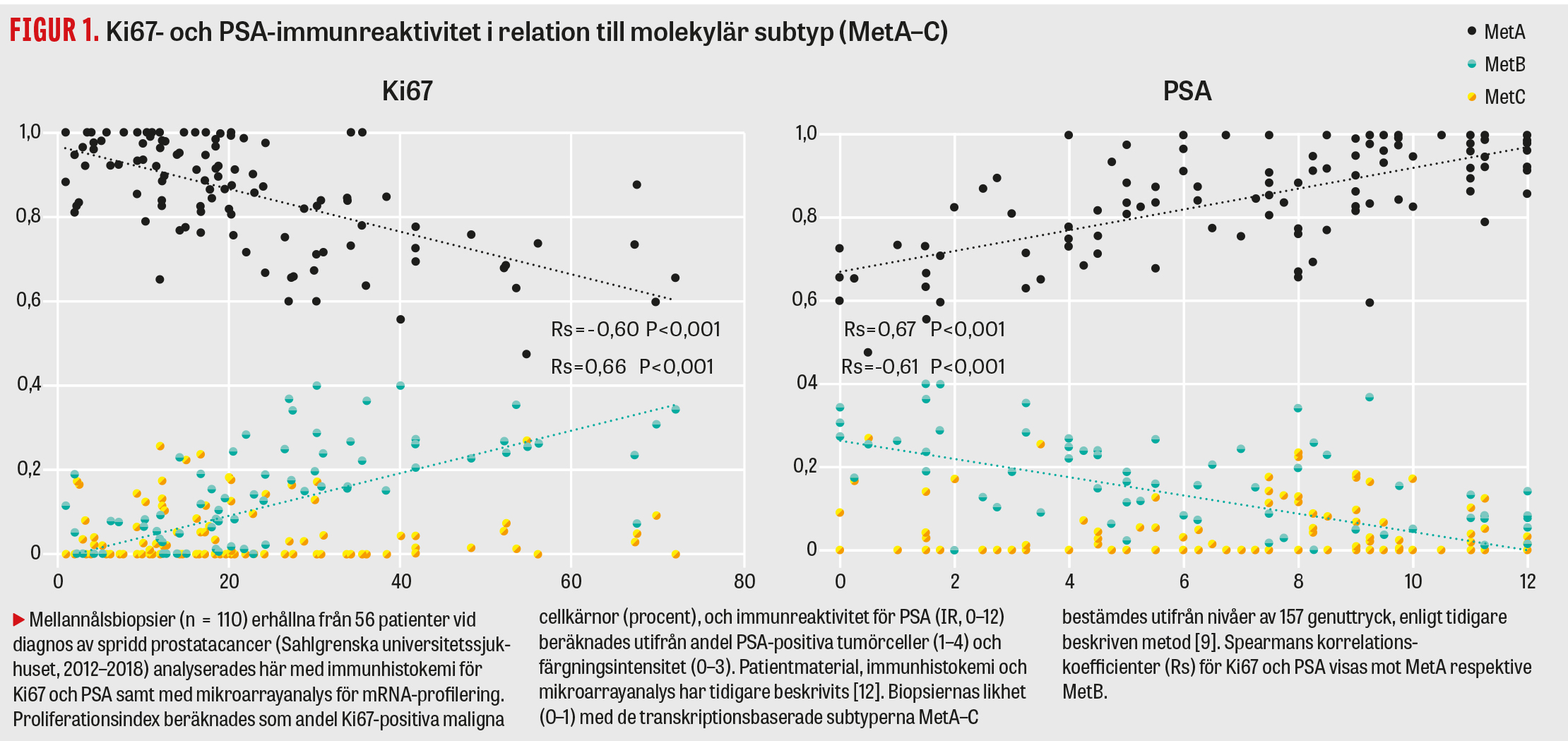
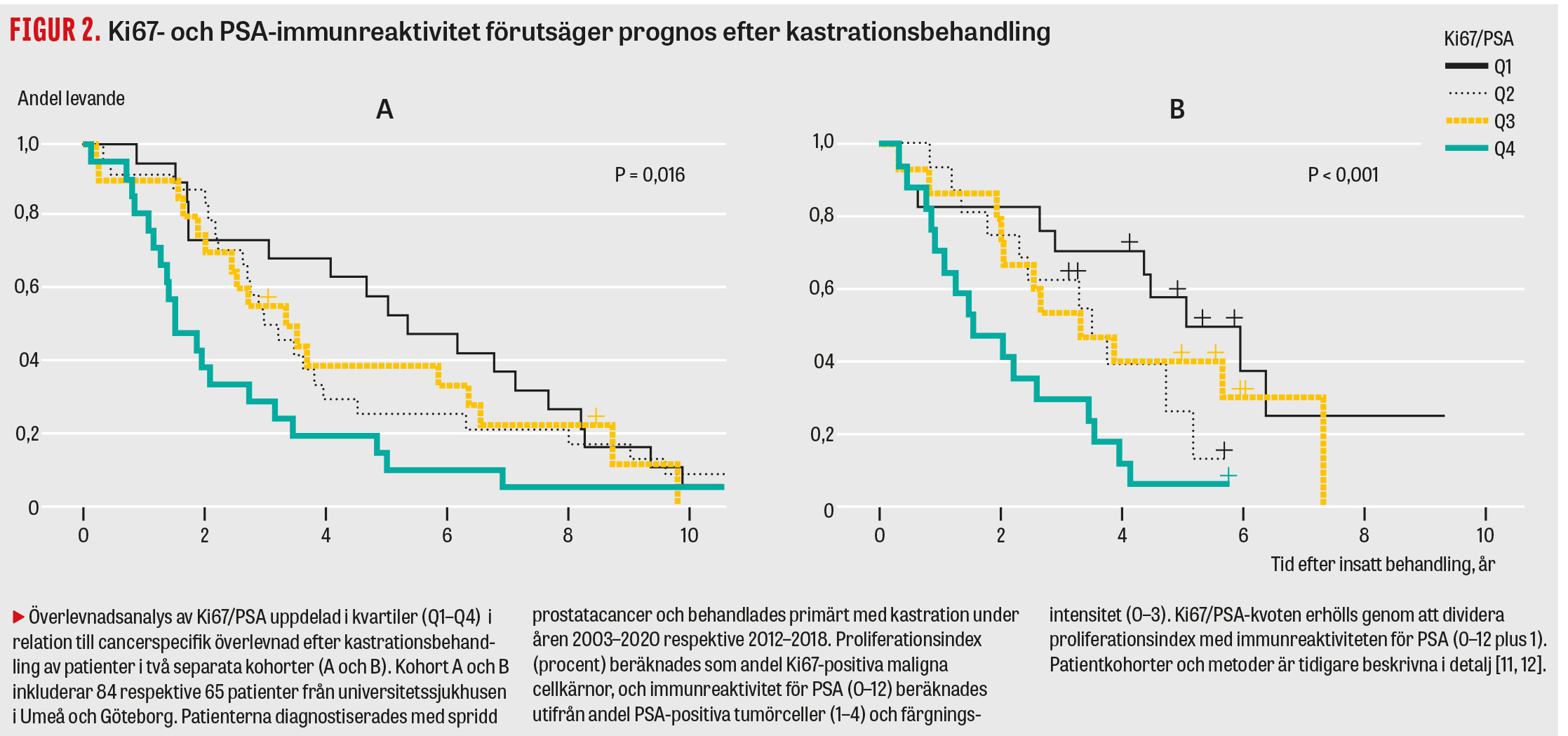
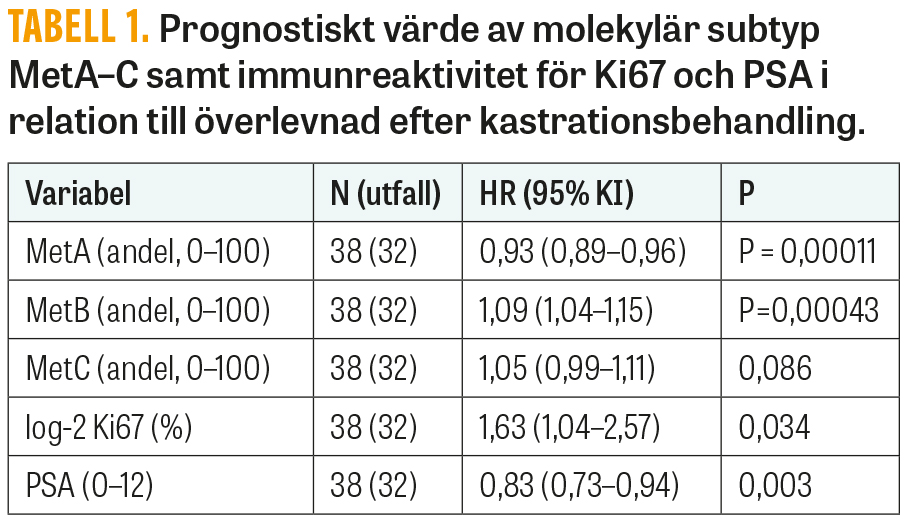
En panel för MetA–C-klassificering har utvecklats, vilken inkluderar 157 genuttryck som analyseras i jämförelse med nivåer i standardprov [8, 9]. Parallellt har en metod baserad på traditionell immunhistokemi för Ki67 (markör för proliferation) och PSA (markör för androgenreceptoraktivitet) utvärderats som ett alternativ till den mer komplexa och kostsamma genexpressionsanalysen [10, 11]. Tydligt positiva samband finns mellan Ki67 och MetB samt mellan PSA och MetA, inte bara i metastasvävnad [8] utan även i primärtumörer (Figur 1). Såväl MetA–C-klassificering som immunhistokemi för Ki67 och PSA ger prognostisk tilläggsinformation till kliniska variabler för M1-patienter vid primär kastrationsbehandling (Tabell 1). Det är troligt att immunhistokemi kan identifiera de mest högproliferativa (MetB) respektive de mest androgenkänsliga (MetA) tumörerna och därigenom kan användas för att stratifiera patienter till standardbehandling (Ki67/PSA, kvartil 1) eller till behandlingseskalering (Ki67/PSA, kvartil 4) (Figur 2), medan den svårklassificerade mellangruppen (kvartil 2–3) kan behöva utredning med mer komplex metodik (11, 12).
Molekylär bilddiagnostik och artificiell intelligens (AI)
Biomarkörtester och genprofiler som fortlöpande utvärderas i kliniska studier kommer att revolutionera vår förståelse av cancerbiologi och förbättra vår förmåga att förutsäga och anpassa behandling. Den ökande molekylära insikten kring olika subtyper av prostatacancer ger även möjligheter till utveckling av subtypsspecifika avbildningsmetoder baserade på positronemissionstomografi (PET), vilka skulle kunna ge detaljerade bilder av metastaser och deras svar på behandling. Exempelvis är PSMA (prostataspecifikt membranantigen), som används vid PSMA-PET, reglerat av androgenreceptorn, vilket gör det till en möjlig markör för avbildning av den vanligaste subtypen av metastaserad prostatacancer, MetA. Specifika PET-metoder som kan kvantifiera cellproliferation, till exempel FET-PET (detekterar tumörupptag av fluoretyltyrosin), bör utforskas för möjlighet att identifiera MetB. Det bör även vara möjligt att använda AI i kombination med såväl bilddiagnostik som rutinmässig infärgning av biopsivävnad för att bestämma molekylära subtyper.
Konklusion
Det är viktigt att förstå tumörheterogenitet, mellan och inom patienter, och att använda denna kunskap för att välja det bästa behandlingsupplägget för varje enskild individ. Ökad molekylärbiologisk kunskap gör det möjligt att överväga inte bara genetiska defekter utan även förändringar i genuttryck som behandlingsprediktiva biomarkörer.
Flera olika prognostiska och behandlingsprediktiva klassifikationssystem för prostatacancer finns beskrivna. MetA–C (transkriptionsprofilering) och immunhistokemi för Ki67/PSA har i forskningsstudier givit tydlig prognostisk tilläggsinformation för patienter med metastaserad sjukdom. För att möjliggöra jämförelse av de mest lovande behandlingsprediktiva biomarkörerna och utvärdera det hälsoekonomiska värdet av att implementera sådan precisionsmedicin för prostatacancer planeras nu i ett samlat initiativ i Sverige en prospektiv studie. Studien kommer att utvärdera och validera biomarkörer samt etablera en plattform för adaptiv biomarkördriven klinisk prövning (sprintr.se).
Potentiella bindningar eller jävsförhållanden: PW, AB och ET har två patentansökningar rörande diagnostik och prognostik av prostatacancer (EP20707226.5, EP20711795.3).
(uppdaterad 2024-04-26)