Nyheter i vårdprogrammet är precisionsmedicin baserad på bedömningsskalan GREAT.
Ytterligare ett sätt att minska postoperativ hypokalcemi är preoperativ kalcium-/vitamin D-behandling till dem med låga nivåer av dessa.
Individualiserad levotyroxindosering efter kirurgi baserad på ålder och BMI ger också bättre precision och snabbare rätt substitutionsdos.
Rekommendationer kring sköldkörtelhormonersättning efter ablativ behandling ger också möjligheter till en enhetlig substitutionsbehandling.
Vårdprogramgruppen har också tagit fram nationell patientinformation.
I vårdprogrammet inkluderas också nationella strålskyddsrekommendationer och riktlinjer för behandling med radioaktivt jod, så att förutsättning ges för nationell harmonisering.
Det nya nationella vårdprogrammet för hypertyreos [1] täcker vården för patienter med Graves sjukdom, multinodös toxisk struma och toxiskt adenom. Denna artikel lyfter fram nyheter i behandlingen och viktiga punkter för att uppnå en jämlik och effektiv vård vid Graves sjukdom som utgår från patienternas behov. För första gången används individuella riskpoäng för att beräkna risken för återfall vid Graves sjukdom, och genetisk bestämning kan användas för gruppen som har en återfallsrisk runt 50 procent enligt den kliniska bedömningsskalan GREAT (Graves’ recurrent events after therapy). Dessutom behövs en individuell värdering av vitamin D-nivåerna, med behandling vid låga värden för att undvika temporär hypokalcemi postoperativt, liksom en mer precis postoperativ levotyroxinbehandling beräknad på ålder och kön. Vi står på tröskeln till precisionsmedicin inom hypertyreos, det vill säga en vård som strävar efter att ge patienter skräddarsydd vård och behandling efter deras egna förutsättningar och behov. I precisionsmedicin ingår både genetiska och icke-genetiska faktorer (ålder, kön, medicinska värden, levnadsvanor med mera).
Hypertyreos – en folksjukdom
Graves sjukdom är den vanligaste formen av hypertyreos [2, 3], och cirka 2 100 individer insjuknar årligen i Sverige i overt Graves sjukdom. Livstidsrisken för Graves sjukdom estimeras till 3 procent för kvinnor och 0,5 procent för män [2]. Vid hypertyreos är tyreoideahormoner (fT4, fT3) förhöjda och tyreoideastimulerande hormon (TSH) lågt. Dessutom får cirka 380 individer subklinisk hypertyreos, där fT4/fT3 är normala men TSH sänkt [2], men sannolikt förekommer här en underdiagnostik och att en del prov normaliseras spontant. I gruppen med subklinisk hypertyreos är toxisk knölstruma (cirka 450 fall/år) och toxiskt adenom vanligare. Vårdtyngden vid Graves sjukdom påverkas också av att
- 50 procent av de tyreostatikabehandlade patienterna recidiverar [4, 5],
- 5–10 procent av patienterna med Graves sjukdom utvecklar en signifikant endokrin oftalmopati,
- 70 procent av patienterna med Graves sjukdom med tiden får ablativ behandling (tyreoidektomi eller radioaktivt jod) [4],
- 20 procent av Graves-patienterna måste ombehandlas efter radioaktivt jod [4] och
- 70 procent av alla patienter med overt Graves sjukdom behöver uppföljning med livslång tyreoideahormonersättning [4].
Initial tyreostatikabehandling
Betablockadbehandling bör initieras inom primärvården. När patienten kommer till endokrinologen påbörjas i de flesta fall behandling med tyreostatika för att minska produktionen av fT3 och fT4. Tyreostatika hämmar enzymet tyreoperoxidas (TPO), som är essentiellt i hormonsyntesen [6]. Behandlingen botar inte Graves sjukdom, som beror på att antikroppar (TSH-receptorantikroppar; TRAK) stimulerar sköldkörteln, men tyreostatika har en immunmodulerande effekt antingen via en direkt effekt på tyreoidea-autoimmuniteten eller genom att eutyreoidism återställer den avvikande immunreaktionen [7]. I enstaka fall kan man avvakta med behandling av lindrig hypertyreos inför behandling med radioaktivt jod och vid subklinisk hypertyreos. Monitorering av fT3 är viktig initialt, eftersom fT4-nivåerna normaliseras hos vissa patienter medan förhöjningen av fT3, och därmed hypertyreosen, kvarstår [8].
Tiamazol är förstahandsbehandling (undantaget vid graviditet, toxisk kris och lindriga biverkningar, då propyltiouracil föredras). Propyltiouracil (licenspreparat) påverkar levern i större utsträckning [9] och har kortare halveringstid. Vanligtvis rekommenderas 2 doser tiamazol per dygn på grund av snabbare effekt, men sannolikt räcker 1 dos per dygn [10], vilket är bra att veta vid bristande behandlingsföljsamhet.
Tyreostatika kan antingen ges som monoterapi, då dosen titreras för att uppnå eutyreoidism, eller som avstängnings- och ersättningsbehandling (»block and replace«), då tyreostatika ges i hög dos och levotyroxin ersätts upp till eutyreoidism. Internationellt går trenden mot monoterapi, då den ger färre biverkningar [11, 12]. I Sverige, där »block and replace« fortfarande är vanligast, har vi valt att inte rekommendera den ena behandlingen framför den andra då en metaanalys visade färre recidiv efter »block and replace« än efter monoterapi [13]. De individuella förutsättningarna får styra om risken för recidiv eller biverkningar väger tyngst.
Vanliga biverkningar av tyreostatika är utslag, nässelutslag och ledvärk (1–5 procent). Vid lindrigare hudreaktioner kan antihistamin ges parallellt med oförändrad tyreostatikabehandling, eller så testas en annan sorts tyreostatika. Vid allvarliga allergiska reaktioner eller allvarliga biverkningar ska ytterligare tyreostatika inte ges, utan kirurgi eller behandling med radioaktivt jod rekommenderas. Allvarliga biverkningar (hepatit, pankreatit, allvarlig leverskada, vaskulit och agranulocytos) [14] förekommer hos 0,1–1 procent av dem som behandlas [10, 15]. Agranulocytos inträffar ofta inom de första 3 månaderna, men kan inträffa under hela behandlingen [15]. I vårdprogrammet rekommenderas rutinmässig provtagning av vita blodkroppar (neutrofiler) och leverstatus, när prov ändå tas under de första 6 veckorna, och därefter vid behov i enlighet med internationella riktlinjer. Alla patienter bör informeras om biverkningar muntligt och skriftligt. I vårdprogrammet finns förslag till patientinformation.
Patientens val av behandling
I en undersökning från 2003–2005 av patienter med Graves sjukdom konstaterades att 70 procent av patienterna i Sverige får tyreostatika, 25 procent behandling med radioaktivt jod och 5 procent kirurgi som förstagångsbehandling [4]. Sedan dess har sannolikt andelen patienter behandlade med radioaktivt jod minskat. Vid behandling med radioaktivt jod behöver ca 80 procent levotyroxin, vilket innebär att behandlingen varit framgångsrik, då hypotyreos eftersträvas vid Graves sjukdom. Vid kirurgi är siffran närmare 100 procent [4]. Levotyroxin användes dessutom av 10 procent av patienter som fått tyreostatika.
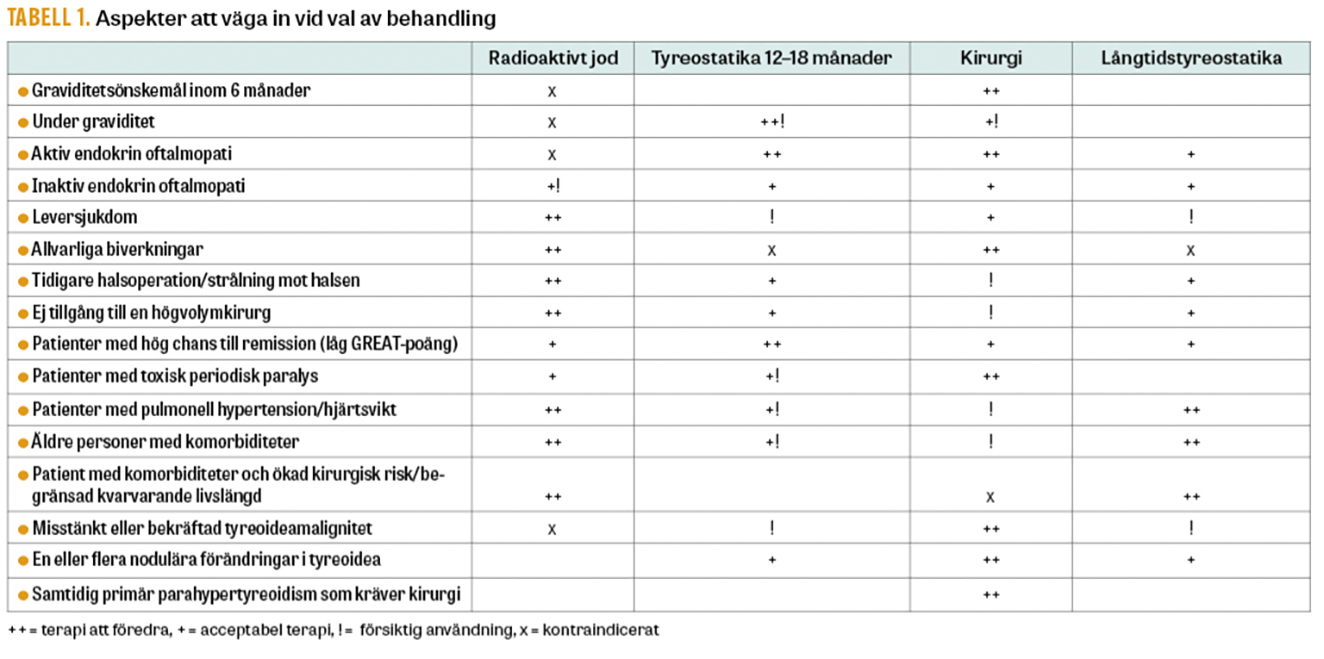
Patienten bör vara välinformerad om behandlingsalternativen för att kunna delta i beslut om behandlingsinriktning. Följande parametrar vägs in: risken för recidiv och dess medicinska konsekvenser, risken för kronisk hypotyreos, risken för komplikationer av behandlingen, risken för ögonen, graviditetsönskan och den individuella upplevelsen av att ha fått Graves sjukdom (Tabell 1).
Individualiserad värdering av recidivrisken
Det går att förutse den individuella risken för recidiv [16]. I ett formulär för GREAT-skalan förs patientens ålder, nivån av fT4 och TRAK samt strumastorleken in, vilket placerar patienten i en av tre riskklasser [17]. I klass I är den relativa risken för recidiv 16 procent, i klass II 44 procent och i klass III 68 procent (Fakta 1). I klass II kan riskprognostiseringen skärpas genom GREAT+, där tre HLA-antigener och en polymorfi bestäms. Den relativa risken i klass II kan då variera från 4 till 80 procent. Bedömning med GREAT+ utförs om genetiska analyser finns tillgängliga. I vårdprogrammet finns reservation för att så inte är fallet, och därför rekommenderas i första hand GREAT-skalan. I vårdprogrammet återfinns formulär för båda skalorna.
Hälsoekonomiska aspekter på behandlingsvalet
Med kostnadseffektivitet menas relationen mellan den nytta en åtgärd åstadkommer för en patient och kostnaden för åtgärden. Det vanligaste måttet på nyttan för patienten är vunna kvalitetsjusterade levnadsår (QALY).
Det saknas svenska studier av kostnadseffektivitet för behandling av Graves sjukdom. Vi har därför initierat en kostnadseffektanalys baserad på den svenska långtidsuppföljningen [4]. Analysen av QALY är ännu inte slutförd men kommer att publiceras i en egen artikel. Resultaten av kostnadsanalysen visar att kostnaden för en patient är högre än kostnaden per behandling, vilket beror på att många patienter får flera behandlingar. Det är vanligt att tyreostatika ges under några år, men att en operation ändå blir nödvändig. Om gentest och riskvärdering med GREAT införs skulle vissa patienter erbjudas operation tidigare, vilket medför besparingar för sjukvården.
Val av behandling på längre sikt
Tyreostatika. Behandling med tyreostatika pågår oftast i 12–18 månader, med avsikten att TRAK under tiden ska normaliseras. Vanligen sätts tyreostatika ut tvärt, medan levotyroxinbehandlingen pågår ytterligare 3–4 veckor för att undvika hypotyreos [18]. Recidiv är vanligast under första året efter avslutad behandling. Patienter som efter 12–18 månaders behandling uppvisar höga TRAK-nivåer kan antingen fortsätta med tyreostatika eller planeras för tyreoidektomi eller behandling med radioaktivt jod. En andrahandsmöjlighet om TRAK bara är lätt förhöjda är att prova ett uppehåll i tyreostatikabehandlingen för att se om de övergått till en neutral icke-stimulerande form.
Risken för recidiv kan minimeras genom att fortsätta med tyreostatika i uppemot 5 år, trots att TRAK normaliserats [19]. Denna behandlingsstrategi är ny och fortfarande ett andrahandsalternativ. Teorin är att en fortsatt effekt på immunsystemet kan föreligga. Behandlingen är säker med en låg förekomst av allvarliga biverkningar [20, 21]. I en randomiserad studie med 4 års uppföljning efter tyreostatika hade 53 procent i den konventionellt behandlade gruppen recidiverat, jämfört med 15 procent i en grupp som behandlats i 95 månader [22].
I vissa situationer är livslång behandling med tyreostatika att föredra [23]. Detta gäller främst äldre patienter med komorbiditet som inte kan genomgå behandling med radioaktivt jod. Obehandlad hypertyreos ökar risken för hjärt–kärlhändelser, förmaksflimmer och död [24], vilket är kopplat till exponeringstiden för hypertyreos [25]. Snabb och framgångsrik behandling oavsett metod minskar mortaliteten [26].
Kirurgi. Patienter med Graves sjukdom opereras med total tyreoidektomi. Postoperativ övergående hypokalcemi är vanlig och kan minskas genom att preoperativt justera nivån av 25-OH-vitamin D3 >30 nmol/l och albuminkorrigerat kalcium >2,20 mmol/l [27-30]. Vid remiss till kirurg bör därför 25-OH-vitamin D3 och kalciumnivåer kontrolleras av endokrinolog, som vid behov bör initiera kalcium-/vitamin D-behandling fram till operation. Sedvanlig utredning görs parallellt kring orsaken till de låga kalk-/vitamin D-nivåerna.
Inför operation ska patienten vara kliniskt eutyreoid, helst under 3 månader, och ha en vilopuls <80 slag/minut, för att peri- och/eller postoperativ aggravering av sjukdomen med risk för tyreotoxisk kris ska minimeras [31]. Bedöms patienten fortfarande vara tyreotoxisk bör operationen skjutas upp. Ingreppet bör ske med intraoperativ nervmonitorering för att undvika stämbandspares.
Vid okontrollerad Graves sjukdom, till exempel vid kontraindikationer mot tyreostatika, bör jodjodkalium (Lugols lösning) övervägas inför tyreoidektomi. Lugols lösning sänker övergående hormonproduktionen i tyreoidea [32, 33]. Förslag till dosering är jodjodkalium APL 5 procent, 5 droppar 3 gånger dagligen med start 10 dagar före operation (extempore) fram till dagen före operation. fT4 kontrolleras efter 5 dagars behandling. Dosen kan ökas till 10–15 droppar × 3 om fT4 inte sjunkit och/eller om kvarstående puls är >90 efter 3–5 dagar. Behandlingen bör lämpligen initieras av endokrinkirurg, som planerar tidpunkten för operation. Operationen rekommenderas att utföras under 7:e–10:e dagen, då patientens hypertyreos annars kan förvärras eftersom effekten av jodblockeringen på hormonsyntesen börjar släppa.
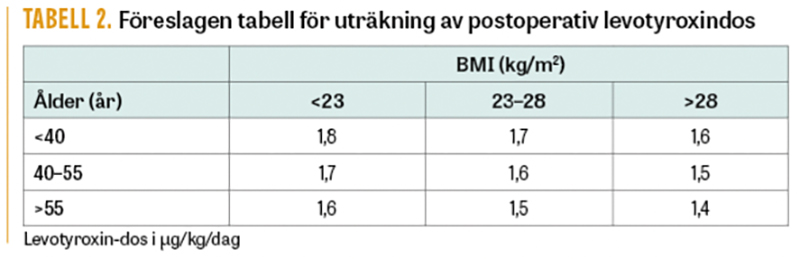
Efter total tyreoidektomi bör paratyreoideahormon (PTH) och kalkvärden kontrolleras efter 2–6 timmar och/eller nästa dags morgon. Levotyroxindosen bör optimeras så att hypotyreos och sekundär endokrin oftalmopati undviks. Att väga in både ålder och BMI ger högst andel normal sköldkörtelfunktion (68 procent) vid första postoperativa kontrollen [34], varför vi rekommenderar att formeln i Tabell 2 används. I vårdprogrammet återfinns patientinformation både för tiden före och efter operation samt en lista med adekvata ICD-10- och KVÅ-koder (klassifikation av vårdåtgärder). Konsekvent kodning av diagnoser, åtgärder och komplikationer är avgörande för att data ska kunna användas till kvalitetsindikatorer.
Behandling med radioaktivt jod. Radioaktivt jod ges peroralt i kapsel eller lösning, och den joniserande strålningen leder till en succesiv minskning av tyreoideas funktion. Om sköldkörteln är full av stabilt jod tas inte det radioaktiva jodet upp. Därför bör patienten inte ha fått jodinnehållande röntgenkontrastmedel inom de senaste 1–3 månaderna och inte använda amiodaron, sårkompresser med jod eller hälsokostpreparat med alger eller tång. Utsättning av preparat kan behövas.
Tyreostatika kan ges inför behandling med radioaktivt jod. Detta gäller särskilt äldre patienter och vid kardiovaskulär sjukdom där snabb kontroll av hypertyreosen behövs och det finns risk för försämring vid en uppblossande hypertyreos, vilket kan ske i samband med behandling med radioaktivt jod. Förbehandling med tyreostatika medför dock risk för behandlingssvikt och lägre grad av hypotyreos, då tyreostatika blockerar TPO [35-37]. TPO är viktigt för effekten av joniserande strålning då det katalyserar bildningen av fria radikaler [36, 38-40]. Därför bör tyreostatika sättas ut 7 dagar före undersökning och behandling med radioaktivt jod och eventuellt återinsättas 7 dagar efter behandlingen. För patienter som har svårt att tolerera detta kan kortare utsättningstid övervägas. Levotyroxin sätts ut samtidigt som tyreostatika.
Behandling med radioaktivt jod ökar risken för endokrin oftalmopati [41-43]. Patienter med måttlig/synhotande aktiv endokrin oftalmopati bör inte genomgå behandling med radioaktivt jod, och de med lindrig aktiv endokrin oftalmopati bör erbjudas steroidprofylax om radiojodbehandling är aktuell. Steroidprofylax kan också övervägas till de patienter som har riskfaktorer för endokrin oftalmopati, som rökning eller hög TRAK-nivå (>8,8 IU/l), eller har inaktiv endokrin oftalmopati. Vinsten för ögonen bör vägas mot risken för biverkningar av kortisonbehandling. Prednisolon 0,4–0,5 mg/kg kroppsvikt rekommenderas [41, 44]. Ett praktiskt schema är 30 mg/dag under 1 månad och sedan nedtrappning med 5 mg varje vecka till 10 mg/dag, därefter nedtrappning med 2,5 mg varje vecka, med total behandlingstid 3 månader. Sällan behövs doser över 40 mg, och något lägre doser än 30 mg kan övervägas hos äldre sköra patienter.
Strålskyddsrekommendationer ska ges muntligt och skriftligt till patienten för att reducera stråldosen till anhöriga och allmänhet. Vi har enats om nationella strålskyddsrekommendationer eftersom informationen varit varierande. Dessa finns som bilaga till vårdprogrammet, tillsammans med tabeller för individuella beräkningar av restriktionstider samt patientinformation om behandling med radioaktivt jod. Om läkare bedömer att patienten inte kan följa strålskyddsrekommendationer på grund av livssituation eller kognitiv förmåga ska annan behandling väljas. Försvårande omständigheter kan vara urininkontinens, då radioaktivitet utsöndras via urinen, eller om patienten inte kan sköta sig själv, då strålskyddet också behöver värderas för personal som sköter omvårdnaden.
Valet av aktivitet vid behandling med radioaktivt jod är en avvägning mellan tillräckligt hög stråldos för att uppnå behandlingseffekt och onödig stråldos för patienten. Detta innebär att ALARA (as low as reasonably achievable)-principen tillämpas [45]. För att följa Strålsäkerhetsmyndighetens föreskrifter om individuell dosanpassning bör individuellt beräknad aktivitet, med absorberad måldos i gray (Gy) baserad på upptag av radioaktivt jod, tyreoideastorlek och värdering av effektiv halveringstid, användas [46, 47]. I vårdprogrammet rekommenderas ett förenklat protokoll [48, 49] där antalet sjukhusbesök minimeras. Det är resurseffektivt, väl applicerbart i svensk sjukvård och uppfyller Strålsäkerhetsmyndighetens föreskrifter och ALARA-principen. Protokollet finns som bilaga till vårdprogrammet. Vårdprogrammet föreslår också att 120–200 Gy används vid Graves sjukdom med målsättningen att uppnå hypotyreos [50].
Uppföljning efter behandling
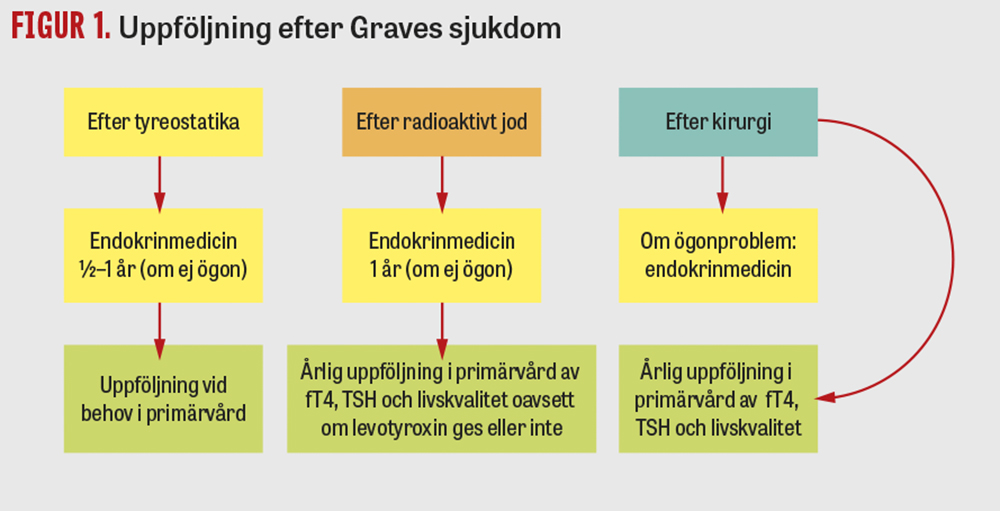
Vid avslutande av tyreostatikabehandling bör endokrinolog bedöma om recidivrisken är låg, måttlig eller hög, baserat på patientens GREAT-poäng. Vid låg recidivrisk följs patienten vid endokrinenhet under 6 månader med provtagning efter 6–8 veckor. Patienter med måttlig och hög risk följs under 1 år med prov var 6:e vecka respektive var 4–6:e vecka under första halvåret och därefter var 2–3:e månad (Figur 1). Om remission föreligger därefter kan kontrollerna avslutas. Patienten bör informeras om hyper- och hypotyreossymtom, och i vårdprogrammet finns information både till patienten och till primärvården.
4–6 veckor efter operation kontrolleras fT4 och TSH var 4–8:e vecka tills värdena stabiliserats och sedan årligen. Albuminkorrigerat kalcium kontrolleras 6 veckor och 6 månader postoperativt samt vid behov. Patienten remitteras till primärvården när situationen stabiliserats avseende levotyroxin, förutsatt att ögonsymtom inte föreligger. Föreligger permanent hypoparatyreoidism kommer patienten successivt att återremitteras till endokrinolog.
Efter behandling med radioaktivt jod bör uppföljning med kontroll av TSH, fT3, fT4 och TRAK göras efter 3 veckor och sedan var 4–6:e vecka de första 6 månaderna, därefter glesare under nästkommande 6 månader. Substitution sker redan vid normala hormonvärden för att undvika hypotyreos. TRAK-nivån stiger ofta efter en behandling med radioaktivt jod och kan stimulera en kvarvarande tyreoidearest, vilket gör att levotyroxindosen kan variera. Då hypotyreos eller starkt svängande ämnesomsättning kan påverka ögonen negativt vid Graves sjukdom är det viktigt med adekvat kunskap och uppföljning, varför patienten finns kvar hos endokrinologen 1 år efter behandling med radioaktivt jod. När substitutionsbehandlingen blivit stabil överförs patienten till primärvården för fortsatt årlig uppföljning (Figur 1). Vid utveckling av endokrin oftalmopati fortsätter endokrinolog att ha patientansvaret.
Hormonersättning efter kirurgi/radioaktivt jod
Levotyroxinbehandlingen har tre mål: uppnå målvärde för TSH, uppnå förbättring/symtomfrihet av hypotyreotiska symtom och undvika överbehandling [51]. Majoriteten av patienterna med levotyroxin mår bra. En minoritet av substituerade patienter (5–10 procent) upplever kvarvarande symtom på hypotyreos efter kirurgi respektive behandling med radioaktivt jod [52]. Orsaken är oklar, men olika möjligheter finns beskrivna [52, 53]. Levotyroxindosen behöver vara högre för att normalisera fT3 än fT4 [54], och därför är målvärdet för TSH i det nedre intervallet av referensområdet (0,4–2,0 mIU/l). Levotyroxindoser som ger normalt TSH medför inte att alla perifera tyreoideamarkörer normaliseras [55]. Frågan har därför uppkommit huruvida T3 (liotyronin) behöver läggas till.
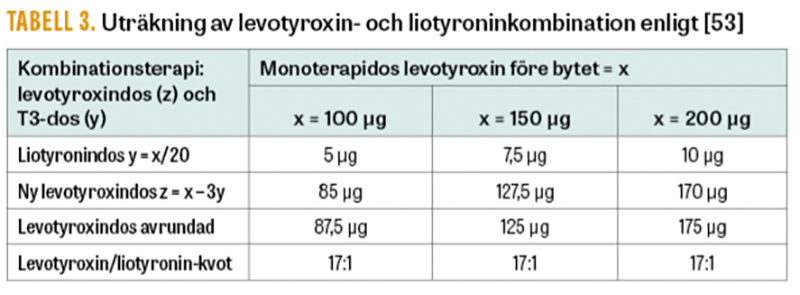
Det saknas behandlingsstudier som undersökt om symtomen minskar genom normaliserad T3-nivå, och det råder inte enighet bland experter om huruvida levotyroxin och liotyronin bör användas [52, 53]. I europeiska riktlinjer [52] rekommenderas att levotyroxin och liotyronin prövas vid kvarvarande symtom under 6 månader om man uteslutit effekter av kronisk natur av sjukdomen och annan autoimmunitet. Inför behandling bör således även andra somatiska/psykologiska/psykiatriska förhållanden värderas. Ett fysiologiskt förhållande mellan fT3 och fT4 och ett normalt TSH bör eftersträvas, och förslagsvis kan beräkningen göras som i Tabell 3. Behandlingen ska ges som enskilda tabletter av levotyroxin respektive liotyronin och inte som kombinationstabletter (DTE, torkat svinsköldkörtelextrakt), eftersom de innehåller för hög T3-komponent. En långverkande T3-beredning är det som står på önskelistan.
Säkerheten med T3-tillägg är viktig. I en skotsk studie påvisades ingen ökad risk för kardiovaskulära händelser, förmaksflimmer och frakturer, men fler patienter bland de T3-behandlade hade antipsykotiska läkemedel [56]. Dessutom visades nyligen i en svensk registerstudie inte någon ökad risk för cancer eller död för dem som stod på T3 [57].
Om kombinationsbehandling övervägs, rekommenderar vi att ett patientkontrakt upprättas för att stärka patientens delaktighet och samverkan genom en överenskommelse kring planeringen av fortsatt behandling. Vi rekommenderar också att kvarvarande symtom värderas med livskvalitetsformulär (se bilagor i vårdprogrammet) både före och efter ett halvårs försöksbehandling. Behandlingen ska sättas ut om ingen förbättring konstateras. Denna rekommendation gäller enbart patienter som genomgått ablativ behandling och ska inte extrapoleras till all hypotyreos.
Konklusion
Behandlingen av Graves sjukdom har sedan 1950-talet uppdaterats, men behandlingsrutinerna har varierat runt om i landet. Viktiga framsteg manifesteras i detta vårdprogram [1], såsom precisionsmedicin med GREAT-skalan, preoperativ kalcium-/vitamin D-behandling, individualiserad levotyroxindosering efter kirurgi och möjligheter till en enhetlig substitutionsbehandling. Dessutom ger detta vårdprogram nationell patientinformation och strålskyddsrekommendationer för en harmoniserad och likvärdig vård.
Författarna är representanteter för Nationell arbetsgrupp (NAG) hypertyreos, den nationella kunskapsorganisationen. Helena Filipsson Nyström är ordförande.
Potentiella bindningar eller jävsförhållanden: Helena Filipsson Nyström har föreläsaruppdrag för BMS, IBSA, Siemens och Equalis och är ordförande i rådgivande kommitté för Orifarm.