Svenska intensivvårdsregistret samlar in och analyserar data avseende intensivvård i Sverige.
Data från registret kan ge en överblick gällande tillgängliga vårdplatser och beläggning på svenska intensivvårdsavdelningar samt patienternas demografiska och kliniska karakteristika och i vilken grad de överlever.
Därigenom kan patientgrupper med sämre prognos identifieras, vilket kan vara en del i ett underlag för den enskilda patientens prognos och ger möjlighet till reflektion kring rimligheten av intensivvård och invasiva åtgärder som potentiellt kan innebära obehag för patienterna.
Sverige har ett flertal kvalitetsregister avsedda för olika patientgrupper. Dessa register samlar in data med huvudsakligt syfte att utveckla kvaliteten i vården, men även för forskningsändamål. Intensivvården är ett område där brist på resurser ofta förekommer och där behov av prioriteringar kan uppstå. Författarna av denna artikel är medlemmar i styrgruppen för Svenska intensivvårdsregistret (SIR) och diskuterar därför möjligheten att använda registerdata för att underlätta prioriteringar inom intensivvården.
Svenska intensivvårdsregistret etablerades 2001 på initiativ från flera avdelningar med målsättningen att jämföra behandlingar och utfall. Sedan 2020 rapporterar samtliga Sveriges allmänna, barn-, torax-, neuro- och brännskade-intensivvårdsavdelningar (Iva) data. Registret samlar in omfattande data, inkluderande avdelningarnas resurser och beläggning samt information om patienternas kroniska sjukdomar, grad av skörhet, akut sjuklighet vid ankomst, ålder, kön, diagnoser, behandlingar, vårdtider, mortalitet på Iva och patienternas fysiska och psykiska status vid uppföljning efter vården.
Intensivvårdsregistret har i dag förmåga att snabbt anpassa inrapportering av data samt generera utdata baserat på aktuella frågeställningar. Denna flexibilitet var av stor betydelse under covid-19-pandemin för insamling av data om covid-19-patienter på Iva. Under pandemin byggde Socialstyrelsens rapportering och sammanställning av intensivvårdade covid-19-patienter helt på data från registret, och registerdata rapporterades också flitigt i nyhetsmedierna. Även Folkhälsomyndigheten erhöll data från registret avseende covid-19-populationen och redovisade dessa data i olika medier.
Tillsammans med platsregistreringen och den nationella samordningen av intensivvårdsresurser, som registret ansvarar för, utgör registret ett kraftfullt verktyg som snabbt kan tas i bruk vid till exempel en pandemi, särskild händelse eller krig. Denna rapportering av både hälsodata och beläggningsdata från Iva är av avgörande betydelse ur ett civilberedskapsperspektiv.
I nuläget saknas det andra system för att fånga patientflöden, belastning och tillgängliga resurser inom intensivvården i Sverige.
Kan data användas för att predicera utfall?
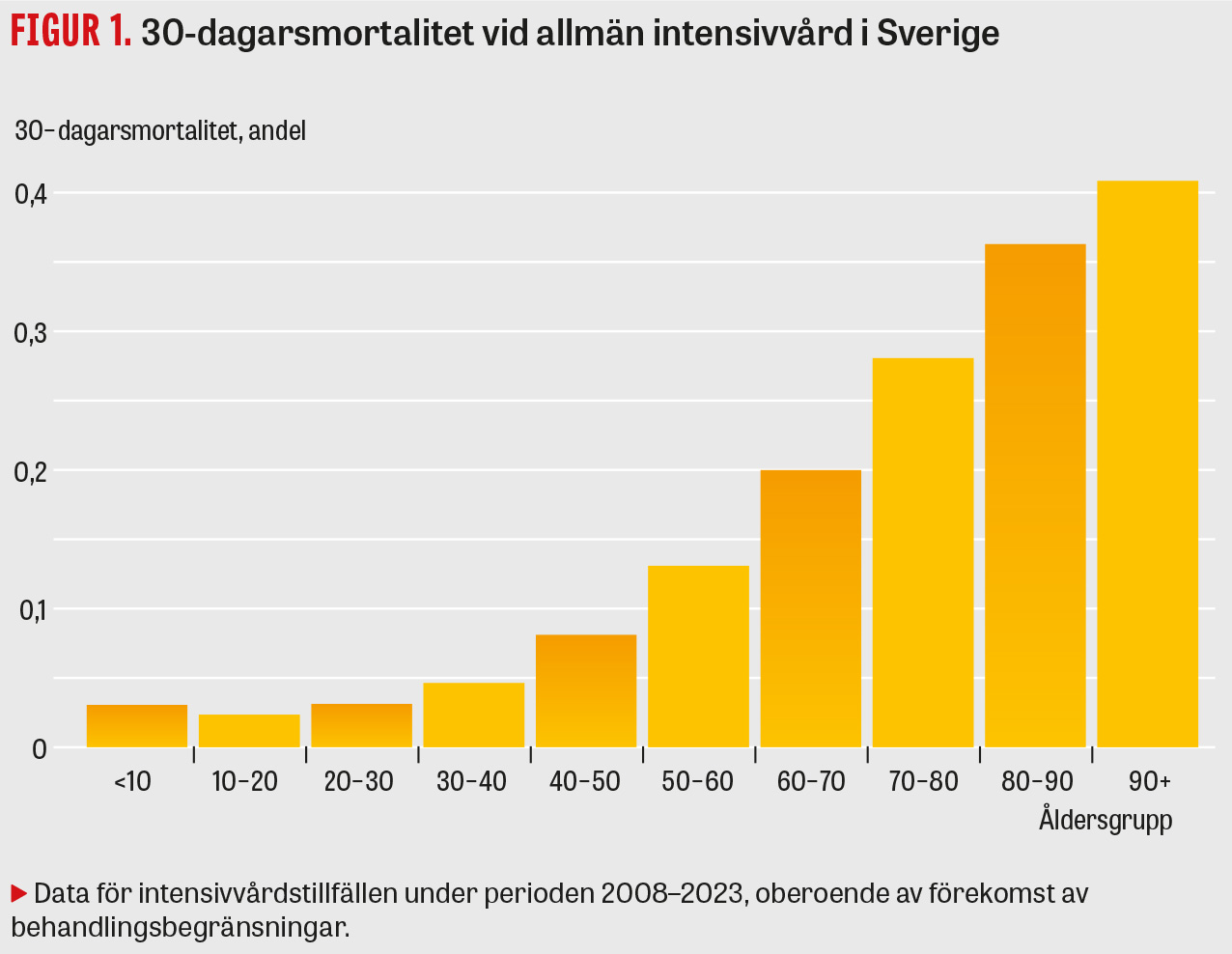
Det finns betydande skillnader i risk att avlida hos patienter som vårdas på Iva, beroende på exempelvis orsak till intensivvård, grad av sjuklighet, kroniska sjukdomar och ålder. Åldern har stor betydelse (se Figur 1).
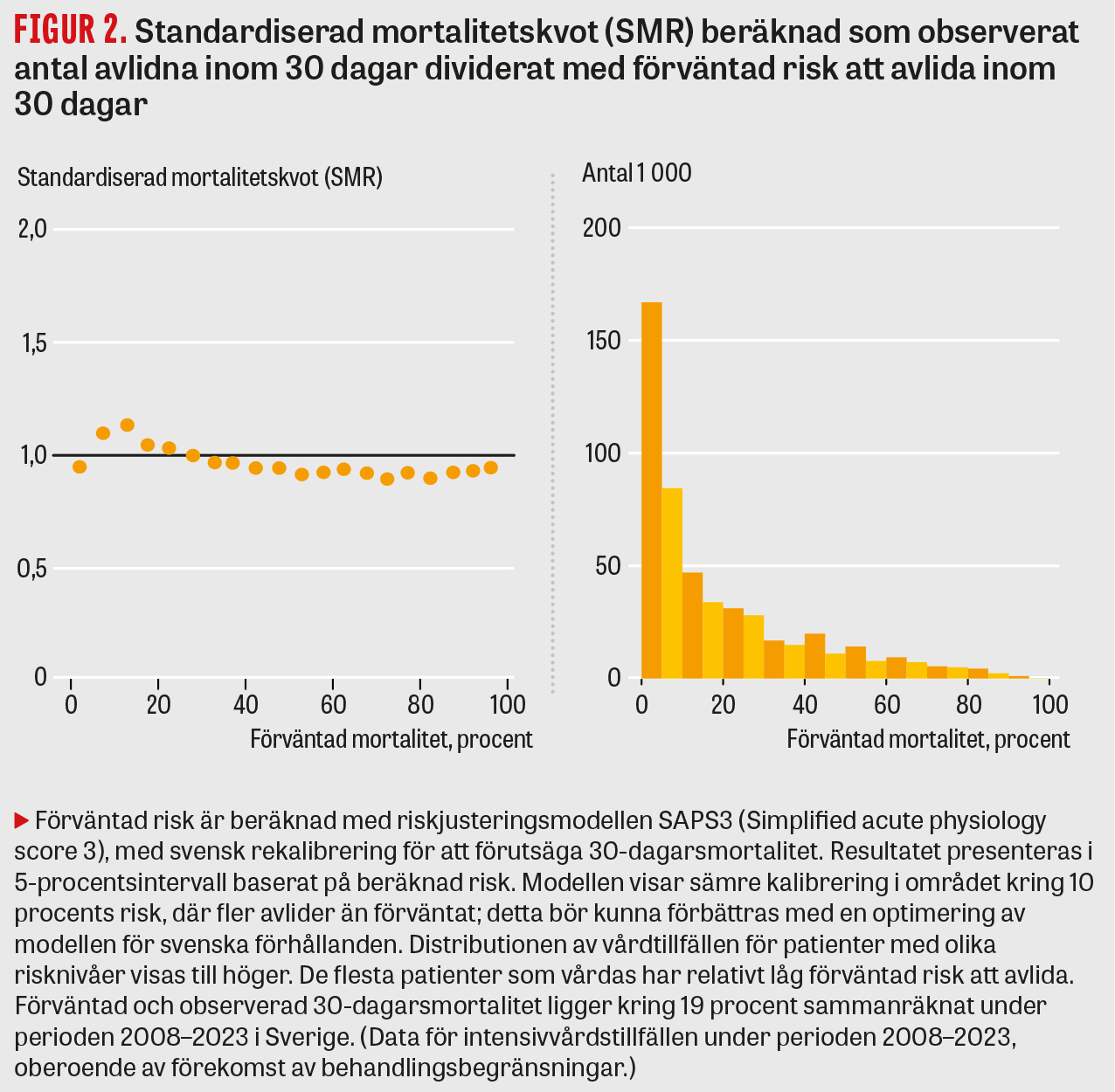
En kvalitetsindikator som ofta används internationellt inom intensivvården är därför riskjusterad mortalitet, vilket innebär att antalet faktiskt avlidna divideras med antalet förväntade dödsfall baserat på patienternas ålder och sjukdomsgrad. I Sverige används modellen SAPS3 (Simplified acute physiology score 3)[1] för att beräkna den förväntade dödligheten, vilken har justerats för svenska förhållanden [2]. Genom att ta hänsyn till patientens kroniska sjukdomar, omständigheter vid inläggning på Iva, orsak till inläggning och mätvärden vid inläggning kan en förväntad risk för att avlida beräknas. I originalmodellen beräknas risken under sjukhusvistelsen, medan den svenska anpassningen beräknar risken inom 30 dagar. Modellen är bra på att identifiera en ökad risk hos dem som sedan avlider och ger en relativt korrekt uppskattning av förväntad mortalitet på gruppnivå. Ett enkelt mått på modellens kalibrering i stort är standardiserad mortalitetskvot (SMR). Om SMR är 1 avlider lika många som förväntat, medan en lägre SMR betyder att färre patienter än förväntat har avlidit. I Figur 2 visas SMR i olika intervall av förväntad risk, vilket till exempel visar att ungefär 95 procent av patienter med en beräknad risk omkring 95 procent avlider. Större delen av patientpopulationen har relativt låg risk att avlida.
Det finns potential att förbättra modellen något genom att lägga till en bedömning av patientens skörhet [3]. ICNARC (Intensive Care National Audit and Research Center), registrets motsvarighet i Storbritannien, använder till exempel en enklare bedömning av patientens funktionsnivå före intensivvården i sin modell [4]. Dock är skörhetsbedömningar förenade med en viss osäkerhet, då de baseras på en bedömning av patientens status före sjukhusvården och information om detta initialt kan vara bristfällig.
Riskjusteringsmodellen kan optimeras ytterligare något för svenska förhållanden, fler variabler kan läggas till och maskininlärningstekniker kan användas [5]. Trots att artificiell intelligens och maskininlärning har testats inom intensivvården under lång tid används dessa modeller bara på forskningsstadiet; de är dåligt utvärderade ur vetenskaplig synvinkel och inte robusta [6, 7].
Således skulle data från intensivvårdsregistret kunna användas för att direkt eller indirekt beräkna risken för dödlighet när det övervägs om en patient ska tas till Iva. Dock blir ansvarsbiten oklar om man låter modeller prioritera patienter. Vem bär ansvaret om det blir fel? Är det tillverkaren av datorn, programvaran, modellen eller övervakningsutrustningen, den som matar in data eller den som undersöker patienten?
Bedömning för ställningstagande till intensivvård
Vid användning av en modell som beräknar risk för dödlighet för ställningstagande till vård måste flera aspekter bedömas och avvägningar göras. Ett första ställningstagande är inom vilken tidsram som överlevnad är relevant. Gagnar det patienten att överleva intensivvården men avlida direkt på vårdavdelning, eller att överleva sjukhusvistelsen men avlida direkt efter ankomst till hemmet? Är det överlevnad i 30 dagar som är av betydelse, eller krävs 90 dagar för att motivera lidandet för patienten och resurserna som används? Denna bedömning kan variera för olika patienter och kan påverkas av patientens status under denna tid. Har patienten möjlighet att återvända hem en sista tid eller ligger patienten medvetslös på Iva eller sjukhuset?
Att överleva innebär inte nödvändigtvis att patienten får ett kvalitativt liv efter intensivvården, exempelvis vid svåra hjärnskador. Vi saknar i dag verktyg för att förutse livskvalitet efter intensivvården, men registret samlar in data om fysiskt och psykiskt mående samt arbetsförmåga vid uppföljning efter intensivvården för att kunna undersöka detta. Dessutom krävs överväganden kring vilken risknivå för dödlighet som anses acceptabel för att motivera intensivvård av en patient. Det finns en betydande risk för att vårdpersonal, patienter och deras anhöriga har olika uppfattning om detta. Dessutom kan bedömningen påverkas av faktorer som olika förväntad återstående livslängd, vilken varierar mellan exempelvis ett barn och en 95-åring. En ytterligare parameter som har betydelse är vilken vård som krävs. Det kan handla om kort behandling med vasopressor på grund av sepsis eller månader av sedering och urträning ur respirator. Dessa överväganden är viktiga både med avseende på patientens lidande och på hur resurserna utnyttjas. Intensivvård är ofta förknippad med psykiskt lidande under vårdtiden och kvarstående både psykiska och fysiska besvär efter avslutad vård.
Det finns i dag ingen modell för intensivvård som väger in både mortalitet, livskvalitet, obehag, psykiska konsekvenser och resursanvändning. För att göra prioriteringar baserade på data krävs ännu tydligare gränsdragningar. Därför är etiska diskussioner nödvändiga för att kunna införa välgrundade prioriteringar i intensivvården.
När läkare i dag gör prioriteringar väger vi in både risken att avlida, förväntad återstående livslängd, möjlighet till livskvalitet samt vilken vård som skulle krävas. Ytterligare ett övervägande är att vinsterna med vården måste överväga riskerna både ur ett etiskt och ett resursmässigt perspektiv. Beslut om initiering av intensivvård görs i allmänhet i samråd mellan intensivvårdsläkare och läkare som är specialister på patientens aktuella sjukdomsområde. När beslut tas om hur länge det är rimligt att fortsätta med intensivvården och huruvida behandlingsbegränsningar ska göras har ofta mer information framkommit och sjukdomsförloppet har kunnat observeras. Denna bedömning involverar som regel intensivvårdsläkare, specialister inom patientens sjukdomsområde, övrig vårdpersonal och en dialog med patienten eller dennes familj, där hänsyn tas till patientens livssituation före sjukhusinläggningen.
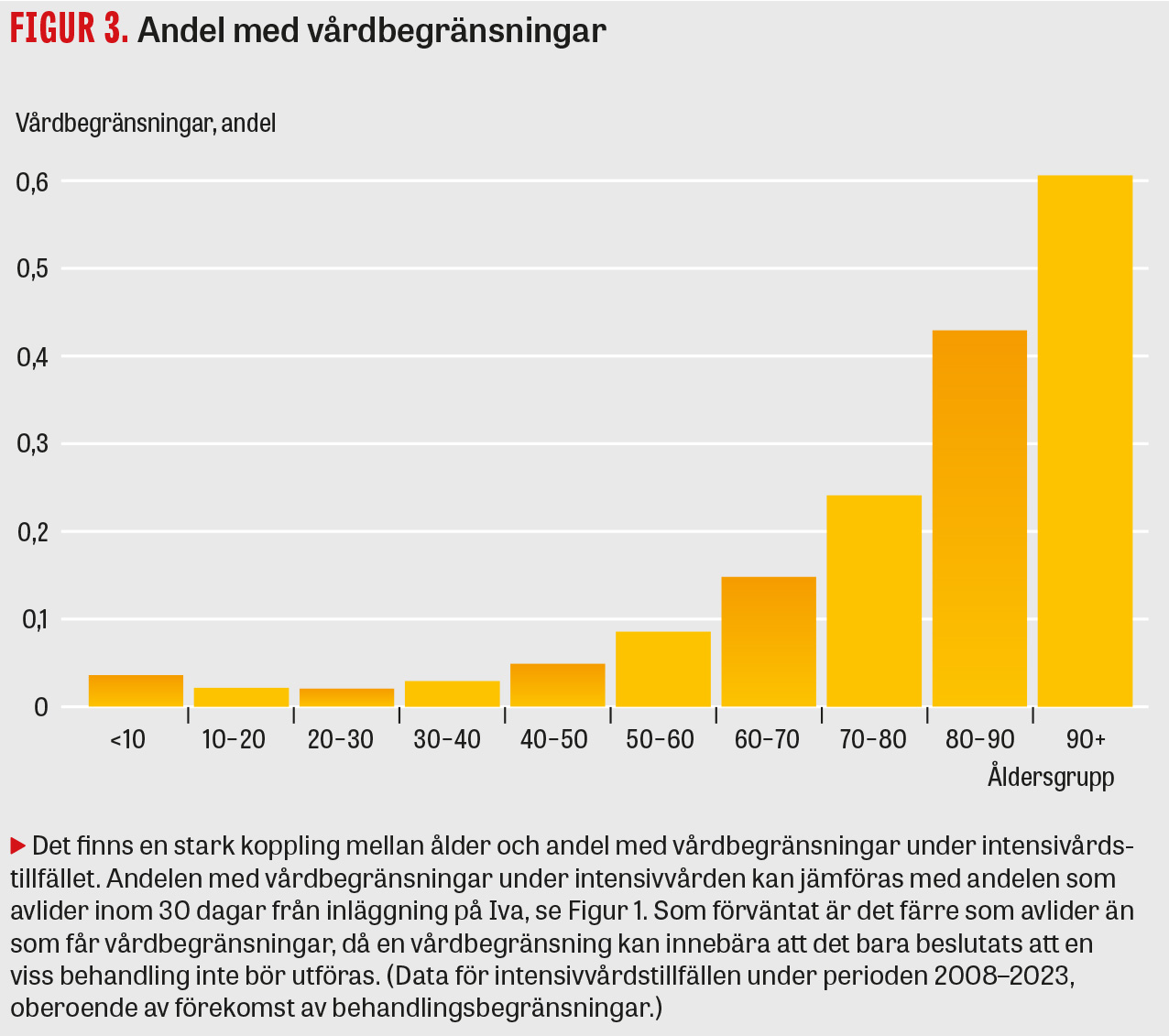
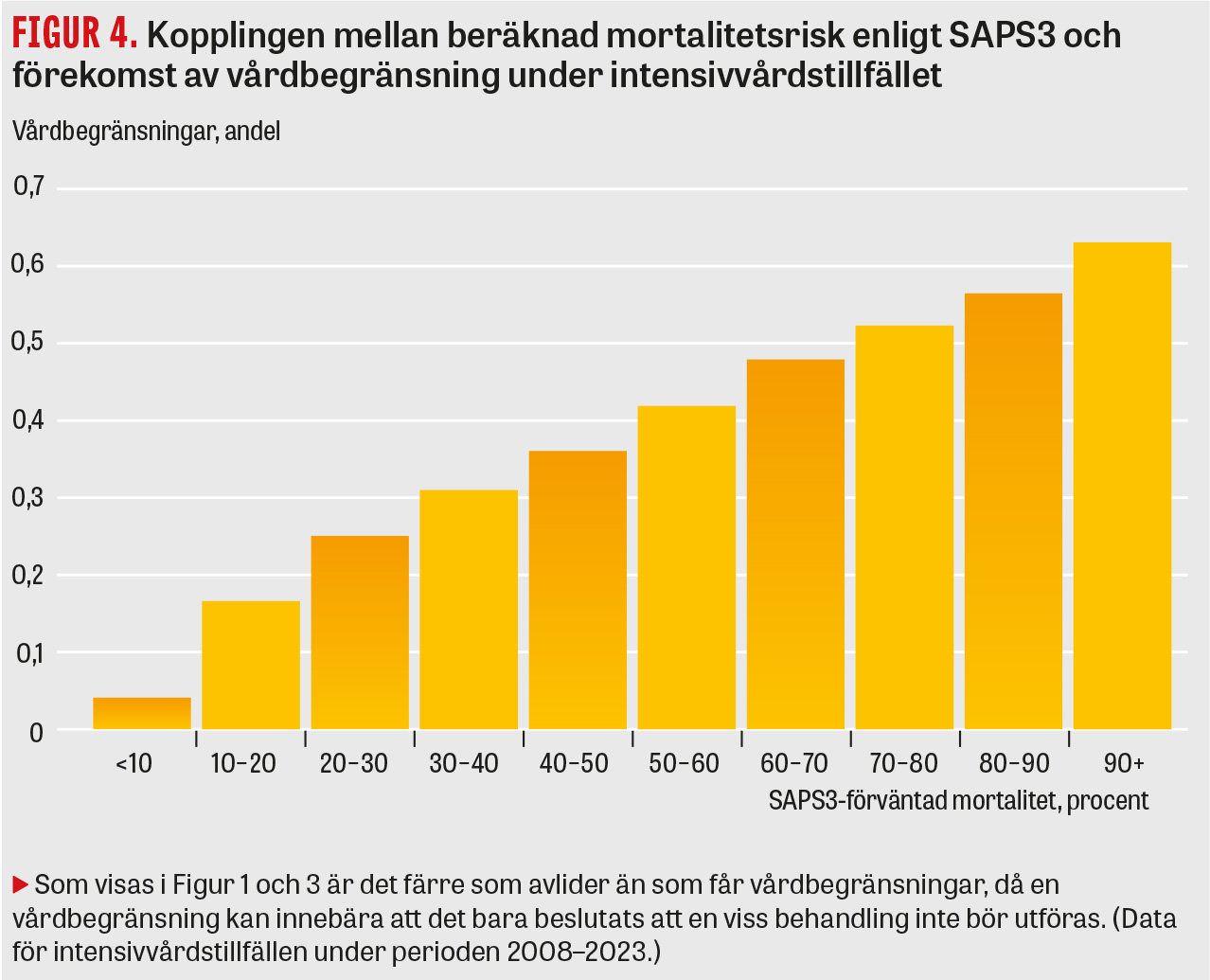
Det finns en tydlig korrelation mellan ålder och beslut om vårdbegränsningar för patienter som vårdas på Iva (se Figur 3), liksom mellan mortalitetsrisk beräknad med SAPS3 och förekomst av vårdbegränsningar (se Figur 4). Var gränsen ska dras för när chansen till ett gott resultat av vården är för låg kan man fundera på, och det handlar som nämnts inte bara om mortalitet utan även om livskvalitet, vilka resurser som krävs och vilket lidande patienten behöver utstå.
Hur kan den demografiska utvecklingen påverka Iva?
Med den demografiska utvecklingen, där vi år 2030 kommer att ha 50 procent fler medborgare i ålder >85 år, kommer sannolikt behovet av intensivvård att öka. Under perioden 2008–2022 har medianåldern för dem som läggs in på Iva successivt stigit från 61 år till 64 år.
En av de vanligaste diagnoserna på Iva är hjärtstopp [8[, vilket med en åldrande befolkning [9] kan leda till ökat behov av intensivvård och, utan nya resurser, till ett ökat behov av prioriteringar. Medianvårdtiden för hjärtstopp är också nästan dubbelt så lång som i intensivvården generellt, då bedömning av neurologisk återhämtning blir säkrare efter 3 dygn.
Hjärtstopp är förknippat med en hög mortalitet. Hos de selekterade patienter som överlever initialt och tas till Iva ligger 30-dagarsmortaliteten kring 60 procent. Denna siffra stiger till 65 procent för dem som haft hjärtstopp utanför sjukhus, och hos personer över 70 år ökar den ytterligare till 70 procent. Vid minst måttlig skörhet enligt Clinical frailty scale ökar 30-dagarsmortaliteten ytterligare till 85 procent, och överlevnaden efter 180 dagar är endast drygt 5 procent. Sådana bedömningar görs i större eller mindre grad vid ställningstagande till intensivvård, och analys av data från intensivvårdsregistret ger fakta om prognos för olika patientgrupper som bedömningarna kan grundas på. I patientgrupper med hög mortalitet, hög ålder och stor resursåtgång kan vi behöva prioritera. En utmaning är i så fall hur vi ska etablera en nationell konsensus angående prioriteringsprinciper i framtiden.
Ett problem med att använda registrets data för prioriteringar inom intensivvården är att information bara finns om de patienter som faktiskt vårdats på Iva. Vi saknar data om dem som inte bedömdes gagnas av intensivvård och inte togs till Iva. Man bör även ha i åtanke att användandet av historiska data för ställningstagande till vård riskerar att ge en självuppfyllande profetia av dålig överlevnad. Om vården läggs ned för patientgrupper som historiskt haft dåligt utfall så kommer det att leda till fortsatt dålig överlevnad inom gruppen.
Slutsats
Det går relativt bra att förutsäga hur stor risken för att avlida i samband med intensivvård är. Emellertid är kvalitetsregistren inte skapade för att fungera som prioriteringsverktyg utan för att följa upp och främja kontinuerlig förbättring av vårdkvaliteten. Genom analys av intensivvårdsdata kan resurskrävande patientgrupper med låg chans att överleva identifieras. Om data ska användas vid prioriteringar inom intensivvården så behöver det fastställas vilken chans till överlevnad som är rimlig att ta samt vilken överlevnadstid som är rimlig att satsa på, och detta behöver relateras till lidande och resursåtgång. Mortalitet är ett grovt utfallsmått, och även andra faktorer som förväntat antal levnadsår och livskvalitet behöver beaktas. Sammanfattningsvis är det svårt att lämna över besluten till beräknade risker, då det finns fler dimensioner att ta hänsyn till. De beräknade riskerna kan dock bidra till en helhetsbedömning. I framtiden kommer vi sannolikt att behöva en nationell konsensus när det gäller prioriteringar med tanke på försämrade resurser i förhållande till vårduppdraget. Det blir en stor utmaning, och etiska överväganden är viktiga.
Författarna sitter i styrgruppen för Svenska intensivvårdsregistret. Johnny Hillgren är registerhållare för Svenska intensivvårdsregistret och Mellansvenska sjukvårdsregionens representant i NPO Perioperativ vård, intensivvård och transplantation. Lars Engerström är styrgruppsledamot i Svenska intensivvårdsregistret.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.