Provsamlingen Swecrit är en del av Region Skånes biobank (BD-47) och innehåller totalt 150 000 prov från omkring 10 000 intensivvårdade patienter.
De kliniska registren Sepcrit, Ardsis, Hjärtstopp i Skåne, Svenska traumaregistret och Covid-IR för diagnosgrupperna sepsis, akut svår lungsvikt, hjärtstopp, trauma respektive covid-19 innehåller precisa kliniska korrelat.
Biomarkörer har analyserats, och planen är att utföra proteomikanalyser med hjälp av masspektrometri och andra metoder samt att undersöka epigenetisk metylering.
Tillstånd finns för att utföra genetiska analyser.
Intresserade forskare inbjuds till samarbete.
Intensivvård innebär att patienter med hotande eller etablerad svikt i vitala funktioner erbjuds en viss vårdnivå, såsom avancerad övervakning, ventilatorstöd eller kontinuerlig dialys. Det är vårdnivån snarare än den fysiska platsen som är avgörande, vilket blev uppenbart under coronapandemin när kritiskt sjuka patienter kunde vårdas på andra avdelningar än en intensivvårdsavdelning (Iva). I Svenska intensivvårdsregistret (SIR) lagras uppgifter om patienter samt deras behandling och utfall på kort och lång sikt. De som vårdas på Iva har många olika sjukdomar. Vanligt förekommande diagnosgrupper är sepsis, akut svår lungsvikt (ARDS), trauma och hjärtstopp samt under coronapandemin även covid-19. Denna variation, och det faktum att många patienter inte kan ge informerat samtycke på grund av medvetslöshet eller nedsövning, innebär speciella utmaningar för intensivvårdsforskningen.
Sepsis är ett exempel på en vanligt förekommande intensivvårdsdiagnos, och omfattande forskning har inte lett till nya behandlingsmetoder, utan dessa består sedan länge av antibiotikabehandling och organunderstödjande behandling. Behandlingsstudier av sepsissyndromet har visat blandade resultat utan att vara konklusiva, vilket sannolikt beror på att patientgrupperna varit dåligt definierade och alltför heterogena snarare än att teorierna om behandlingseffekterna skulle vara fel [1]. Det finns således ett behov av att bättre definiera och karaktärisera sepsispatienter, så kallad fenotypning, i enlighet med den trend inom medicinen som kallas precisionsmedicin, det vill säga idén att skräddarsy eller individualisera behandlingen. Här har man kommit längre inom exempelvis onkologi och kardiologi.
Biomarkörer. En biomarkör är en mätbar indikator av ett biologiskt tillstånd. De används för att förstå processerna som gör att patienter sviktar i vitala funktioner. Vanliga biomarkörer i humanmedicin är substanser, ofta ett protein, som kan mätas i blod och urin. Biomarkörer kan vara ett verktyg för att möjliggöra tidig diagnos, identifiera högriskgrupper och övervaka sjukdomsförlopp. Inom intensivvården tas en uppsjö av blodprov. Ibland krävs det blodgaser varje timme, då varje prov omfattar ett tiotal olika analyser. Andra prov tas dagligen. Biomarkörer analyseras för att förstå vilket slags fysiologisk rubbning som hotar patienten för tillfället (exempelvis natriumvärdet i blodet), men också för att förutse utfallet av intensivvård (exempelvis neuronspecifikt enolas som hjärnskademarkör vid hjärtstopp). Biomarkörer kan också vägleda behandling, exempelvis C-reaktivt protein eller prokalcitonin för att följa behandlingseffekten av antibiotika. Ett potentiellt framtida användningsområde för biomarkörer är att karaktärisera patienter som kliniska fenotyper för att bättre avgöra om de kommer att svara på någon specifik behandling, t ex vasopressin i stället för noradrenalin. Inom medicinen hade prospektiva analyser av biomarkörer varit att föredra, men tyvärr är de svåra att genomföra i stor skala och med många biomarkörer, då det i regel inte finns patientnära maskiner för analys och då kostnaderna är höga. Det är därför enklare och mer kostnadseffektivt att samla in och lagra blod och annat biologiskt material i en provsamling för senare analys.
Biobank. En biobank innehåller provsamlingar bestående av prov tagna inom hälso- och sjukvården som kan härledas till en viss person. Att samla blod i en biobank är vanligt, men de största volymerna utgörs av vävnader från patologi och cytologi. Prov kan användas för kliniskt bruk och forskning, men även för utvecklings- och kvalitetsarbete. Totalt finns cirka 450 biobanker i Sverige som är registrerade hos Inspektionen för vård och omsorg (Ivo). Biobank Sverige utgör en viktig nationell infrastruktur och kan ses som en brobyggare mellan sjukvård och forskning (www.biobanksverige.se). Biobankslagen (SFS 2002:297), som trädde i kraft 2003, styr regelverket och all hantering av biobanksprov. En ny biobankslag trädde i kraft den 1 juli 2023 (SFS 2023:38) och har samma syfte som den föregående, men innebär vissa förändringar avseende tillämpningar och undantag. Det främsta syftet med biobanker är att främja vård och behandling. Ett annat viktigt syfte är att kunna forska på sparad vävnad. Sådan forskning kräver alltid samtycke från studiedeltagaren och etikgodkännande. Biobanker har ibland beskrivits som en sorts tidsmaskin, eftersom de möjliggör att gå tillbaka i tiden för att hitta svar på medicinska frågeställningar med hjälp av ny kunskap och modern teknologi.
Provsamlingen Swecrit
I Swecrits provsamling (id-nummer SC-1922) har blod från intensivvårdade patienter samlats in för att senare användas i forskningssyfte. Ett EU-bidrag (Europeiskt territoriellt samarbete, Interreg IV A) erhölls 2012 med danska forskarkollegor och utgjorde initial finansiering. Även Biobanking and Biomolecular Resources Research Infrastructure (BBMRI) och Region Skåne har givit stöd. En projektplan togs fram och etikgodkännande gavs parallellt med att infrastrukturen byggdes. Insamling av seriella prov från hjärtstoppspatienter som vårdades på Iva vid 3 sjukhus i Region Skåne påbörjades under 2014. Modellen krävde att anhöriga informerades under vårdtiden och att överlevande studiedeltagare senare gav sitt samtycke. Vår uppföljningsmodell innebar ett återbesök hos sjuksköterskor på Iva efter 2 till 3 månader då samtycke kunde inhämtas om det missats under vårdtiden. För avlidna gällde så kallat förmodat samtycke. Samma modell för information och skriftligt samtycke användes senare i samband med coronapandemin.
För att kunna utöka Swecrit-studien till att innefatta samtliga patienter som vårdas på Iva krävdes ett nytt etikgodkännande. Samtycke skulle vara svårt att inhämta under vårdtiden på Iva, eftersom patienter läggs in och skrivs ut dygnet runt, ofta med korta vårdtider. För den stora allmänna Swecrit-kohorten godkände den dåvarande Etikprövningsnämnden (nu Etikprövningsmyndigheten) ett så kallat »opt out«-förfarande. Detta innebar att patienter som överlevt 3 månader efter vård på Iva fick ett brev hem med information om studien och möjlighet att dra tillbaka sitt samtycke. För avlidna gällde fortsatt förmodat samtycke. Denna modell har varit en förutsättning för att kunna skapa en stor provsamling inom intensivvården, givet svårigheterna att inhämta informerat samtycke hos kritiskt sjuka patienter, som ofta är medvetslösa eller sövda.
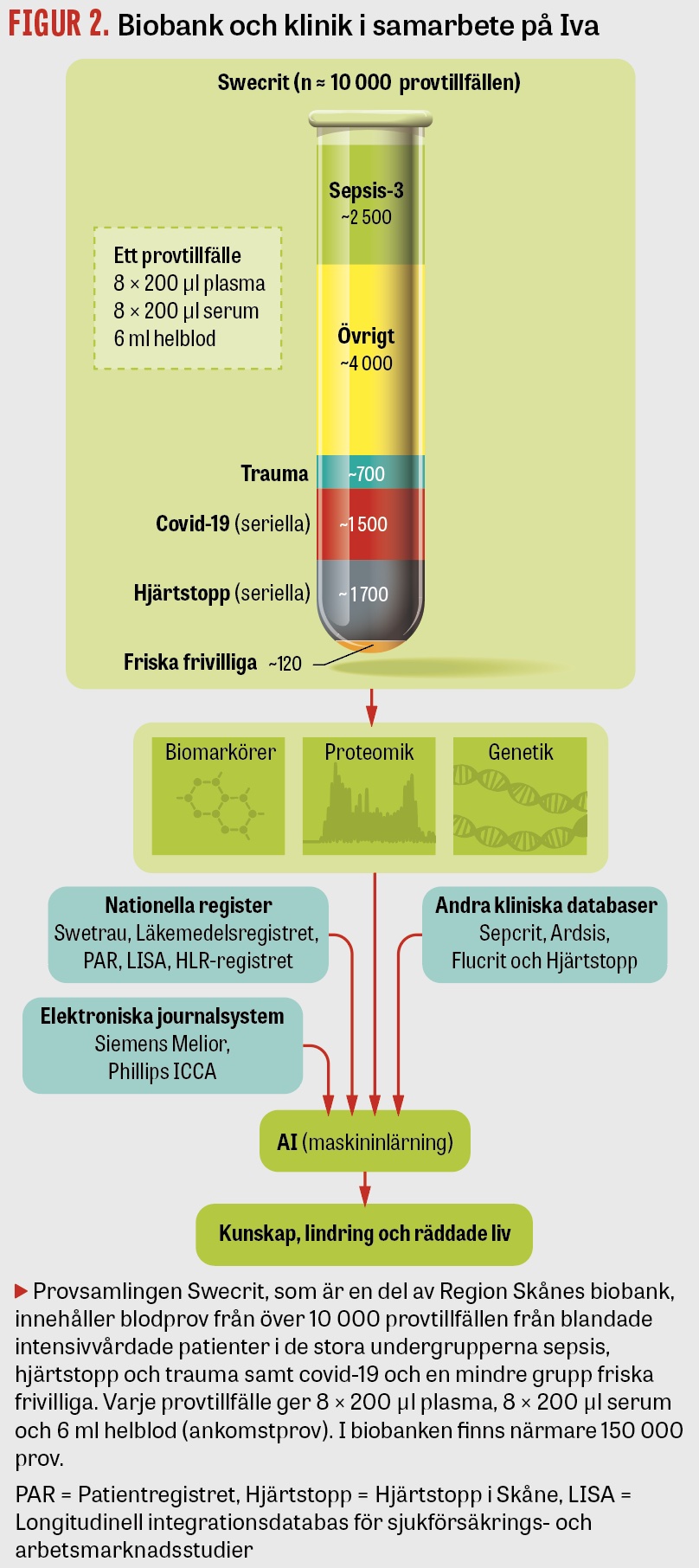
Provsamlingen Swecrit består för närvarande av 6 kohorter av Iva-patienter som samtliga har lämnat ankomstprov och i vissa fall seriella prov. Skånes universitetssjukhus i Lund och Malmö, Helsingborgs lasarett och Centralsjukhuset Kristianstad deltar i provinsamlingen. Utöver finansiering krävdes nya rutiner på Iva samt avtal med medverkande kliniker, Klinisk kemi i Region Skåne och Region Skånes biobank, som har registreringsnummer 136 hos Ivo. Avdelningen som förvarar prov benämns BD-47. Under 2015 påbörjades insamlingen av blodprov från samtliga patienter vid ankomst till Iva. Totalt insamlades prov från ca 10 000 vårdtillfällen. Som fallrapportsformulär använde vi prospektivt insamlade data från mjukvaran Pasiva (Otimo Data AB), som används för att skicka data till SIR. När coronapandemin drabbade samhället våren 2020 användes erfarenheterna från Swecrit för att relativt snabbt starta insamlingen av seriella blodprov från kritiskt sjuka intensivvårdade patienter med covid-19 (Figur 1). Samverkansprojektet Forum söder, en del av Kliniska studier Sverige, bidrog samtidigt med att skapa en tillhörande kvalitetsdatabas (Covid-IR).
Provmaterial. I samtliga Swecrit-kohorter har ankomstprov samlats in. Dessa består av 8 serumprov, 8 plasmaprov och 1 rör med helblod. I hjärtstoppskohorten har dessutom seriella prov samlats in 12 och 48 timmar efter ankomst till Iva. Från covid-19-kohorten har seriella prov samlats in 48 timmar samt 7 dygn efter ankomst utöver ankomstprov. Uppföljande prov (plasma och serum) har samlats in från covid-19kohorten 3 månader och 1 år efter ankomst till Iva.
Kliniskt relevanta diagnosgrupper. Det pågår ett arbete med att identifiera kliniska undergrupper på Iva med vanligt förekommande diagnoser för att kunna undersöka olika biomarkörers diagnostiska och prognostiska värde. En kohort bestående av 120 friska frivilliga ingår som kontrollgrupp. Eftersom ankomstprov finns från hela intensivvårdspopulationen kan jämförelser även göras mellan specifika undergrupper, med övriga intensivvårdspatienter som kontrollgrupp. För de olika diagnosgrupperna har bakgrundsdata samlats in retrospektivt, exempelvis kliniska data och data om samsjuklighet från journaler samt data från kliniska informationssystem (klinisk kemi, bilddiagnostik och mikrobiologi). Registerdata hämtas från Pasiva (varifrån data, inklusive överlevnadsdata, skickas till SIR), Hjärt‒lungräddningsregistret, Svenska traumaregistret (Swetrau) och från andra nationella kvalitetsregister (Läkemedelsregistret, Folkbokföringsregistret, Longitudinell integrationsdatabas för sjukförsäkrings- och arbetsmarknadsstudier med flera).
Swecrit–Sepcrit. Sepsis är en vanlig orsak till intensivvård och utgör den enskilt största diagnosgruppen i Swecrit. Inom ramen för ett omfattande metodarbete har vi strävat efter att identifiera en så specifik sepsispopulation som möjligt [2]. Som utgångspunkt har vi använt Sepsis-3-kriterierna från 2016, med blododling och antibiotikabehandling som proxykriterier för misstänkt infektion [3]. Med dessa proxykriterier finns en uppenbar risk för falskt positiva sepsisfall (så kallade sepsishärmare), eftersom tröskeln är låg för att behandla Iva-patienter med antibiotika. Vi har med hjälp av nypublicerade infektionskriterier identifierat sepsishärmare för att kunna utesluta dem ur populationen [4]. I en preliminär analys var hela 23 procent av sepsispopulationen härmare [5]. Med nya biomarkörer finns en förhoppning att bättre kunna identifiera och differentiera den heterogena sepsispopulationen i kliniska fenotyper.
Swecrit–Ardsis. ARDS förekommer relativt ofta på Iva, men långt ifrån alla erhåller korrekt diagnos av behandlande kliniker [6], vilket gör dokumentationen i Pasiva/SIR bristfällig. Inom ramen för ett doktorandprojekt har vi retrospektivt granskat journaler samt röntgen- och DT-bilder på patienter som vårdats på Iva i Lund och Malmö. Vi fann att cirka 10 procent av patienterna uppfyllde ARDS-kriterierna och att bio-adrenomedullin är en lovande biomarkör för att predicera ARDS [7].
Swecrit–Hjärtstopp. Hjärtstoppspatienter utgör cirka 10 procent av patienterna på Iva, men eftersom vårdtiden ofta är längre än för genomsnittspatienten är andelen vårddagar större. Analyser av hjärnskademarkörer i blod från medvetslösa hjärtstoppspatienter är ett högaktuellt forskningsområde. För närvarande rekommenderas neuronspecifikt enolas som komplement till klinisk neurologisk undersökning, neurofysiologi och neuroradiologi. Nya kandidater med högre precision för hjärnskada, främst »neurofilament light« (NFL), kommer sannolikt att ersätta neuronspecifikt enolas, som är användbart som prognostiskt verktyg först 48 timmar efter hjärtstoppet. Vi har i ett arbete sprunget ur Swecrit funnit att NFL har en utmärkt prediktiv förmåga redan efter 12 timmar [8].
Swecrit–Covid-IR. Under året då covid-19-studien pågick (maj 2020 till maj 2021) inkluderades 498 kritiskt covidsjuka patienter i provsamlingen Swecrit och registret Covid-IR, som inkluderar detaljerad långtidsuppföljning [9]. Mortaliteten var hög under perioden och högst under perioder med hög beläggningsgrad på Iva. Höga interleukin-6-värden och låga trombocyttal vid ankomst var associerade med högre mortalitet. Biomarkörer i blod från covid-19-patienter kan identifiera högriskpatienter och underlätta allokering till rätt vårdnivå. Biomarkörer kan också användas i forskning om långtidscovid.
Swecrit–Swetrau. Andelen patienter med svårt trauma som observeras och vårdas på Iva utgör cirka 10 procent av samtliga Iva-patienter. Patienterna registreras i det nationella kvalitetsregistret Swetrau, som kompletterar Pasiva/SIR med ett 30-tal traumarelaterade variabler och en förteckning över patienternas skador. Det finns flera biomarkörer för stress och cellskada, men en specifik biomarkör för kärlskada, ockult blödning eller hypoperfusion saknas. Vi bedömer att cirkulerande dipeptidylpeptidas-3 (DPP-3) och plasma-proenkefalin A119-159 (penkid) kommer att få en prognostisk betydelse vid trauma.
Figur 2 visar en skiss på hur provsamlingen Swecrit med tillhörande kliniska databaser och nationella register kan skapa mervärde i vården.
Genomförda studier
Nedan presenteras egna och andras genomförda studier som inspiration för hur provsamlingen Swecrit och de kliniska databaserna kan användas i forskning.
Sphingotech. I ett samarbete med företaget Sphingotech (Berlin, Tyskland) har vi genomfört analyser av 3 biomarkörer: bio-adrenomedullin, DPP-3 och penkid. Dessa biomarkörer har alla prognostisk potential inom intensivvården [7, 10-13].
Klinisk kemi och farmakologi, Akademiska sjukhuset. I ett samarbete med Akademiska sjukhuset i Uppsala har följande biomarkörer analyserats på covid-19-kohorten (över 1 500 prov) och på de patienter som vårdats längre än 1 dygn (över 4 500 prov): intercellulär adhesionsmolekyl, vaskulär cellulär adhesionsmolekyl, kalprotektin, endostatin, NGAL (neutrophil gelatinase-associated lipocalin) och cystatin C. Analyser av dessa pågår och kommer att publiceras inom en snar framtid.
Neurokemi i Mölndal. I samarbete med neurokemiska laboratoriet vid Sahlgrenska universitetssjukhuset i Mölndal har vi förutom den tidigare omnämnda studien avseende NFL vid hjärtstopp [8] även undersökt NFL vid kritisk covid-19 [14]. Vi fann att NFL var en oberoende prognostisk markör för långtidsöverlevnad efter kritisk covid-19.
Krympt por-syndromet. Kvoten mellan cystatin C och kreatinin har analyserats i Sepcrit-kohorten som ett led i undersökningar av det så kallade krympt por-syndromet (shrunken pore syndrome), som tidigare har studerats som en prognostisk faktor i en intensivvårdpopulation [15].
Svår preeklampsi. Swecrit har även bidragit med plasmaprov från 41 kvinnor vårdade på Iva med svår preeklampsi, och man jämförde kliniska riskfaktorer och nivåer av utvalda »scavenger-proteiner« med prov från kvinnor med lindrig preeklampsi och kvinnor med normal graviditet [16].
Kommande projekt
Influensa. Antalet laboratorieverifierade influensafall som vårdas på Iva varierar. Under säsongen 2017–18, när influensa B grasserade, vårdades fler än 50 patienter med verifierad influensa på Iva i Region Skåne, av vilka 36 procent avled inom 3 månader. Biomarkörer behövs för att bättre kunna prognostisera och vägleda behandling av svår influensasjukdom. Våra studier kommer förhoppningsvis att bidra med viktig kunskap inom detta område.
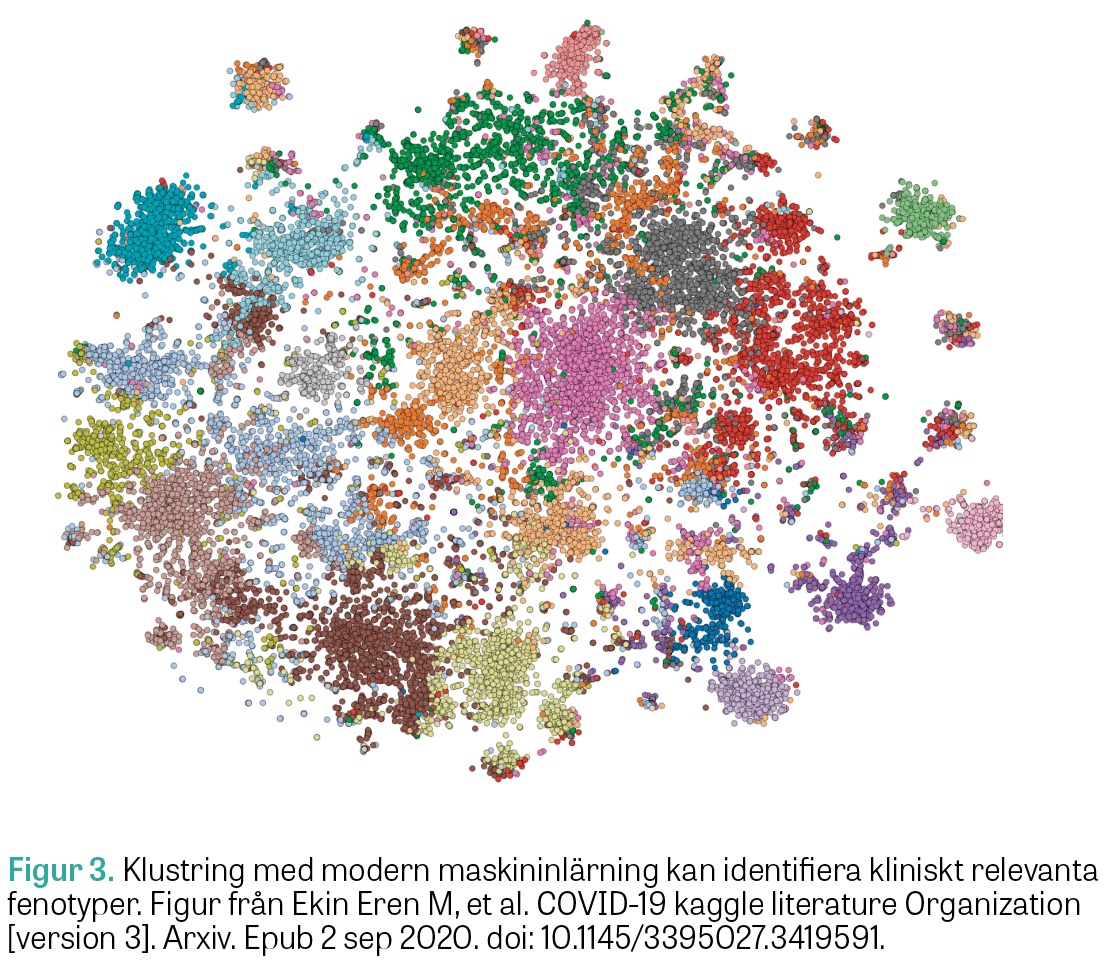
Proteomik. Masspektrometriska metoder kan användas för att analysera de relativa uttrycken av cirka 750 proteiner i endast någon mikroliter plasma och på detta sätt erhålla ett »fingeravtryck« för varje patient. Dessa analyser genererar stora mängder data, och maskininlärning (artificiell intelligens) har en viktig roll i analysen. Dessa detaljerade analyser kan förhoppningsvis hjälpa oss att dela in de heterogena intensivvårdssyndromen sepsis, ARDS, hjärtstopp och covid-19 med flera i kliniskt relevanta undergrupper, så kallad fenotypning (Figur 3). I vår forskargrupp ingår matematiker från Matematikcentrum i Lund som är experter på modern maskininlärning [17, 18]. Vår grupp har inlett ett samarbete med det nationella nätverket för biologisk masspektrometri Bioms, med noder i Lund, Göteborg och Stockholm (Figur 4).
Proteomikanalyser utförs traditionellt med masspektrometri, men Olink och Somalogic, som vi har initierat samarbete med, erbjuder alternativa metoder. Olinks teknologi »proximity extension assay« med antikroppar kan kvantifiera 5 000 proteiner med hög reproducerbarhet. Somalogic använder modifierade DNA-molekyler och kan kvantifiera 7 000 proteiner. Båda teknikerna detekterar låg- till höguttryckta proteiner i små provmängder och kompletterar masspektrometri. De ger forskare möjligheter att utforska proteomvariationer och biologiska processer på molekylär nivå.
Genetik. Riktad sekvensering av kandidatgener har använts för att identifiera enbaspolymorfier associerade med gynnsamt eller ogynnsamt utfall vid både sepsis och ARDS. Genomtäckande associationsstudier av sepsis och ARDS har också gjorts, och man har kunnat identifiera farmakogener som möjliggör riktad medicinsk behandling vid sepsis, exempelvis noradrenalin, vasopressin och kortikosteroider [19].
Vi avser att i ett första steg extrahera DNA för att sedan genomföra genomtäckande associationsstudier eller, om kostnaderna tillåter, helgenomsekvensering.
Inbjudan till samarbeten
Med den stora provsamling som Swecrit utgör i intensivvårdssammanhang i kombination med väldefinierade och välkaraktäriserade diagnosgrupper finns en unik möjlighet för intresserade forskargrupper att besvara frågeställningar som rör biomarkörer hos intensivvårdspatienter, men också utveckla bioinformatiken kring dessa analyser. Intresserade forskare inbjuds till samarbete.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.