Läkemedelsverkets ansvar är att ta emot anmälningar om restsituationer från läkemedelsföretag, sprida information om restsituationer och samverka med berörda aktörer gällande potentiellt kritiska bristsituationer.
Läkemedelsverket ansvarar inte för att tillverka, inhandla eller lagerhålla läkemedel.
Läkemedelsföretagen har skyldighet att anmäla restsituationer till Läkemedelsverket, ansvarar för att ansöka om nya godkännanden och beslutar själva huruvida deras godkända läkemedel ska finnas till försäljning.
En restsituation uppstår när ett läkemedelsföretag inte kan leverera sitt läkemedel i tillräcklig volym så att tillgång möter efterfrågan på nationell nivå. Läkemedelsföretagen är enligt läkemedelslagen skyldiga att anmäla restsituationer till Läkemedelsverket. Läkemedelsverkets ansvar är bland annat att utreda, sammanställa och tillgängliggöra information om inkomna restanmälningar. Nedan beskrivs befintliga möjliga åtgärder för att minska effekterna av en restsituation samt ges förslag till nya mandat för att minska risken för framtida läkemedelsbrist.
Restsituation och läkemedelsbrist
En restsituation uppstår när läkemedelsföretaget som innehar marknadsföringstillståndet för sin produkt i Sverige inte kan leverera läkemedlet i den volym som behövs. Läkemedelsbrist är det som allmänheten, patienterna och förskrivarna upplever när produkten inte längre finns tillgänglig till försäljning och inte heller går att beställa på grund av en restsituation. En bristsituation kan ha olika påverkansgrad [1].
Det kan finnas flera olika anledningar till att ett läkemedelsföretag tillfälligt inte kan tillhandahålla ett läkemedel. De vanligaste är tillverkningsrelaterade problem, som minskad produktionskapacitet och kvalitetsavvikelser, samt oväntat hög efterfrågan på läkemedlet. Läkemedelsförsörjningskedjan är global och komplex, och varje led i kedjan är effektiviserat. Produkter produceras och levereras i precis den mängd och vid den tidpunkt som de behövs. Detta system med »just-in-time«-leveranser leder ofta till korta ställtider och minskad lagerhållning, med ökad sårbarhet för påverkan i hela försörjningskedjan som följd. Ekonomiska faktorer, såsom inflation och låg kronkurs, samt andra yttre faktorer såsom pandemier, kris och krig har tillkommit de senaste åren. Dessa faktorer har påverkat den redan sårbara försörjningskedjan på ett negativt sätt.
Ett läkemedelsföretag kan också bestämma sig för att sluta sälja sin produkt eller avregistrera den.
Läkemedelsverkets ansvar
Läkemedelsverkets ansvar vid restsituationer styrs av förordning (2020:57) med instruktion för Läkemedelsverket, paragraf 17, där det framgår att Läkemedelsverket fortlöpande ska svara för att sprida information om försäljningsuppehåll för läkemedel [2]. Enligt instruktionen ska Läkemedelsverket även samverka med berörda aktörer gällande bristsituationer.
När Läkemedelsverket har tagit emot en restanmälan från ett läkemedelsföretag publiceras informationen, tillsammans med råd om eventuella alternativ, i en söktjänst på Läkemedelsverkets webbplats. Informationen om restsituationer uppdateras dagligen. Söktjänsten används av olika aktörer inom hälso- och sjukvården, till exempel förskrivare, läkemedelskommittéer och apotek, samt av allmänheten [3]. Det vanligaste är att en viss förpackningsstorlek eller styrka är restanmäld, och då finns oftast samma produkt av annan tillverkare eller i annan mängd eller styrka att tillgå, vilket innebär att en anmäld restsituation inte behöver leda till en bristsituation.
Signaler från allmänheten, patienter och förskrivare om läkemedelsbrist analyseras och utreds på samma sätt som anmälningar från företagen.
Läkemedelsverket ansvarar varken för tillverkning, inköp eller lagerhållning av läkemedel. Myndigheten är inte heller involverad i ett läkemedelsföretags beslut att ansöka om godkännande eller om utökad indikation för ett läkemedel [4]. Det är företagen själva som beslutar om ett läkemedel ska säljas i Sverige efter att det har blivit godkänt.
Läkemedelsföretagens skyldighet
Enligt läkemedelslagen ska läkemedelsföretagen göra en restanmälan så snart som möjligt, dock senast 2 månader före förväntad restsituation, det vill säga då en läkemedelsförpackning inte kan beställas av ett apotek. Företagen ska i anmälan lämna information om när restsituationen förväntas uppstå, hur länge den förväntas pågå samt orsak till restsituationen. Anmälningsskyldigheten ser olika ut beroende på genom vilken procedur läkemedlen har godkänts [4, 5]:
- Anmälningsskyldigheten gäller alla läkemedel för människa som är nationellt godkända i Sverige.
- Restsituationer för läkemedel centralt godkända i EU ska anmälas till den europeiska läkemedelsmyndigheten, EMA. Läkemedelsverket önskar dock att restsituationer för dessa läkemedel anmäls även i Sverige.
- Läkemedel kan säljas via parallellimport (nationellt godkända läkemedel) och parallelldistribution (centralt godkända läkemedel). Företagen som bedriver parallellimport och parallelldistribution räknas i strikt mening inte som innehavare av försäljningstillstånd och omfattas därför inte av anmälningsskyldigheten. Det finns dock en frivillig överenskommelse mellan dessa företag och Läkemedelsverket om att i vissa situationer anmäla restsituationer för parallellhandlade läkemedel.
I Läkemedelsverkets söktjänst »Läkemedelsfakta« finns information om enligt vilken procedur ett läkemedel är godkänt samt om det är parallellimporterat eller parallelldistribuerat [5].
Sanktionsavgifter
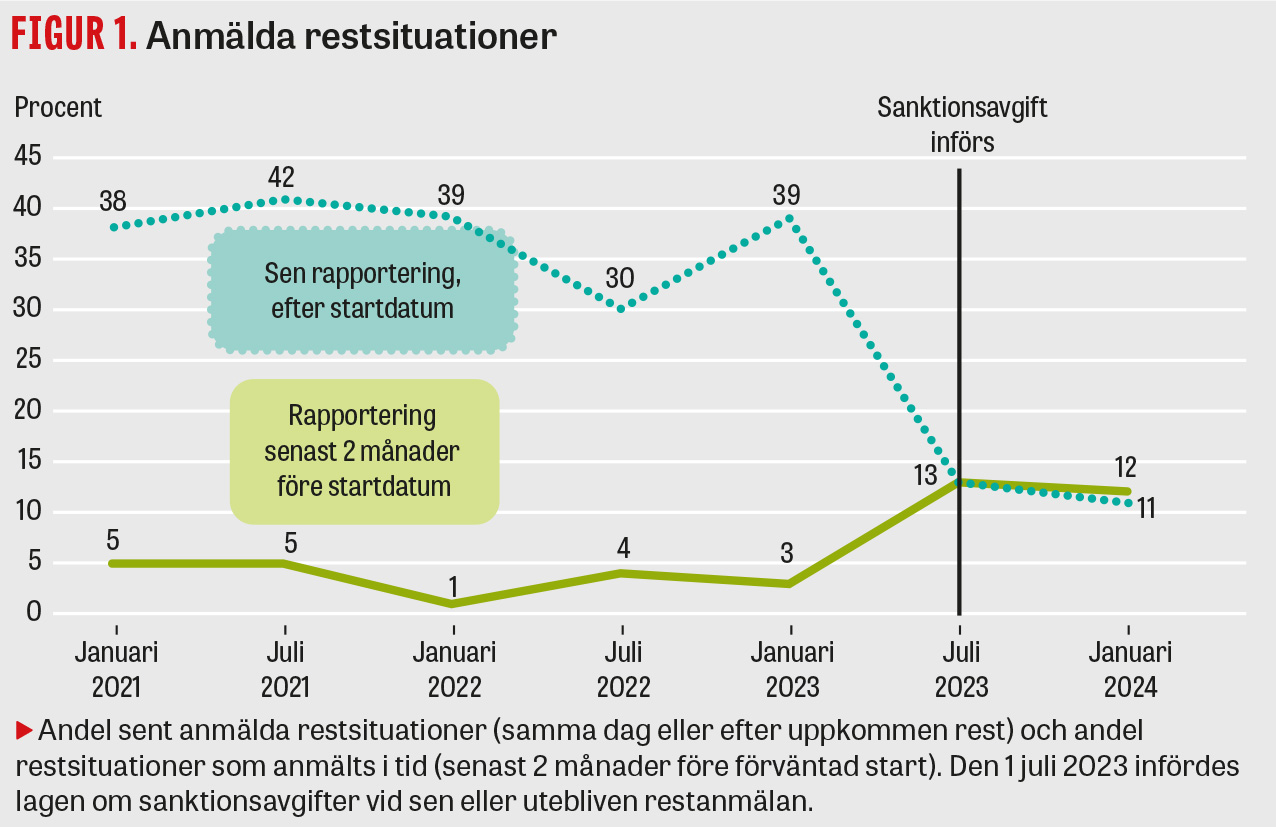
Efterlevnaden av skyldigheten att anmäla restsituationer till Läkemedelsverket i tid är låg. Orsakerna till detta har inte analyserats i detalj. De kommentarer Läkemedelsverket har fått från företagen är bland annat att de anser att det är svårt att ha en framförhållning på 2 månader och att det är olika regelverk i olika länder för hur och vilka restsituationer som ska anmälas.
Den 1 juli 2023 infördes lagen om sanktionsavgifter, vilket innebär att Läkemedelsverket har möjlighet att utfärda sanktionsavgifter till läkemedelsföretag vid sen eller utebliven restanmälan. Efter denna lagändring har företagen börjat anmäla restsituationer med något bättre framförhållning. För några år sedan rapporterades fler än hälften först efter att restsituationen uppstått, jämfört med i dag då endast 10 procent av restanmälningarna inkommer samma dag eller efter restsituationens början. Det finns även ett mörkertal av restsituationer som aldrig anmäls, och endast cirka 10 procent inkommer lagenligt senast 2 månader före förväntad restsituation (Figur 1) [6].
»Sök restanmälda läkemedel«
I söktjänsten »Sök restanmälda läkemedel« publicerar Läkemedelsverket efter utredning en sammanställning av anmälningar av restsituationer från läkemedelsföretagen tillsammans med information om eventuella behandlingsalternativ [3]. Företagen ska i sin anmälan löpande ange prognoser för start- och slutdatum för restsituationen. De måste även ange orsak till restsituationen, men den publiceras endast om företaget gett sitt medgivande. I utredningen ingår att utreda vilka tänkbara regulatoriska åtgärder som kan vidtas för att försöka minska konsekvenserna av en restsituation och att publicera information om dessa åtgärder. Söktjänsten uppdateras varje dygn.
Det är företagen som kan svara på ytterligare frågor som rör en specifik restsituation utöver det som står i söktjänsten.
Läkemedelsverkets information om anmälda restsituationer publiceras även i strukturerat format (öppna data) och vidareanvänds av andra aktörer, till exempel av Lif för publicering på Fass.se och av Inera för publicering i Svensk informationsdatabas för läkemedel (Sil). Därmed kan informationen göras tillgänglig i vårdgivarnas egna system.
Åtgärder som Läkemedelsverket kan vidta
Läkemedelsverket ska underlätta samordning mellan aktörer inom hälso- och sjukvården och försörjningskedjan samt förbereda ett system för att ta fram en nationell lägesbild av tillgången till läkemedel [2]. Läkemedelsverket ser tillsammans med andra aktörer kontinuerligt över möjligheten att på regulatorisk väg eller via andra särskilda åtgärder säkerställa tillgången till berörda läkemedel vid hotande eller faktisk rest- och bristsituation.
Utbytbara läkemedel
Läkemedelsverket beslutar vilka läkemedel som är likvärdiga och medicinskt utbytbara med varandra [7]. Tandvårds- och läkemedelsförmånsverket (TLV) beslutar vilka förpackningar av de medicinskt utbytbara läkemedlen som även är jämförbara storleksmässigt, vilket avgör vad apoteken direkt kan byta till. När det finns utbytbara läkemedel och förpackningar har restsituationer oftast ingen eller låg inverkan på vård och patienter.
Dispens för märkning och bipacksedel
Ett läkemedelsföretag kan ansöka om ett tillfälligt tillstånd, dispens, att sälja en läkemedelsförpackning som inte möter kraven i Läkemedelsverkets föreskrifter om märkning och bipacksedlar, till exempel för utländska förpackningar. Information om Läkemedelsverkets dispensbeslut publiceras i »Sök restanmälda läkemedel« och i »Sök läkemedelsfakta«. När väl dispensförpackningar finns tillgängliga behöver förskrivare inte utfärda nya recept, utan apoteken kan direkt byta till dispensläkemedlet [8].
Licens
Licensförskrivning är ett försäljningstillstånd till apotek för ett läkemedel som inte är godkänt i Sverige. Förskrivaren påbörjar en licensansökan genom att motivera behovet av licens. Licensansökan görs sedan av ett apotek till Läkemedelsverket, som beviljar licens [9].
Utlämnandebegränsning och ransonering
Läkemedelsverket kan genom en tillfällig föreskrift reglera vilka recept apoteken får expediera till patienten, baserat på vilken specialitet förskrivaren har. Det är en ovanlig åtgärd, som senast användes i början av covid-19-pandemin för att säkerställa tillgången till klorokin och klorokinfosfat till reumatiker [10].
Gränsen för vad patienten maximalt får hämta ut inom högkostnadsskyddet är den mängd läkemedel som beräknas behövas för 90 dagar. Patienten kan dock välja att hämta ut alla uttag samtidigt under receptets giltighetstid (max 1 år), men betalar då fullt pris.
Läkemedelsverket kan hos regeringen begära ett beslut om en temporär förordning som reglerar hur stor förbrukning som kan expedieras till en patient. På grund av hotande hamstring under början av pandemin trädde den 1 april 2020 en sådan temporär förordning i kraft (SFS 2020:164, förordning om ändring i förordningen [2009:659] om handel med läkemedel). Läkemedel för maximalt 3 månaders förbrukning kunde därmed hämtas ut i taget [11].
Vid krig, eller om det vid krigsfara eller utomordentlig händelse föreligger knapphet eller betydande fara för knapphet av till exempel läkemedel, kan regeringen besluta om ransonering enligt ransoneringslagen (1978:268) [12].
Vädjan
I speciella fall, när regulatoriska åtgärder inte bedömts vara aktuella, har Läkemedelsverket vädjat till förskrivare att endast förskriva läkemedel på vissa specifika indikationer [13, 14].
Behov av nationell försörjningsberedskap
Sverige behöver få till en stabil nationell försörjningsberedskap för läkemedel. Läkemedelsverket ser ett flertal utvecklingsområden framöver som skulle kunna minska risken för att rest- och bristsituationer uppstår och begränsa effekterna av dem som trots allt uppkommer. Ett viktigt område redan i dag är att öka den obligatoriska lagerhållningen på alla nivåer från produktion till patient. Det uppdrag Läkemedelsverket har tillsammans med E-hälsomyndigheten, att förbereda ett system för att ta fram en nationell lägesbild av tillgången till läkemedel, kommer bland annat att ge en bättre överblick över lagerstatus på alla nivåer i försörjningskedjan [15]. Ökad lagerhållning skapar en buffert mot kortvariga restsituationer. I händelse av kris eller krig med risk för omfattande och långvariga restsituationer krävs även andra åtgärder. Läkemedelsverket driver frågan att det måste finnas en upparbetad statlig styrning för en smidig produktionsomställning nationellt eller i närområdet, där privata aktörer och även statligt ägda Apotek Produktion & Laboratorier (APL) vid behov ska kunna beredskapstillverka för att täcka en bristsituation. EU har i enlighet med detta initierat ett arbete som bland annat kan utmynna i förstärkt tillverkningskapacitet inom unionen samt i en mer stabil försörjning av aktiv substans (active pharmaceutical ingredient, API). Läkemedelsverket deltar aktivt i detta arbete tillsammans med andra EU-länder. En del av detta arbete innebär att aktivt motverka att bristsituationer uppstår för de drygt 200 substanser som ingår i den kritiska listan över läkemedel som nyligen upprättats [16]. I ett pågående regeringsuppdrag föreslår Läkemedelsverket en lagändring som ska möjliggöra att även försäljningsuppehåll för centralt godkända humanläkemedel ska anmälas till Läkemedelsverket. I förlängningen skulle det då även bli möjligt att utfärda sanktionsavgift.
Pandemin visade på ett behov av att en statlig myndighet får ansvar för omfördelning av läkemedel i kris eller krig. Utöver det behövs en systematisk kunskapsstyrning av läkemedelsanvändningen i kris och krig med fokus på prioritering. Vid läkemedelsbrist måste hälso- och sjukvården prioritera vilka patientgrupper som ska ges företräde till läkemedelsbehandling. Här behöver flera aktörer få ett gemensamt uppdrag att ta fram riktlinjer för prioritering av läkemedelsbehandling vid kris eller krig.
Vi på Läkemedelsverket är väl medvetna om att läkemedelsbrist medför oro hos allmänheten och patienter samt frustration och merarbete för apotek och hälso- och sjukvården. Läkemedelsverket ser redan i dag, inom vårt befintliga uppdrag, möjligheter att göra ännu mer för att motverka läkemedelsbrister, till exempel att inrätta ett snabbspår för licenser vid hotande brist och att påskynda arbetet med elektronisk produktinformation för att underlätta dispenser. För att Sverige ska få en stabil nationell försörjningsberedskap för läkemedel krävs dock även mer långtgående åtgärder som nämnts ovan, till exempel ökad obligatorisk lagerhållning i alla led i försörjningskedjan, snabbspår för licenser samt upparbetade rutiner och ansvarsfördelning för statlig produktion och produktionsomställning i händelse av kris eller krig.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1. Om Läkemedelsverket
- Godkänner läkemedel.
- Bedriver tillsyn av läkemedel, från produktion till apotek och läkemedelsförråd.
- Bedriver säkerhetsövervakning av läkemedel, inklusive biverkningsrapportering.
- Ger producentobunden läkemedelsinformation.
- Läkemedelsupplysningen och Giftinformationscentralen är en del av myndigheten.
- Ligger i Uppsala och Solna och har cirka 980 medarbetare.
- Kontakt: registrator@lakemedelsverket.se, 018-174600 (växel), www.lakemedelsverket.se