Familjär hyperkolesterolemi (FH) är en hereditär blodfettsrubbning som leder till högt LDL-kolesterol och kraftigt ökad risk att drabbas av tidig kardiovaskulär sjukdom. Tidig primärpreventiv behandling av sjukdomen minskar risken.
Familjär hyperkolesterolemi har prevalensen 1:311, vilket motsvarar ca 33 000 individer i Sverige. Trots att Socialstyrelsen redan 2015 rekommenderade att prioritera screening av familjär hyperkolesterolemi så har mindre än 5 procent av dem med förväntad sjukdom i Sverige diagnostiserats.
En digifysisk vårdkedja för kaskadscreening av familjär hyperkolesterolemi innebär vård i både fysiska och digitala kanaler, vilket har potential att öka patientens delaktighet och effektiviteten i arbetet.
Familjär hyperkolesterolemi (FH) är den kliniskt viktigaste hereditära dyslipidemin. Patienter med familjär hyperkolesterolemi har en ökad nivå av LDL-kolesterol i blodet redan från unga år, drabbas ofta av ateroskleros tidigt i livet och har en hög risk för hjärtinfarkt, stroke och perifer kärlsjukdom [1]. En norsk studie visade att medelåldern vid första kardiovaskulära händelsen bland patienter med familjär hyperkolesterolemi var 44 år, och 93 procent hade etablerad kardiovaskulär sjukdom när de dog [2]. Trots dessa dystra siffror kan naturalförloppet förhindras. En långtidsuppföljning under 20 år demonstrerade nyligen att initiering av statinbehandling hos barn med familjär hyperkolesterolemi i 8–18-årsåldern kunde förhindra både aterosklerosutveckling i halskärlen och kardiovaskulära händelser mycket effektivt redan vid 39 års ålder jämfört med deras föräldrar med familjär hyperkolesterolemi som fått behandling först i vuxen ålder [3]. Det understryker nyttan av att identifiera, diagnostisera och behandla personer med familjär hyperkolesterolemi tidigt i livet. Vikten av detta avspeglas också i behandlingsriktlinjerna från European Atherosclerosis Society/European Society of Cardiology, som rekommenderar aktiv farmakologisk behandling även av barn med familjär hyperkolesterolemi [4]. Svenska nationella rekommendationer för familjär hyperkolesterolemi saknas i dagsläget.
Diagnostiken baseras på förekomst av kardiovaskulär hereditet, egen tidig kardiovaskulär sjukdom, kliniska stigmata (senxantom, presenil korneal arkusring), LDL-kolesterol och genetisk testning. Till stöd för läkarens bedömning finns kliniska skattningsinstrument för att mer objektivt väga samman de olika ingångvärdena, där det från Dutch Lipid Clinic Network är det mest spridda och använda [5]. Familjär hyperkolesterolemi är en autosomalt dominant och monogenetisk sjukdom som orsakas av en mutation i någon av de tre gener (LDLR, APOB, PCSK9) som alla påverkar, direkt eller indirekt, upptaget av LDL-partiklar i levern. Hittills har över 1 500 olika mutationer beskrivits, och genetisk testning är ett viktigt verktyg vid diagnostisering [6]. Penetransen av mutationen är hög, 85–93 procent [7, 8], vilket gör att det vanligtvis går lätt att följa ärftlighetsmönstret med 50 procent affekterade förstagradssläktingar i minst fyra släktled [9]. Höga kolesterolvärden ses oftast redan hos barn, och screening kan rekommenderas från 5 års ålder eftersom nivåerna sjunker tillfälligtvis under puberteten, vilket kan försvåra diagnostiken [10]. Ibland kan dock den kliniska bilden vara grumligare, där patienter uppvisar typiska karakteristika för familjär hyperkolesterolemi utan att en mutation identifieras eller har en mutation utan att LDL-kolesterolet är förhöjt. Några korta men initierade tankar om sjukdomens betydelse och komplexitet finns sammanfattade av två av världens främsta företrädare på området [11].
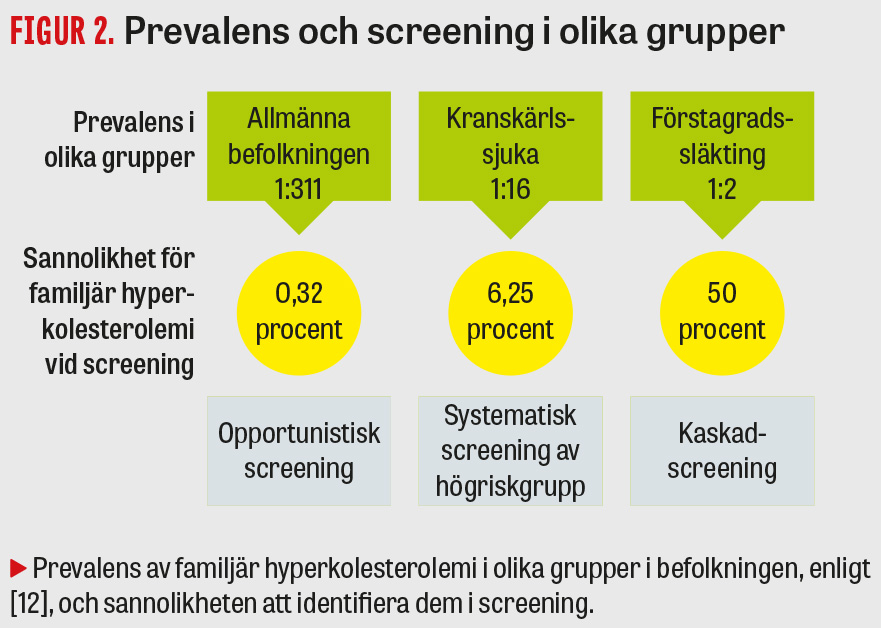
Familjär hyperkolesterolemi är en relativt vanligt förekommande blodfettsrubbning med en prevalens på 1:311–313 i den allmänna befolkningen [12, 13]. Förekomsten av familjär hyperkolesterolemi uppvisar inte några större regionala skillnader, även om vissa platser i världen har en ansamling av familjer med mutationer (så kallad founder-effekt), som Quebec i Kanada [14]. Däremot är prevalensen betydligt högre (1:16), bland patienter med etablerad aterosklerotisk kranskärlssjukdom [12]. Hos personer med tidigt (män ≤ 55 år; kvinnor ≤ 60 år) eller mycket tidigt (≤ 35 år) insjuknande i ischemisk hjärtsjukdom uppskattas prevalensen till 1:23 respektive 1:6 [13].
Screeningen är underutvecklad i Sverige
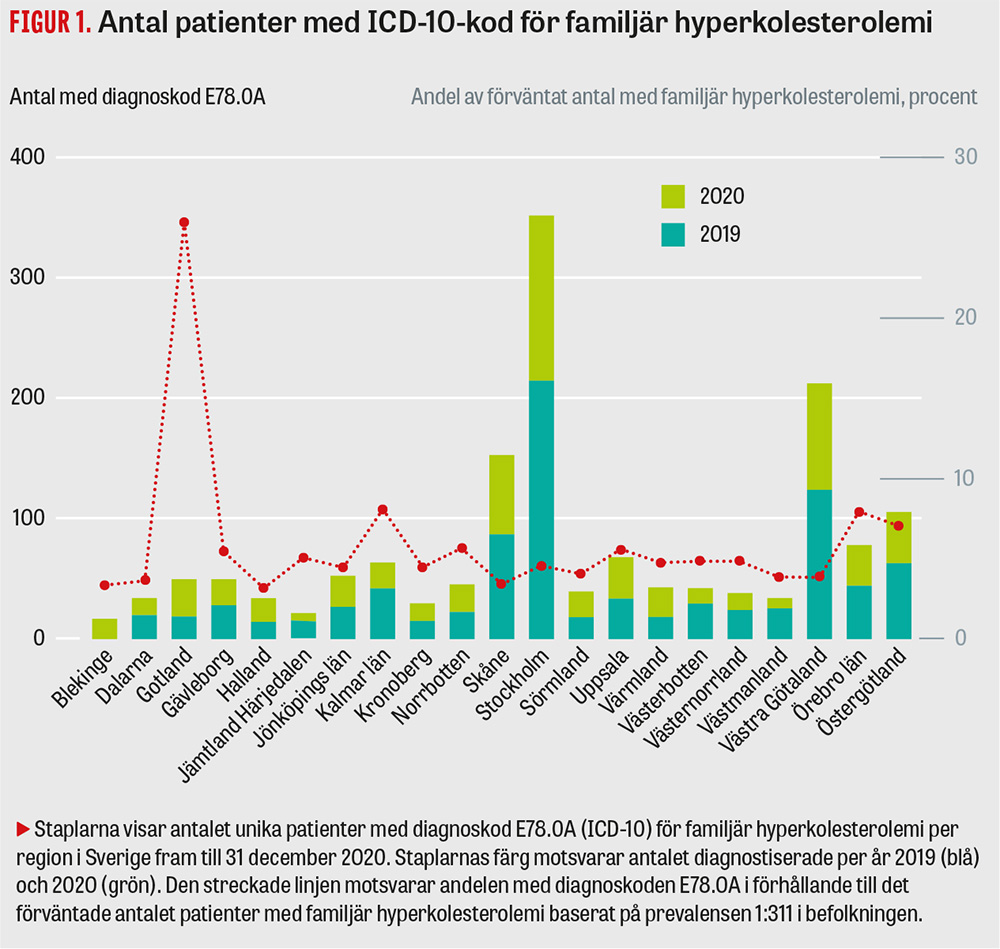
Familjär hyperkolesterolemi lämpar sig utmärkt för screening. Det är en vanligt förekommande och behandlingsbar sjukdom där tillgänglig behandling leder till minskad sjuklighet. Socialstyrelsen rekommenderade redan 2015 att screening av familjär hyperkolesterolemi ska prioriteras [15], och nyligen kom en global petition för att agera kraftfullt i frågan [16]. Cirka 33 000 personer i Sverige förväntas ha familjär hyperkolesterolemi. Det saknas ett fungerade nationellt kvalitetsregister för familjär hyperkolesterolemi, vilket gör att antalet identifierade patienter är svårbedömt. De mest objektiva och tillförlitliga data kommer från Socialstyrelsens patientregister, där antalet personer med den unika ICD-10-diagnoskoden för familjär hyperkolesterolemi (E78.0A), som infördes den 1 januari 2019 [17], hittills endast är 1 572 (till och med 2020). Detta motsvarar knappt 5 procent av det förväntade antalet i Sverige (Figur 1). Baserat på antalet nydiagnostiserade patienter under 2020 (685 personer) beräknas den absoluta ökningstakten till 2 procent per år. Troligen är antalet diagnostiserade med familjär hyperkolesterolemi något högre i verkligheten på grund av eftersläpning i registreringen, men ändå långt ifrån vad som är acceptabelt. Tyvärr syns samma bild också i den pediatriska populationen, vilket vi redovisat i en studie av statinanvändning hos barn i Skandinavien, med Sverige långt efter Norge [18].
Det är en utmaning både i Sverige och globalt att diagnostisera familjär hyperkolesterolemi i befolkningen, och anpassade arbetsmodeller för screening med rimligt satta mål skulle troligen underlätta [19]. Det svenska arbetet med screening för familjär hyperkolesterolemi har hittills präglats av stora regionala skillnader både gällande arbetssätt och intensitet, sannolikt beroende på skillnader i organisation, kunskap och resurser. En region som står ut i positiv bemärkelse är Gotland. Där har under några år bedrivits ett målmedvetet arbete med både biokemisk och genetisk screening, vilket lett till en hög andel (ca 25 procent) diagnostiserade patienter (Figur 1).
Digifysisk kaskadscreening av släktingar
För att möta utmaningen med diagnostisering av familjär hyperkolesterolemi har Karolinska universitetssjukhuset skapat en digifysisk vårdkedja för screening (Fakta 1). Begreppet digifysisk vård har etablerats i samband med publiceringen av den statliga offentliga utredningen om digifysiskt vårdval [20]. Vårdformen innebär att fysiska och digitala kanaler kompletterar varandra utefter vad som bedöms mest lämpligt i den aktuella vårdsituationen, med syfte att skapa ökad tillgänglighet och delaktighet för patienten och förbättrad resurseffektivitet för sjukvården. Den digifysiska vårdkedjan för screening av familjär hyperkolesterolemi som presenteras här bygger på fyra grundläggande insikter:
- Screening blir mer effektiv om den utförs i grupper där sannolikheten är som störst att hitta odiagnostiserade patienter. Sjukdomsprevalens hos förstagradssläktingar till patienter med familjär hyperkolesterolemi är 1:2. Det blir därför den naturliga utgångspunkten för screening, vilket ofta kallas för kaskadscreening (Figur 2).
- Ökad delaktighet hos patienterna gör screeningarbetet mer framgångsrikt och säkert. I vår modell bjuder indexpatienter själva in sina släktingar till screening via sms eller e-post. Det blir en förenklad resa inom vården för släktingarna jämfört med att de erhåller en uppmaning om att söka sin lokala vårdgivare för screening. Arbetssättet löser också de medikolegala frågorna kopplade till integritet och personuppgiftsansvar för släktingarna. Vården har inte rätt att kontakta släktingar till patienter utan deras medgivande. I detta fall kontaktar släktingarna själva, efter inbjudan av indexpatienten, sjukvården för att anmäla sitt deltagande i screening, vilket kan liknas vid en egenremiss.
- Ökad digitalisering förenklar för både patient och vårdgivare. Introduktion av en interaktiv webbplattform för kommunikation mellan patient och vårdgivare (remisser, provsvar, samtycke till screening av vårdnadshavare) ger ett effektivare utnyttjande av sjukvårdens resurser, som då i stället kan fokusera mer på att behandla de patienter som diagnostiseras.
- Effektiviteten blir hög i en obruten screeningkedja, där varje släkt följs tills alla medlemmar antingen är diagnostiserade med eller frikända från familjär hyperkolesterolemi. Den digifysiska modellen möjliggör sammanhållen screening av en hel släkt oavsett var i landet de enskilda individerna bor.
- En opportunistisk screeningmodell [21] för familjär hyperkolesterolemi i den allmänna befolkningen är mindre effektiv på grund av den låga prevalensen av sjukdomen (Figur 2). Screening i den allmänna befolkningen bör därför inte utgöra grunden för screeningstrategin, även om patienter med en hög sannolikhet för familjär hyperkolesterolemi, till exempel grundad på ett högt LDL-kolesterol taget i primärvården, också ska utredas enligt nuvarande rutin.
Den digifysiska vårdkedjan för kaskadscreening som visas i Fakta 1 fokuserar på patienter med genetiskt verifierad familjär hyperkolesterolemi (så kallad indexpatient). Vårdgivaren registrerar indexpatienten, som därefter kan logga in på en webbplattform (med bank-id eller Freja e-id), bygga sitt släktträd och välja vilka släktingar som ska bjudas in till screening. De inbjudna släktingarna får via e-post eller sms en länk för inloggning på webbplattformen. Släktingen har möjlighet att avstå screeningen genom att ignorera inbjudan. Släktingar som svarar ja blir formellt patienter på Karolinska universitetssjukhuset, får besvara ett antal frågor på webbplattformen och får en remiss för att lämna blodprov lokalt där de bor för kontroll av blodfetter. Blodprovssvaren bedöms av läkare på lipidmottagningen, som loggar in på en klinikdel av webbplattformen och meddelar släktingarna via plattformen. I de fall lipidvärderna inte är tillräckligt bedömningsunderlag för att avgöra om släktingen har familjär hyperkolesterolemi kompletteras utredningen med genetisk testning. Alla som genomgår genetisk testning erbjuds ett digitalt läkarbesök med läkare på lipidmottagningen för genetisk rådgivning. Det gör även alla som diagnostiseras med familjär hyperkolesterolemi för att få information om sin diagnos. Därefter remitteras patienterna till lokala vårdgivare för insättning av behandling och uppföljning. Den nydiagnostiserade patienten erbjuds att registreras som en ny indexpatient i screeningen, och därmed ges goda förutsättningar för att fortsätta med en obruten kaskadscreeningkedja.
Digifysisk kaskadscreening för familjär hyperkolesterolemi är sedan augusti 2021 en del av rutinsjukvården på Karolinska universitetssjukhuset. I en pilotstudie som utfördes före implementering i klinisk rutin identifierades ett åttafaldigt antal individer med risk för familjär hyperkolesterolemi, fördelat på 3 släktled, utifrån 10 indexpatienter. Antalet släktingar som bjöds in till screeningens nästa steg (blodprovtagning) var drygt 2 per indexpatient. Den lägre siffran förklaras av att indexpatienterna var uppmanade att i första hand bjuda in förstagradssläktingar (föräldrar, syskon, barn) till screening. I de fall de visste om arvet kom från mamman eller pappan var de också instruerade att bara bjuda in personer från den delen av släkten. Detta för att kaskadscreening bör genomföras sekventiellt med ett släktled i taget för att undvika onödig testning av individer flera släktled bort, där familjär hyperkolesterolemi redan kan vara utesluten. Vi avser att göra en komplett utvärdering av effekterna av införandet av den digifysiska vårdkedjan om 2 år, med fokus på deltagarnas kardiovaskulära hälsostatus, kolesterolsänkande behandling, screeningeffekt och hälsoekonomiska faktorer.
Framtiden för en digifysisk vårdkedja är ljus
Systematisk kaskadscreening av släktingar till patienter med genverifierad familjär hyperkolesterolemi i en digifysisk vårdkedja finns nu implementerad i klinisk rutinsjukvård i Region Stockholm. Goda resultat av kaskadscreening har redovisats tidigare från Nederländerna [22] med en tiofaldig utväxling (237 indexpatienter, 2 039 nydiagnostiserade) även om arbetet tog 5 år. Den digifysiska vårdkedjan har stor potential då modellen ökar patientengagemanget samtidigt som det minskar manuellt och administrativt sjukvårdsarbete. Tyvärr är antalet individer med diagnostiserad familjär hyperkolesterolemi i Sverige alltför litet för att kaskadscreening som enskild metod ska kunna lösa utmaningen med att identifiera hela kohorten. Därför genomför vi nu en pilotstudie med systematisk digifysisk screening av patienter med etablerad kranskärlssjukdom i syfte att identifiera fler indexpatienter som kan gå vidare till kaskadscreening. Hälso- och sjukvårdsförvaltningen i Region Stockholm har i november 2021 beslutat om 3 års projektfinansiering för screening i regionen enligt den digifysiska modellen. Det inger hopp om att kunna identifiera en betydligt större andel av populationen med familjär hyperkolesterolemi och därmed kunna erbjuda dem preventiv behandling.
Potentiella bindningar eller jävsförhållanden: Den tekniska lösningen som används i den digifysiska vårdkedjan är skapad i ett innovationsprojekt i samarbete mellan Karolinska universitetssjukhuset, med projektledare Karin Littmann och Jonas Brinck, IT-företaget Health Solutions och bioteknikföretaget Amgen.
Fakta 1. Schematiskt flöde av den digifysiska vårdkedjan för kaskadscreening av familjär hyperkolesterolemi.
- Patient med säkerställd genetiskt verifierad familjär hyperkolesterolemi (indexpatient) registreras på webbplattformen och loggar in med bank-id/Freja e-id.
- Indexpatienten kartlägger sina släktingar och skickar inbjudan till att delta i screening.
- Släktingen får en länk till inloggning på webbplattformen och tackar ja till att delta i screening. Släktingen får svara på ett antal frågor och får en remiss för blodprovstagning.
- Släktingen lämnar prov och svaren rapporteras in på klinikdelen av webbplattformen.
- Läkare bedömer provsvaren genom att logga in på klinikdelen av webbplattformen med sitt SITHS-kort. Släktingen får information om provsvar och läkarens bedömning via webbplattformen.
- Patienter som diagnostiseras med familjär hyperkolesterolemi får ett besök hos läkare på lipidmottagningen via telefon/video/fysiskt besök och erbjuds då att registreras som ny indexpatient för fortsatt screening av sina släktingar.