Sammanfattat
År 2004 infördes det kliniska prövningsdirektivet 2001/20, vilket ökade administration och kostnader för forskare.
EU-kommissionen startade samma år ECRIN – en infrastruktur till stöd för multinationella kliniska prövningar via partnerorganisationer i 13 EU-länder.
ECRIN bidrar tillsammans med andra forskningsinfrastrukturer till ett konkurrenskraftigt forskningsklimat i Sverige och EU.
För forskarinitierade studier gäller i dag samma regler vid genomförandet som för företagens kliniska forskning – ett ibland oöverstigligt hinder. Detta har inneburit att antalet kliniska prövningar har minskat, inte bara i Sverige utan över hela Europa. Även om extra resurser tillförs denna forskning riskerar en stor del av medlen att ätas upp av den byråkrati regelverken kräver.
EU-kommissionen har sjösatt en rad olika projekt för att stimulera den kliniska forskningen i Europa. ECRIN (European Clinical Research Infrastructures Network) är ett projekt som syftar till att skapa infrastruktur i Europa och nationellt för att hjälpa forskarsamhället att identifiera och genomföra multinationella kliniska prövningsprojekt.
Mer byråkrati och dyrare
Forskarinitierade kliniska prövningar i Europa har tidigare präglats av stort utrymme för akademisk fantasi och improvisation, och studierna har kunnat genomföras till relativt låg kostnad.
I syfte att förstärka EU:s konkurrenskraft infördes det kliniska prövningsdirektivet 2001/20 i maj 2004. Det innebar att regler för ansökan och genomförande gjordes enhetliga inom EU. I Sverige kom detta att omfatta flera nya regelverk med bl a en ny forskningsetikprövningslag, en förstärkt personuppgifts- och biobankslag samt en reviderad läkemedelslag.
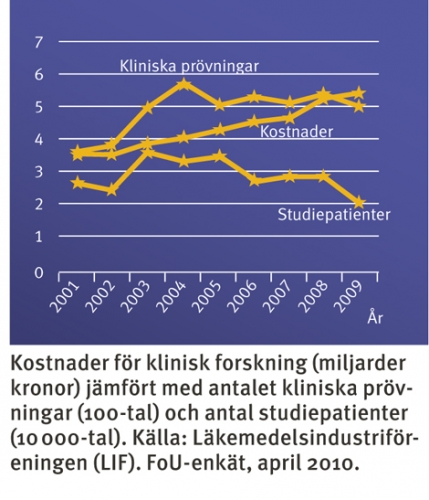
Parallellt med dessa regler och processer, som av många upplevdes som byråkratiska, ökade även kostnaderna. I studier genomförda av EORTC (European Organisation for Research and Treatment of Cancer) visade det sig att kostnaden för icke-kommersiella kliniska studier (forskarinitierade) ökade och kostnadsmässigt närmade sig företagsinitierad klinisk forskning.
I EU-direktivet ingick också krav på att undvika studier på personer som inte kan lämna samtycke. Det har i Sverige lett till att läkemedelsstudier på medvetslösa inte längre låter sig göras.
För den kliniskt verksamma forskaren leder detta till stora svårigheter. Det räcker inte längre med att vara uppdaterad på forskningsfronten och hålla i gång sin kliniska tjänstgöring. Därutöver måste forskaren känna till alla tillämpliga regelverk och sätta upp rutiner för kvalitetskontroll, något som resulterat i ökade kostnader. Denna kostnadsökning ses även för industrisponsrade kliniska prövningar (se figuren).
ECRIN avlastar prövare
År 2004 initierade EU-kommissionen ECRIN
Under nästa ECRIN-fas bildades transnationella arbetsgrupper som dels utarbetade gemensamma riktlinjer för support till multinationella studier, dels presenterade detaljer över varje lands regelverk.
År 2008 inleddes ECRIN:s tredje fas, där arbetet från de två första faserna implementeras via pilotprojekt. I detta skede blev det möjligt för forskare och sponsorer i ECRIN:s olika medlemsländer (i dag 13 länder, däribland Sverige) att ansöka om tillgång till det nätverk som ECRIN etablerat och därigenom erhålla support till infrastruktur i multinationella studier. Flera studier har på detta sätt dragits till Sverige.
Nationella nätverk samordnar via hubb
Parallellt med denna europeiska utveckling har ECRIN:s medlemsländer också etablerat nationella nätverk. Sveriges nätverk Swecrin
Men inget är gratis! Forskare på många håll har uppfattningen att stöd med infrastruktur till den kliniska forskningen bör vara en fri nyttighet och tillhandahållas av universitet eller sjukvårdshuvudmannen. Ofta vänder man sig till regionala centra eller till ECRIN för att få dessa tjänster utförda gratis. Även forskningens finansiärer har i dag en tendens att bortse från de kringkostnader som ovillkorligen drabbar den kliniska prövningen.
Infrastruktur för kliniska prövningar kostar, och man måste få ta betalt för sina tjänster. Således måste forskare, huvudmän och forskningsfinansiärer budgetera resurser också för kostnader kring prövningsfasen, inte bara för det kliniska genomförandet.
Inga gränsöverskridande kostnader
En av tankarna med ECRIN är att multinationella studier inte ska kosta mer än nationella. Partnerinstitutionerna inom ECRIN är kliniska forskningscentra som till största delen ger support åt akademiska forskare. Avgifterna för deras tjänster är därför anpassade till en akademisk projektbudget. ECRIN har hittills fått finansiellt stöd från EU:s 6:e och 7:e ramprogram, vilket sträcker sig till år 2011.
ECRIN planerar därefter att bilda ett konsortium med finansiellt stöd från respektive medlemsland och på så sätt garantera att inhemska forskare får tillgång till den forskningsinfrastruktur som ECRIN byggt upp. ECRIN:s portfölj av information och tjänster har utvecklats utifrån det behov som finns hos europeiska prövare och sponsorer.
Enligt en detaljerad behovsundersökning, genomförd i januari 2010 i samtliga ECRIN-länder, rankas ansökan till läkemedelsverk och etikprövningsnämnd samt stöd vid tecknande av försäkringar som de viktigaste tjänsterna vid genomförandet av multinationella studier.
Allmänheten engageras
I enlighet med målet att medvetandegöra medborgare om värdet av klinisk forskning och dess koppling till framtidens sjukvård har ECRIN initierat International Clinical Trials Day (ICTD) den 20 maj. Dagen firas till minne av James Lind, som genomförde den första kliniska prövningen 1747.
I år var Sverige värdland för detta årliga firande, och ECRIN genomförde i samarbete med Karolinska Trial Alliance en omfattande satsning i Kungsträdgården i Stockholm.
Till dagen var diverse opinionsbildare, forskare, företag, patientorganisationer, politiker, kändisar m fl inbjudna för att tala kring ämnet. Allmänheten erbjöds möjlighet till att ta del av diverse hälsotest samt ställa frågor kring vad det innebär att t ex vara organ-/bloddonator eller medverka som försöksperson i kliniska studier. En serie debatter och forskarledda föreläsningar i aktuella frågor drog ca 40 000 åhörare.
EU-projekt i samverkan
Problematiken i Europa sträcker sig bortom klinisk forskning och berör många andra aspekter inom forskningsflödet. EU-kommissionen har identifierat ytterligare områden som är i behov av systematiskt stöd i uppbyggnad av sin infrastruktur. Bland systerorganisationer till ECRIN ingår t ex nätverk inom bioinformatik, strukturell biologi, biobanker, djurmodeller och translationell medicin.
IMI (Innovative Medicines Initiative) har lanserats inom EU-kommissionens 6:e ramprogram och är baserad på industrins behov. Här anses flaskhalsarna ligga inom säkerhet, effekt, kompetens och utbildning. En strategisk åtgärdsplan har utformats för att avhjälpa dessa, och resurser och kompetens har mobiliserats från både industrin och akademin för att få till ett helhetstänk.
Svårigheterna anses vara så stora att konkurrerande läkemedelsföretag nu slår sig samman för att i ett paneuropeiskt perspektiv försöka möta aktuella och framtida utmaningar inom europeisk läkemedelsutveckling tillsammans med akademin och sjukvården.
Framtiden tycks finnas i ett »enat Europa«-tänk. Detta kan enligt vår mening också dras ner till nationell och regional nivå, där samverkan mellan aktörer och regioner kan förstärka svenska forskares möjlighet att konkurrera.
Kliniska studier riskerar utarmning
Slutsatsen blir att kliniska studier i dag inte kan göras utan ingående kunskap om regler och författningar och att den akademiskt initierade forskningen inom klinisk prövning utarmas allt mer, eftersom forskningsfinansiären sällan identifierar de kostnader infrastrukturen för med sig.
Problematiken måste tas på allvar så att de ansatser som i dag finns i Sverige för att skapa nätverk och strukturer med avsikt att ge stöd till den akademiskt initierade kliniska prövningen kan etableras och växa. Först då kan vi se en ljusning för klinisk forskning i Sverige och EU.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.