Ebolaepidemin i de tre västafrikanska länderna Sierra Leone, Liberia och Guinea är ännu utom kontroll. Samtidigt pågår ett mindre utbrott i Kongo–Kinshasa.
Ebola orsakas av filovirus, en av fyra typer av virus som kan orsaka blödarfeber. Förutom blödning, feber och myalgi drabbas infekterade av hypotoni och organsvikt. Diarré och kräkning är vanliga symtom.
Ebola har hög smittsamhet vid närkontakt med infekterade kroppsvätskor, men viruset är inte luftburet. Med korrekt utrustning går det att skydda sig mot smitta.
Ebola är en zoonotisk sjukdom, vilket innebär att det naturliga värddjuret inte är människa. Sannolikt är reservoaren för ebolavirus en eller flera arter av fruktätande fladdermöss. Antikroppar mot andra varianter av ebolavirus har påvisats i fladdermöss även utanför Afrika, vilket skulle kunna tyda på att dessa virus är mer spridda än man tidigare trott.
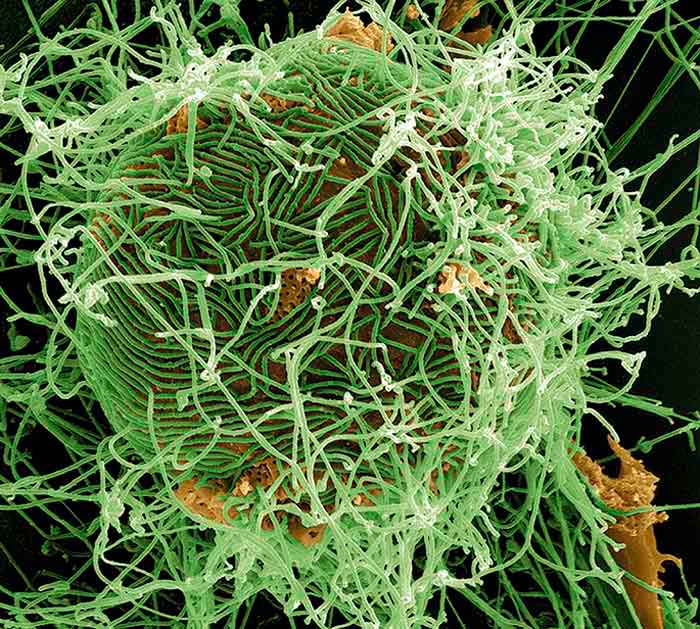
Flera virala proteiner samverkar till sjukdomsbilden vid ebola. Glykoproteinet är sannolikt det viktigaste; det förmedlar virusets inträde i cellen genom att binda till receptorer på cellens yta. Här syns ebolaviruspartiklar (grönt) utvecklas i en infekterad cell (orange).
Foto: National Institutes of Health/NIAID/SPL
Sedan våren 2014 pågår den största epidemin av ebola någonsin, med epicentrum i de västafrikanska länderna Sierra Leone, Guinea och Liberia [1]. Ett mindre men betydande utbrott, som inte har koppling till den västafrikanska epidemin, pågår även i Kongo-Kinshasa i Centralafrika.
Sjukdomens mest kända drag är feber, muskelsmärta, diarré och ökad blödningsbenägenhet. Under samtliga utbrott, även det nuvarande, har dödligheten bland infekterade varit mycket hög, uppemot 90 procent [2].
Någon effektiv behandling eller något vaccin finns inte, och intresset har hittills varit svalt från industrins sida att investera i utveckling av behandling och prevention. Till industrins försvar kan sägas att sjukdomens sporadiska uppdykande och försvinnande samt behovet av att utföra allt arbete i säkerhetslaboratorier (BSL-4) har gjort forskning och utveckling komplex.
Orsaker till epidemins omfattning
Den nuvarande epidemin har fått betydligt större spridning än tidigare begränsade utbrott. Dålig infrastruktur, spridning i storstäder och rudimentära sjukvårdsresurser i de värst drabbade länderna samt tidig och snabb geografisk spridning på grund av resande har hittills pekats ut som förklaringar till epidemins omfattning.
Sjukvården i de tre mest drabbade länderna har havererat, och patienter med andra sjukdomar och tillstånd har svårt att få hjälp och vård vid sidan av ebolakatastrofen. Sverige och många andra länder förbereder sig dels för insatser i området, dels för att öka sin beredskap för att ta emot fall »på hemmaplan«.
Första utbrottet år 1976
Ebola orsakas av ett filovirus. De första kända fallen av filovirusinfektioner inträffade i slutet på 1960-talet, i Tyskland och Jugoslavien. I samband med försök på apor som importerats från Afrika smittades laboratoriepersonal. Viruset som isolerades döptes till marburg (MARV) efter den tyska ort där laboratoriet var beläget.
År 1976 skedde två utbrott i Sudan och Zaire, nuvarande Demokratiska republiken Kongo (eller Kongo-Kinshasa), av en sjukdom som liknade dem som orsakades av marburgvirus. Det visade sig att utbrotten berodde på två likartade typer av filovirus, som båda var distinkt skilda från marburgvirus. Viruset fick namnet ebola (EBOV) efter den flod som flyter genom epidemiområdet i norra Kongo. Virusvarianterna döptes till Zaire respektive Sudan.
Sedan dess har ytterligare tre varianter av ebolavirus påträffats: Taï forest eller Côte d’Ivoire (Elfenbenskusten) och Bundibugyo från Uganda samt Reston, efter orten i Virginia i USA där den först isolerades efter dödsfall bland laboratorieapor. Restonvirus finns endemiskt på Filippinerna men är inte patogent för människa.
Sudan- och Zaire-varianterna har sedan de påträffades orsakat upprepade men sporadiska utbrott i olika delar av Centralafrika. Epidemin 2014 orsakas av en ny variant av Zaire-ebolavirus [1].
Glykoprotein binder till receptorer
Ebola orsakas av filovirus, som är RNA-virus. De sju generna kodar för åtta proteiner och omges av heliska nukleoproteiner som skapar en nukleokapsid. Flera virala proteiner samverkar till sjukdomsbilden. Det sannolikt viktigaste proteinet, glykoproteinet, sitter på virusets yta, likt utstickande nabbar. Glykoprotein binder till receptorer på cellytorna och medierar virusets inträde i cellerna.
Under bildningen av nya virus i cellens matrix utsöndrar den infekterade cellen stora mängder sekretoriska glykoproteiner. Dessa inhiberar immunförsvaret genom bl a apoptos av dendritiska celler och ger signaler om minskad mitos av lymfoida celler efter de 2–3 första dagarna av infektion.
Det spekuleras även om sekretoriska glykoproteiner kan vara ett lockbete för neutraliserande antikroppar. Glykoproteiner nedreglerar integriner, vilket i sin tur orsakar att exempelvis endotelcellerna blir rundare och släpper från varandra. På så sätt orsakas läckage från blodbanan med blödningar som följd.
Dessutom utsöndras stora mängder vasoaktiva substanser som cytokiner, kemokiner, histamin och peroxidas från infekterade monocyter. Detta samverkar ytterligare till ökad vätskeförlust och blödningsbenägenhet samt inducerar chock [2].
Inte det enda blödarfeberviruset
Det finns flera virus som kan orsaka blödarfeber eller hemorragisk feber, ofta förkortat VHF (viral hemorrhagic fever). Viral hemorragisk feber har flera gemensamma drag, oavsett vilket virus som är inblandat, bl a feber, muskelsmärtor och olika grader av blödningsbenägenhet.
Förutom de två besläktade virusen marburg och ebola kan arenavirus (exempelvis lassafebervirus), flavivirus (exempelvis gula febern och denguefeber) eller bunyavirus (exempelvis Krim–Kongofeber) orsaka liknande tillstånd [3].
De olika virustyperna ger upphov till kliniska särdrag, men de är svåra att särskilja från varandra utan tillgång till laboratoriediagnostiska metoder.
Fladdermöss kan vara virusreservoar
Alla virustyper som orsakar viral hemorragisk feber är höljeförsedda RNA-virus och alla orsakar zoonotiska sjukdomar, dvs de finns hos djur och kan via en serie händelser korsa artbarriärerna och slutligen hamna hos människa.
Man har länge ansett att någon eller några arter av fruktätande fladdermöss är de naturliga reservoarerna för både marburg- och ebolavirus, men hittills har man inte kunnat avgöra detta definitivt [3, 4]. Om fladdermöss är reservoar för ebolavirus, har virus och värd samexisterat så länge att fladdermössen inte uppvisar någon sjukdomsbild.
Det förhållandet gäller t ex änder och influensavirus. Värddjuret, som då inte uppvisar sjukdom, kan sprida viruset via exempelvis avföring eller bett till individer av samma art, men även till andra arter. Om de andra arterna är mottagliga för viruset, kan svår sjukdom uppstå.
Att identifiera vilka populationer som bär på virus utan att bli sjuka är komplext. Man har hittat antikroppar mot ebolavirus i flera arter av fruktätande fladdermöss, och man vet att flera andra däggdjursarter kan bli sjuka av viruset, däribland flera arter av apor, antiloper och grisar [5].
De fyra humanpatogena varianterna av ebolavirus orsakar blödarfeber med något varierande allvarlighetsgrad hos människa, men det är svårt att dra slutsatser kring dödlighet från de olika utbrotten på vitt skilda platser och tider och med olika antal drabbade.
Den variant som sprids i västra och centrala Afrika 2014 är Zaire, och den är sedan tidigare associerad med högst dödlighet av de fyra humanpatogena ebolavirusvarianterna. I likhet med Zaire har Sudan-varianten också orsakat flera utbrott, medan de övriga två inte har påträffats på länge [1].
Vätskeförlust via kärlläckage
Det huvudsakliga problemet med alla former av viral hemorragisk feber är egentligen inte blödning utan vätskeförluster via kärlläckage. Den immunologiska reaktionen hos värden orsakar ökad kärlpermeabilitet, som leder till ökad hudrodnad (ibland utslag), ödem, hypovolemisk hypotension och i svåraste fall organsvikt – allt beroende på en cytokinkaskad inte helt olik den vid SIRS (systemiskt inflammatoriskt svarssyndrom) vid svår sepsis.
Leukopeni och trombocytopeni är vanligt men varierar något bland olika former av viral hemorragisk feber. Krim–Kongo och allvarliga fall av gula febern är associerade med större problem med blödningar, även om detta kan vara framträdande också vid ebola. Diarré, kräkningar (ofta blodtillblandade), ikterus och petekier förekommer också i varierande grad.
Vad gäller ebola är anamnestiska uppgifter om närkontakt med sjuka, vistelse i epidemiskt område i samband med feber, diarré/kräkningar och myalgi viktiga faktorer att ta hänsyn till. I början av sjukdomsförloppet är ebola inte helt olik malaria, vilken är en viktig diagnos att utesluta hos denna patientgrupp. Inkubationstiden är 2–21 dagar, men oftast 4–10 dagar. Oftast dör den sjuke kring 10:e sjukdomsdagen.
Postmortemundersökningar visar påfallande avsaknad av immunrespons i form av antikroppssvar, förmodligen delvis beroende på virusorsakad apoptos av dendritiska celler, som är en av ebolavirusets initiala målceller vid infektion [2].
Några få diagnostiska verktyg
Förutom den epidemiologiska och kliniska bilden finns det några få diagnostiska verktyg. Det viktigaste är att detektera viruset med hjälp av PCR (polymeraskedjereaktion). Denna kan numera göras under närmast fältmässiga former och är inte nödvändigtvis kopplad till avancerade laboratorier. Det är viktigt att tänka på att ett negativt PCR-svar från ett troligt fall, men taget inom 3 dygn från de första symtomen, ska konfirmeras med ytterligare ett prov 72 timmar efter debutsymtom.
Det finns inga validerade serologiska metoder, varför påvisande av antikroppar inte har någon plats i den akuta diagnostiken. Elektronmikroskopi brister i sensitivitet, och virusisolering kan bara göras på laboratorier med den högsta säkerhetsklassen (BSL-4).
Begravning – en spridningsfaktor
Ebola smittar via närkontakt med kroppsvätskor från sjuka människor alternativt virusbärande eller sjuka djur. Det finns flera tänkbara sätt för virus att överföras från fladdermöss till andra däggdjur. Infekterad saliv från en fladdermus på delvis äten frukt skulle kunna föras vidare till ett annat fruktätande djur eller till människa. Ebolavirus är instabilt utanför värdkroppen, men kan vara infektionsdugligt i timmar till dagar vid optimala omständigheter, länge nog för att eventuellt kunna föra smittan vidare till en annan art [6]. Virus i avföring skulle också kunna smitta via föda eller vatten och spridas från fladdermus till andra djur, inklusive människa.
Den omfattande jakten på »bush-meat« är en omständighet som kan överföra smitta från djur till människa [7]. När viruset väl etablerats hos människa, sprids smittan genom närkontakt med smittade kroppsvätskor. Symtom i form av kräkning och diarré innebär ökad risk för smittspridning via kroppsvätskor och utgör en stor smittrisk i vårdsituationer. Med korrekta hygienrutiner anses risken dock ändå vara låg [8].
I den aktuella epidemin var den utlösande spridningsfaktorn besök på en begravning. I många länder förekommer begravningstraditioner som att den döde ska tvättas, beröras och kyssas av de närstående. Eftersom viruset kan vara aktivt på en död kropp i flera dagar, är detta en uppenbar smitt- och spridningsrisk.
Risk med luftburen smitta diskuteras
Det förekommer diskussioner om huruvida ebola eventuellt kan smitta genom aerosoler eller mikroskopiska vattenpartiklar i luft, men även om detta skulle visa sig vara en möjlig smittväg har det förmodligen ingen större praktisk betydelse. De föreskrifter som bl a Socialstyrelsen, WHO och CDC (Centers for Disease Control and Prevention) har angivit utgår från detta.
Patienter i Sverige med misstänkt ebola ska genast isoleras och så fort som möjligt beredas transport med specialambulans till högisoleringsenheten i Linköping. Vårdpersonal ska skydda sig mot kontakt med kroppsvätskor från konstaterat eller misstänkt smittade patienter med heltäckande, vätsketåliga skyddskläder, visir, tättslutande andningsskydd (EU-klass FFP3) och dubbla handskar. Se även Socialstyrelsens rekommendationer för handläggning av misstänkta fall av ebola, reviderade senast 26 september 2014.
Antivirala medel utan effekt vid ebola
Dödligheten i ebola verkar variera beroende på vilken virusvariant som orsakar sjukdom. Zaire-stammen har hittills uppvisat den högsta dödligheten bland de olika ebolavirusvarianterna. Det är dock svårt att dra slutsatser kring dessa siffror, eftersom utbrotten skett på olika platser och ofta med undermåliga sjukvårdsresurser och infrastruktur. Underrapportering av sjukdomsfall och dödsfall förvirrar statistiken ytterligare.
Erfarenheter från höginkomstländer med möjligheter till intensivvård är begränsade, och jämförelser svåra att göra. Man kan dock förmoda att dödligheten är lägre med optimerad understödjande vätsketerapi.
Antivirala läkemedel som ribavirin har prövats med viss framgång på flera virus som orsakar viral hemorragisk feber, men det har inte effekt på ebola. Försök att ge plasma från donatorer som tillfrisknat från viral hemorragisk feber har gjorts i syfte att tillföra antikroppar mot virus, detta mot bakgrund av det bristfälliga immunsvaret som påvisats hos avlidna. Sådana försök har gjorts vid infektion med arenavirus [9] med positiva resultat samt vid ett försök utan kontrollgrupp vid ebolavirusinfektion [10]. Den egentliga effekten av denna behandling har dock betvivlats efter mer kontrollerade försök med icke-människoapor [11].
Frågor kring läkemedel och vaccin
Under den senaste tiden har ljus riktats mot nya experimentella läkemedel som baseras på monoklonala antikroppar mot ebolavirusets ytantigen [12, 13]. ZMapp, som har prövats på flera patienter som smittats i Afrika och evakuerats till bl a USA, består av tre olika antikroppar mot ebolavirusets ytstrukturer. ZMapp är en utveckling, eller optimering, av två tidigare experimentella antikroppsblandningar. Då utbrottet började hade framgångsrika men småskaliga försök gjorts på marsvin och apor, men inte på människa [12].
I dagsläget har få patienter fått ZMapp, och långtgående slutsatser är svåra att dra med så litet underlag. Till detta måste läggas att dessa patienter även fått den bästa understödjande behandlingen som västerländsk medicin kan uppbringa. Om det är ZMapp eller god intensivvård som räddat dessa patienter är oklart.
En intressant detalj kring ZMapp är att antikropparna produceras i transgena tobaksplantor. För närvarande finns inte detta läkemedel att tillgå ens för experimentell behandling. Tobaksplantorna håller just nu på att växa till sig i USA, där mer antikroppar ska produceras.
Forskning kring ebolavaccin har intensifierats, men många frågor, främst om var, hur och till vem ett eventuellt framtida vaccin ska ges, kvarstår [3].
Resultat från det mest lovande vaccinförsöket publicerades nyligen [14]. I ett »prime-boost«-försök vaccinerades makakapor med ett schimpans-adenovirus som modifierats för att koda för ebolavirusets glykoprotein. 8 veckor senare vaccinerades makakerna igen, men då med ett modifierat vaccinia-virus kodande för samma glykoprotein. Efter första vaccindosen var aporna immuna under några veckor, medan de apor som fått båda doserna var immuna i upp till 10 månader, då försöket avbröts.
Viktigt förstå vår roll i ekosystemet
Behovet av mer intensiv forskning om övervakning, prevention och behandling har blivit uppenbart under de senaste månaderna. För att vi ska ha möjlighet att begränsa sjukdomen i framtiden och förhindra nya utbrott krävs grundläggande förståelse kring var viruset finns mellan utbrotten och epidemierna. Det vill säga: Vilken eller vilka djurarter är reservoarer för ebolavirus, och hur sprids viruset från djur till människa? Vilka svaga länkar vad gäller smittspridning finns i omhändertagandet av sjuka?
Slutligen måste vi fråga oss hur vår inverkan på naturen och på ekosystemen kommer att påverka oss i framtiden. Den enorma skogsskövling som pågått i de berörda västafrikanska länderna (vid sidan av inbördeskrig) kan givetvis ha underlättat utbrottets uppkomst genom ökad kontakt mellan människor och vilda djur, både primater och fladdermöss.
I början av förra seklet skrev biologen Theodosius Dobzhansky »Nothing in biology makes any sense except in the light of evolution«. Vi vill tillägga »nothing in medicine makes any sense except in the light of ecology«. Först när vi förstår och respekterar våra och andras roller i ekosystemet kan vi bäst undvika liknande katastrofer i framtiden.
Donation som »årets julklapp«
Avslutningsvis ägnar vi en tanke åt dem som med risk för egen hälsa är i katastrofområdet för att hjälpa sina medmänniskor. En donation till någon av hjälporganisationerna, t ex Läkare utan gränser eller Röda korset, skulle vara en snygg »årets julklapp« i stället för råsaftscentrifug eller platt-tv.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Se även
http://www.socialstyrelsen.se/publikationer2014/2014-6-7
Information om aktuella utbrott finns på:
























