Den europeiska tvingande lagen från 2007 om att nya läkemedel måste dokumenteras på barn har lett till att antalet nya läkemedel och nya indikationer för barn har ökat.
I ett par nordiska länder och många andra europeiska länder finns nätverk för kliniska läkemedelsstudier på barn.
Förutsättningar för sådana nätverk måste skapas också i Sverige genom insatser från sjukvården, staten och industrin.
Figur 1
Bristen på effektiva och dokumenterade läkemedel för barn beskrevs redan 1968 av den amerikanske läkaren Harry Shirkey. Det dröjde dock många år innan problemet togs på allvar. Först 1997 föreslog den amerikanska läkemedelsmyndigheten FDA en 6 månaders patentförlängning för nya läkemedel som studerades och dokumenterades på barn. Förslaget antogs och följdes året därpå av en regel som föreskrev att alla läkemedelstillverkare i vissa fall måste dokumentera nya läkemedel och nya indikationer i studier på barn.
I Europa började liknande tankar på en lagstiftning växa fram. Initiativ togs från vetenskapligt håll redan 1997 av ESDPPP (European Society for Developmental, Perinatal and Pediatric Pharmacology) genom att man begärde en rundabordskonferens med humanläkemedelskommittén (CHMP; Committee for Medicinal Products for Human Use) inom den europeiska läkemedelsmyndigheten EMA (European Medicines Agency).
Idéerna diskuterades därefter i många rundor mellan EMA, Europeiska rådet, industrins företrädare, berörd medicinsk expertis, EU-kommissionen och Europaparlamentet.
Gav både piska och morot
Efter nästan tio år lade EU-kommissionen slutligen fram ett förslag till ny lag, som antogs av parlamentet och infördes i januari 2007 [1].
De nya kraven på pediatrisk dokumentation för alla nya läkemedel och nya indikationer (»piskan«) förenades med en »morot«, nämligen att tillverkaren kan åtnjuta 6 månaders förlängning av patentet, vilket för läkemedel med stora indikationsområden har betydande ekonomiskt värde.
EMA-rapport visar positiv bild
EMA har nyligen redogjort för erfarenheterna och resultaten av den nya lagen [2]. Rapporten är för närvarande utlagd för s k offentligt samråd, vilket gör det möjligt att kommentera den.
Rapporten [3] visar en positiv bild av utvecklingen, både när det gäller antalet nya läkemedel för barn, nya farmaceutiska beredningsformer, mängden information om barnläkemedel, forskning och utveckling av läkemedel för barn och integrering av barngruppen inom generell läkemedelsutveckling. Av det totala antalet kliniska prövningar har andelen kliniska prövningar på barn ökat från 9,3 procent 2006 till 11,5 procent 2015.
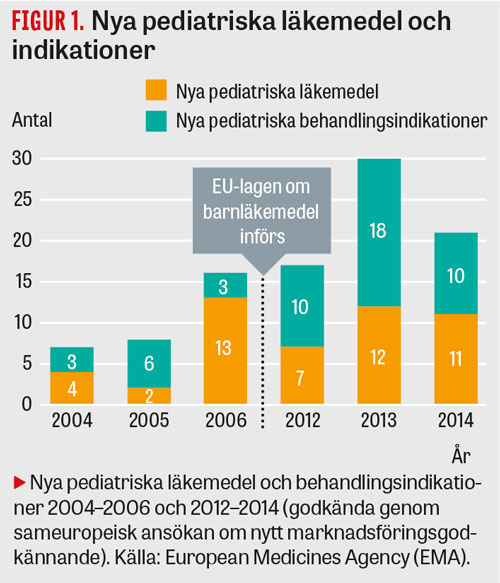
Antalet nya läkemedel för barn och nya pediatriska indikationer i EU ökade markant från 3-årsperioden närmast före införandet av lagen (2004–2006) till perioden 2012–2014 (Figur 1).
Av rapporten framgår också att antalet nyfödda patienter planerade att ingå i kliniska studier anmälda till den europeiska databasen EudraCT var 470 åren 2007–2009. Under 3-årsperioden 2013–2015 var motsvarande siffra 13 000. Det visar tydligt det stora behovet av klinisk läkemedelsutveckling för barngruppen.
Från 2007 till 2015 har 49 nya mediciner för pediatrisk användning blivit godkända som ett resultat av kraven i den nya lagen. Under samma period har dessutom 64 nya indikationer och 13 nya beredningsformer anpassade för barn godkänts. Därutöver har ytterligare ett antal nya mediciner, indikationer och pediatriska beredningsformer godkänts oberoende av den nya lagen. Siffrorna är flera gånger högre än motsvarande siffror i Japan och Kanada, där liknande lagstiftning saknas.
PUMA har inte varit attraktiv
Möjligheten att utveckla och anpassa gamla läkemedel utan patent för användning på barn har dock inte varit särskilt attraktiv, trots möjligheten att få ett 10-årigt »dataskydd« för den nya indikationen och beredningsformen. Endast två läkemedel har godkänts med det nya marknadsföringsgodkännandet (PUMA; Pediatric use marketing authorisation) nämligen midazolam och propranolol (för hemangiombehandling). Det ekonomiska incitamentet har inte varit stort nog, troligen eftersom användningen av gamla odokumenterade läkemedel utanför godkänd indikation (off label) redan är utbredd och produkterna är billiga att köpa.
Av samtliga godkända läkemedel och indikationer ökade andelen läkemedel för barn från 25 procent 2004–2006 till 35 procent 2012–2014.
Har ännu inte nått klinisk praxis
Många studier har visat att användningen av odokumenterade läkemedel och dosregimer är stor hos barn, och allra störst hos nyfödda. En periodprevalensstudie 1999 [4] av sjukhusinlagda barn i fem EU-länder, däribland Sverige, visade att hälften av alla barn fick läkemedel ordinerade utanför godkänd indikation. Hos nyfödda var siffran över 60 procent.
Tio år senare var användningen utanför godkänd indikation fortfarande lika stor i Sverige och många andra länder [5]. Det visar att den positiva utvecklingen som beskrivs ännu inte slagit igenom i den kliniska användningen av barnläkemedel.
Situationen globalt och i EU
Sammantaget har EU-lagen om barnläkemedel sedan den infördes 2007 haft en mycket positiv inverkan på EU:s läkemedelsutveckling för barn. Den numera gamla och konservativa attityden att »skydda« barn från läkemedel och läkemedelsstudier har definitivt brutits med ökad kunskap hos allmänheten och genom de viktiga lagändringarna i USA och EU.
Världshälsoorganisationen har också bidragit till detta genom en resolution 2007 om bättre läkemedel för barn.
Behovet av effektiva och dokumenterade barnläkemedel understryks också av FN:s millenniemål från 2000. Detta gäller särskilt det fjärde målet: Att reducera barnmortaliteten med två tredjedelar till år 2015. I flera delar av världen har man sett betydande framgång med arbetet för detta mål, men i afrikanska länder söder om Sahara är situationen fortfarande mycket allvarlig.
Globalt halverades den totala mortaliteten hos barn under 5 års ålder från drygt 12 miljoner barn till drygt 6 miljoner per år under perioden 1990 till 2013, och mortaliteten är fortsatt på väg ner.
Även om bristande sanitet och nutrition är de främsta orsakerna till barnadödligheten globalt, är många dödliga sjukdomar behandlingsbara, t ex diarrésjukdomar, malaria, hiv och tuberkulos. Nya läkemedel och gamla läkemedel med dokumenterade behandlingsregimer för barnsjukdomar kan avsevärt bidra till att minska mortaliteten och morbiditeten – naturligtvis förutsatt adekvat tillgång till läkemedlen och ekonomisk möjlighet att köpa dem.
Men nya lagar och politiska mål räcker inte. Pengar måste också reserveras för läkemedelsstudier. Lovvärda satsningar att stödja utvecklingen har vi sett i EU:s 7:e ramprogram och i det nu aktuella Horisont 2020 (http://ec.europa.eu/programmes/horizon2020/en/), där bl a Innovative Medicines Initiative (IMI2 Call 10) ger möjlighet att söka bidrag från den globala läkemedelsindustrin med eventuellt samstöd från EU.
Förutsättningar i Norden och Sverige
För att genomföra arbetet med läkemedelsutveckling för barn krävs infrastruktur inom sjukvården och akademin; dessutom krävs engagemang från den medicinska professionen för att verksamheten ska kunna bedrivas och uppfylla de kvalitetskrav som ställs i Europa av myndigheter och läkemedelsindustrin.
I ett par nordiska länder (Finland och Norge) finns redan i dag nätverk och organisationer som med stöd från samhället (sjukvård, stat och universitet) skapat sådana förutsättningar (www.finpedmed.fi respektive www.legemidlertilbarn.no).
I Sverige har vi ännu inte kommit dit. Arbete för att skapa ett svenskt motsvarande nätverk bedrivs bl a i Barnläkarföreningens intresseförening för barn och läkemedel med förväntat stöd från de regionala forskningsnoderna. Hittills har gensvar på ansökan om stöd från departement och Vetenskapsrådet tyvärr uteblivit.
Men frågan lever, och arbetet att skapa motsvarande förutsättningar i Sverige fortsätter.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.



















