Abdominellt aortaaneurysm kan behandlas med öppen (OAR) eller endovaskulär (EVAR) teknik.
OAR har något högre risk på kort sikt, medan EVAR medför fler livshotande reinterventioner, sekundärrupturer och högre aneurysmrelaterad dödlighet på lång sikt.
Förväntad överlevnad måste bedömas, och risker på kort och lång sikt måste värderas inför behandling.
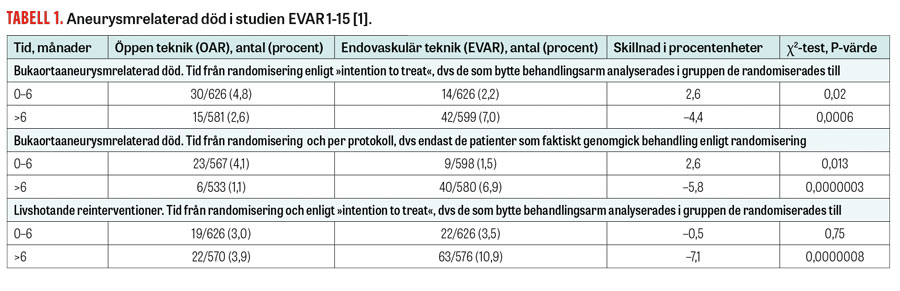
Tabell 1
Endovaskulär behandling (EVAR; endovascular aortic repair) för bukaortaaneurysm är ett alternativ till öppen aortarekonstruktion (OAR; open aortic repair). Bukaortaaneurysm med diameter <55 mm har låg sannolikhet för ruptur, ger sällan några symtom före ruptur och innebär inte någon säker nackdel för patienten, bortsett från risken för ruptur. Patienter med bukaortaaneurysm kan få förlängd överlevnad genom att ruptur förhindras, men patienten måste ha rimlig förväntad överlevnadstid för att dra nytta av ingreppet.
Nyligen har en 15-årsuppföljning av EVAR 1-studien publicerats [1], liksom en metastudie av de fyra randomiserade studier som jämför OAR och EVAR [2]. Jag fokuserar här på skillnader i absoluta procent, absoluta antal och kumulativa skillnader omräknade till 15 års uppföljning. Data är hämtade från 15-årsuppföljningen av EVAR 1-studien (EVAR 1-15) [1] och den nyligen publicerade metaanalysen [2] av de fyra randomiserade studierna (EVAR 1 [3], DREAM [4], ACE [5] och OVER [6], här kallad META 4, men också från EVAR 2 [7].
Resultaten från EVAR 1-15 och META 4
Vad avser dödlighet av alla orsaker finns ingen statistiskt säkerställd skillnad mellan de två teknikerna, vare sig i EVAR 1-15 eller META 4. Medianöverlevnaden är ca 8 år i EVAR 1-15 och runt 9 år i META 4. Var femte patient i EVAR 1-15 överlevde >15 år efter invasiv behandling.
Tabell 1 visar data från EVAR 1-15 gällande aneurysmrelaterad död. Skillnaden i tidig aneurysmrelaterad mortalitet mellan de två teknikerna är drygt 2 patienter per 100 till fördel för EVAR.
I Sverige var under 2014 och 2015 30-dagarsmortaliteten efter OAR 16/745 (2,1 procent) och efter EVAR 19/1 265 (1,5 procent) (skillnad 0,6 procentenheter). Detta gäller rutinsjukvård och innefattar alla elektivt opererade patienter med infrarenala bukaortaaneurysm och med en sammantagen operationsmortalitet på 35/2 010 (1,7 procent) [8].
Aneurysmrelaterad mortalitet efter 6 månader är 4,4 och 5,8 procentenheter högre för EVAR enligt »intention to treat«- respektive per protokoll-analys. I EVAR 1-15 kan kumulativ aneurysmrelaterad mortalitet mätas/skattas vid 1 och 12,7 år efter randomisering. Om detta räknas om till 15 års uppföljning fås 1,9 procent respektive 12,8 procent aneurysmrelaterad kumulativ dödlighet från 1 år efter randomisering till 15 års uppföljning för OAR respektive EVAR (skillnad 10,9 procentenheter).
I META 4 presenteras data för sekundär aneurysmruptur hos dem som faktiskt opererades med EVAR. Vid 8 år kan mätas/skattas att 4,8 procent av patienterna drabbats av sekundär aneurysmruptur. Detta kan räknas om till 8,8 procent kumulativ risk för sekundär aneurysmruptur 15 år efter operation med EVAR-teknik.
EVAR är förenad med fler reinterventioner än OAR. I Tabell 1 visas att reinterventioner för livshotande tillstånd är 7,1 procentenheter vanligare för EVAR än för OAR i det senare förloppet. I EVAR 1-15 visas att detta också kvarstår efter 5 år. Således har EVAR väsentligt fler reinterventioner än OAR också för livshotande tillstånd; detta gäller även den senare delen av uppföljningen.
Bedömning inför öppen aortakirurgi
I både EVAR 1-15 och META 4 diskuteras hur komplikationer efter EVAR ska hanteras/elimineras. Livslånga kontroller bedöms vara nödvändiga. Efter 8 år var cancerdödligheten för EVAR-armen i EVAR 1-15 5,4 procentenheter högre än för OAR, vilket kan göra ytterligare kontroller med exponering för joniserande strålning problematiska.
Däremot nämns inte möjligheten att förbättra de tidiga resultaten efter OAR. Sannolikt finns här utrymme för förbättringar.
Den franska studien ACE valde att enbart randomisera patienter med låg och måttlig risk för postoperativ död enligt ett riskvärderingssystem [9] avsett just för aortakirurgi (SVS/AAVS; Society for Vascular Surgery/American Association for Vascular Surgery) (Fakta 1). I ACE rapporteras inte hur många patienter som exkluderades på grund av hög risk, men detta har skattats till 20 procent [Jean-Pierre Becquemin (huvudman för ACE-studien), Paris, pers medd; 2017].
I ACE redovisades tydligt vilken riskpoäng de ingående patienterna hade. Den postoperativa mortaliteten var 0,7 procent för OAR och skiljde sig inte statistiskt från mortaliteten i EVAR-armen. Den låga postoperativa mortaliteten efter OAR förefaller vara mer en konsekvens av ett medvetet patienturval (patienter med hög risk utesluts) än ett slumpmässigt utfall. Resultatet är inte orealistiskt; i Östergötland hade vi under 1997–2006 en operationsmortalitet på 0,6 procent för elektiva infrarenala bukaortaaneurysm, och vi opererade i genomsnitt 34 patienter per år (data från Swedvasc).
Korttidsresultaten efter OAR borde kunna förbättras både avseende handläggning och patientselektion. Med tanke på de sämre långtidsresultaten efter EVAR jämfört med OAR är det inte rimligt att använda EVAR hos patienter med låg till måttlig risk för mortalitet efter OAR. Svenska patienter med bukaortaaneurysm borde värderas med riskvärderingsystemet SVS/AAVS (Fakta 1) [9] som bas för förbättrad selektion inför öppen kirurgi.
Osäker nytta av EVAR hos sköra patienter
Patienter med hög peroperativ risk bör optimeras inför ingreppet, men trots detta kommer det att finnas patienter med för hög risk. Bör då dessa patienter behandlas med EVAR? I EVAR 2-studien [7] randomiserades patienter som ansågs för sköra för OAR i EVAR 1-studien [1] till antingen bästa medicinska behandling eller bästa medi-cinska behandling och EVAR. Trots att en rationell riskvärdering användes finns ingen tydlig redovisning av förekomst av specifika riskfaktorer för postoperativ död i vare sig EVAR 1- eller EVAR 2-studien, vilket gör jämförelse med andra patientmaterial svår.
Patienterna i EVAR 2 ter sig skörare än dem som exkluderades från ACE-studien på grund av hög risk, men jag saknar data som stöder detta. Tillägget av EVAR till bästa medicinska behandling förbättrade inte dödligheten av alla orsaker vid »intention to treat«-analys. Däremot förelåg färre aneurysmrelaterade dödsfall i EVAR-armen, dock utan effekt på överlevnad. En per protokoll-analys visade icke-signifikant något bättre sen överlevnad för de som ingick i EVAR-armen. 70 patienter som fick bästa medicinska behandling enbart (34 procent) genomgick trots allt EVAR (överkorsning mellan studiegrupperna), något som med rätta har kritiserats och som kan ha förbättrat överlevnaden i den armen.
Generellt var överlevnaden betydligt sämre än i META 4. Risken för ruptur av bukaortaaneurysm på 55–69 mm är ca 30 procent på 3 år [10], vilket medför svårigheter att avgöra vilken nytta EVAR ger i en population med totalmortalitet på 50 procent efter 3 år, som i EVAR 2. Det är således osäkert om sköra patienter får bättre överlevnad med EVAR. Dock kan det finnas icke-klarlagda distinktioner mellan »lite skör« och »mycket skör«, vilket har en avgörande betydelse för denna fråga.
För att rekonstruktion av ett bukaorta-aneurysm ska vara meningsfull måste den förväntade tiden till aneurysmruptur vara kortare än patientens förväntade överlevnad. En ordentlig riskvärdering av den svenska populationen med bukaortaaneurysm skulle kunna etablera tumregler för vilka som har nytta av EVAR.
Patienternas preferenser
I EVAR 1-15 uppges att patienterna föredrar EVAR framför OAR. I ursprungs-publikationen [11] fick patienter uppge sina preferenser, och de informerades bl a enligt följande: 1) operationsmortaliteten för OAR vs EVAR är 4–8 procent vs 2 procent; 2) konvalescensen är 2–3 månader vs 4–6 veckor. Ingen information gavs om sekundärrupturer, senare aneurysmrelaterad död, livshotande reinterventioner eller riskbaserad selektion inför OAR/EVAR.
I Sverige är operationsmortaliteten vid OAR respektive EVAR 2,1 respektive 1,5 procent, och konvalescensen är 4 respektive 2–3 veckor.
För- och nackdelar med båda metoderna
Ingen av de två metoderna är i alla avseenden överlägsen den andra. OAR kan vara krävande för sköra patienter men har god hållbarhet på sikt. EVAR är mera skonsam men är förenad med livslånga kontroller, flera livshotande reinterventioner, kvarvarande hot om ruptur och möjlig ökad risk för död i cancer. Patienter med buk-aortaaneurysm måste inför öppen eller endovaskulär behandling bedömas avseende medicinsk risk och förväntad överlevnad, och de ska erbjudas en diskussion om risker på både kort och lång sikt med de olika behandlingsalternativen.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1. SVS/AAVS riskvärdering [9]
I riskvärderingssystemet SVS/AAVS värderas riskfaktorer för mortalitet på skalan 0–3 (ingen, lätt, måttlig eller hög risk). Risken värderas i fem grupper: hjärta, lungor, njurar, blodtryck och ålder. Varje riskgrupp kan ge 3 poäng. Hjärtrisken viktas med faktor 4, lung- och njurrisken med faktor 2 och blodtryck och ålder med faktor 1. Man kan således få 0–30 i riskpoäng. Dessa riskpoäng divideras med 10, vilket ger riskvärderingen 0–3, motsvarande ingen, lätt, måttlig eller hög risk för postoperativ död.
Bland de riskfaktorer som bedöms som mest allvarliga (3 poäng) återfinns:
Hjärta: Instabil angina, okontrollerad arytmi, okontrollerad hjärtsvikt, ejektionsfraktion <25 procent, färsk hjärtinfarkt.
Lungor: Vitalkapacitet (VC) <1,85 l, forcerad exspiratorisk volym (FEV) <1,2 l, maximal voluntär ventilationsförmåga (MVV) <50 procent, PCO2 >45 mm Hg, O2-behandling, pulmonell hypertension.
Njurar: Uremi/dialys.
Blodtryck: >2 blodtrycksläkemedel/okontrollerad hypertoni.
Ålder: >80 år.



















