Nuvarande analysmetoder vid svenska sjukhuslaboratorier för kortisolbestämning i serum och plasma ger lägre nivåer än de metoder som använts tidigare.
Med beaktande av felkällor och patientens kliniska bild bedöms ACTH-kortisolaxeln fungera tillfredsställande om P-kortisol >350 nmol/l i morgonprov från ostressad patient eller P-kortisol >450 nmol/l efter Synacthen-injektion.
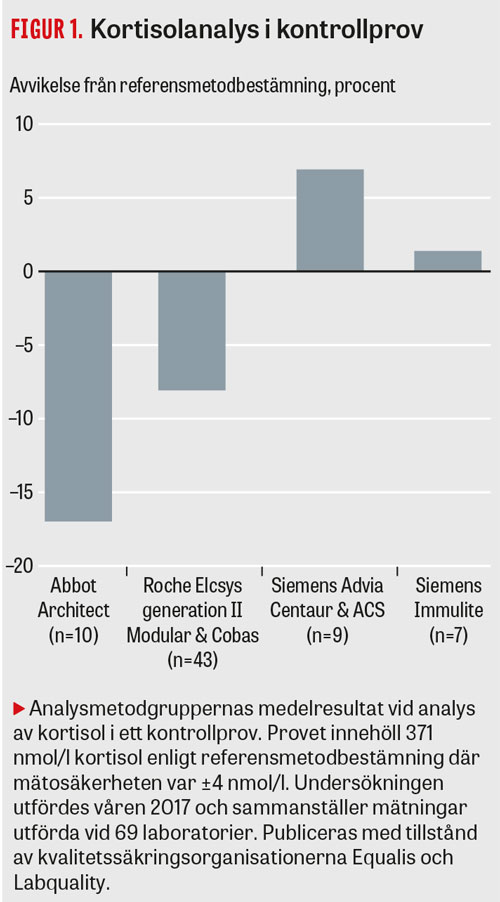
Figur 1
Kortisol är ett livsnödvändigt hormon som produceras i binjurebarken. Denna glukokortikoid samverkar med andra hormoner för att upprätthålla blodtrycket och har en rad effekter via receptorer som finns i nästan alla vävnader, vilket säkerställer bl a att hjärnan har tillgång till energi under stress.
Primär binjurebarkssvikt (Addisons sjukdom) innebär kraftigt nedsatt eller helt utslagen produktion av kortisol i binjurebarken. Det är ett ovanligt tillstånd, som snabbt kan bli livshotande (addisonkris). Central binjurebarkssvikt innebär att hypofysens produktion av det kortisolstimulerande hormonet adrenokortikotropin (ACTH) är nedsatt. Central binjurebarkssvikt kan indelas i sekundär (på grund av störd ACTH-produktion vid hypofyssjukdom) och tertiär (på grund av långvarig läkemedelsbehandling med glukokortikoider).
Kortisolbristen vid såväl primär som central binjurebarkssvikt medför risk för livshotande situationer vid svår stress (trauma, sepsis, gastroenterit och stor kirurgi) om inte adekvat ersättning med glukokortikoider ges. För att värdera binjurebarkens funktion mäts kortisolkoncentrationen i plasma under betingelser som stimulerar kortisolproduktionen. Det är viktigt att dessa funktionstest på ett korrekt sätt kan både diagnostisera kortisolbrist och fria från brist, eftersom behandling med (suprafysiologiska doser av) glukokortikoider i sig är förenad med ökad morbiditet och mortalitet [1, 2].
Bestämning i serum och plasma
Mätning av kortisolkoncentration i plasma och serum har traditionellt utförts med fluorometriska metoder som bygger på att kortisolderivat har fluorescerande egenskaper. Dessa metoder har ersatts av kompetitiva antikroppsbaserade analysmetoder som numera är automatiserade.
Fluorometriska analysmetoder medförde betydande korsreaktivitet med olika steroidmetaboliter. De mer specifika antikroppsbaserade analysmetoder som används i dag ger därför lägre nivåer av kortisol.
Trots detta baseras riktlinjer för tolkning av kortisolresultat i litteraturen på kortisolbestämning med fluorometrisk metodik [3]. Fram till år 2015 använde de flesta svenska universitetslaboratorier en analysmetod för kortisolbestämning i plasma (Roche Elecsys generation I) som gav ca 20–25 procent högre nivå än de kortisolbestämningsmetoder som nu används inom svensk sjukvård. Därefter förändrade reagensleverantören metoden så att den nya metoden (Roche Elecsys generation II) ger en nivå som är likartad övriga i dag använda metoder (Figur 1).
Metodberoende skillnader finns där vissa analysmetoder ofta ger något högre nivå än andra. Figur 1 visar skillnaden i medelmetodnivå för metoder som för närvarande används i Sverige i förhållande till bästa tänkbara mätning (referensmetodbestämning). Data kommer från en provningsjämförelse arrangerad av kvalitetssäkringsorganisationen Labquality i samarbete med den svenska kvalitetssäkringsorganisationen Equalis.
Metodskillnaderna är dock inte konstanta utan varierar med kön och andra provberoende faktorer, vilket gör det svårt att etablera och tillämpa metodberoende beslutsgränser [4]. Svenska Equalis ger i en rekommendation från 2017 laboratorierna vägledning om svarsrutin för kortisolbestämning i serum och plasma [5].
Funktionsundersökningar
Insulininducerad hypoglykemi (insulintoleranstest; ITT) påverkar hypotalamus till att stimulera hypofysens ACTH-frisättning, vilket i sin tur stimulerar frisättning av kortisol från binjurarna. Testet anses vara referensmetod, eftersom det involverar hela hypotalamus–hypofys–binjuresystemet (HPA-axeln).
Äldre undersökningar har visat god överensstämmelse mellan ITT och det mindre påfrestande Synacthen-testet [6]. Synacthen-testet introducerades under 1950-talet och är nu den vanligaste metoden att bedöma binjurebarkens kortisolproduktion. En syntetisk ACTH-peptid injiceras intravenöst (vanligen 250 µg), och kortisolkoncentrationen i plasma mäts efter 30 och 60 minuter.
Beslutsgräns för kortisolkoncentration som friar från misstanke om kortisolsvikt är omdiskuterad. Tankar har funnits om att definiera sufficient binjurebarksfunktion som den lägsta kortisolrespons vid ITT som krävs för att säkert kunna utföra elektiv kirurgi, men någon väl underbyggd beslutsgräns har aldrig definierats [7]. I litteraturen anges ofta att adekvat plasmakortisol vid ITT bör vara ≥500–550 nmol/l. Vid misstanke om primär binjurebarkssvikt förordar Endocrine Society, i riktlinjer från 2016, att en kortisolkoncentration i plasma efter Synacthen-test på <500 nmol/l indikerar binjurebarksinsufficiens [8].
En välgjord brittisk studie av kortisolkoncentrationer 30 minuter efter 250 µg Synacthen fann nedre referensintervallsgränser (2,5 percentil) 430 nmol/l hos män och 416 nmol/l hos kvinnor med analysmetoden Abbott Architect, 446 nmol/l med Siemens Advia Centaur, 474 nmol/l med Siemens Immulite 2000 och 457 nmol/l med Beckman Access [9].
En studie från Norge fann en nedre referensintervallsgräns på 412 nmol/l vid 30 minuter och 485 nmol/l vid 60 minuter efter Synacthen, analyserat med LC-MS/MS [10]. En nyligen publicerad spansk studie av kvinnor med kortisolmätning 30 minuter efter 250 µg Synacthen fann en nedre referensintervallsgräns på 436 nmol/l vid analys med Siemens Immulite 2000 och 411 nmol/l vid analys med Abbott Architect [11].
Till detta ska läggas erfarenheten av att de flesta svenska universitetslaboratorier har använt Roche Elecsys generation I fram till 2015 och sannolikt utvärderat Synacthen-testen mot de traditionella gränserna 500–550 nmol/l. Detta motsvarar en lägre nivå (ca 400–450 nmol/l) med nuvarande analysmetoder.
Sammantaget bedömer vi att plasmakortisol >450 nmol/l uppmätt med nuvarande analysmetoder efter Synacthen-test hos en ostressad individ och med beaktande av patientens kliniska bild samt nedanstående felkällor, motsäger behandlingskrävande kortisolsvikt.
Vi ser inget skäl att tillämpa olika beslutsgränser vid Synacthen-test för primär respektive sekundär kortisolsvikt, förutsatt att 6 veckor förflutit efter en potentiell hypofysskada inklusive hypofysoperation [12].
Morgonkortisol
Vid normal dygnsrytm är kortisolkoncentrationen i plasma hög efter morgonuppvaknandet. I litteraturen anges att morgonkortisol ≥400 nmol/l motsäger kortisolsvikt, förutsatt att patienten inte är utsatt för svår stress [13]. Detta bygger på jämförelser av morgonkortisolnivåer i plasma hos individer med normalt Synacthen-test [14].
Vi anser att denna gräns kan sänkas till 350 nmol/l vid mätning med de kortisolbestämningsmetoder som för närvarande används på svenska sjukhuslaboratorier. Som stöd för detta har ett morgonkortisolvärde över ca 350 nmol/l mätt med Abbott Architect-metoden och Siemens Advia Centaur-metoden visats förutsäga en tillfredsställande kortisolrespons vid Synacthen-test [15].
Till detta ska läggas att kortisolkoncentration 400 nmol/l uppmätt med den tidigare Roche-metoden motsvarar en nivå <350 nmol/l med de metoder som nu används vid svenska sjukhuslaboratorier.
Felkällor vid tolkning av kortisol i plasma
Tolkning av morgonkortisol förutsätter att patienten har normal dygnsrytm. Graviditet och östrogenbehandling leder till högre kortisolkoncentrationer i plasma på grund av ökad mängd bindarprotein. Hos kvinnor som behandlas med östrogeninnehållande p-piller ökar vanligen kortisolkoncentrationen i plasma efter Synacthen-test till nivåer ≥600–700 nmol/l [9].
Andra felkällor att beakta är att de nuvarande immunkemiska mätmetoderna inte är helt specifika för kortisol. Behandling med en del syntetiska glukokortikoider, främst prednisolon, leder till falskt hög kortisolkoncentration på grund av korsreaktioner [16]. Falskt hög kortisolkoncentration i plasma till följd av korsreaktioner med steroidmetaboliter kan även ses vid svår njursvikt, svår leversjukdom, genetiskt orsakade enzymdefekter i binjuren (kongenital binjurebarkshyperplasi) och steroidsynteshämning med metyrapon [4, 16].
Konsensus saknas om vilka nivåer som säkert utesluter binjurebarkssvikt vid svår sjukdom/stress och kraftig systemisk inflammation. De gränser för kortisolkoncentrationer som omtalas här gäller vuxna patienter.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Göran Brattsand ingår i Equalis expertgrupp för endokrinologi.























