Strategin att använda polypiller för primär prevention av kardiovaskulär sjukdom har lanserats för att förenkla läkemedelsbehandling. Studier i Iran samt internationellt (TIPS-3) har visat en preventiv kardiovaskulär effekt jämfört med placebo, tillsammans med eller utan ASA.
Fördelar med polypiller kan innefatta förenklad terapi, minskad belastning på sjukvården samt en möjlighet för globala insatser mot hjärt–kärlsjukdomar, medan nackdelar kan vara svårigheter att härleda eventuella biverkningar till enskilda farmakologiska komponenter.
Ett försök med polypiller för utvalda patientgrupper eller befolkningar i Sverige kan tänkas men bör utvärderas för acceptans, tolerans och kostnadseffektivitet.
Fortfarande kan högriskpatienter kräva en mer individanpassad behandlingsstrategi baserad på strävan att uppnå målvärden och optimal dos av läkemedel med bevisad effekt.
Trots betydande landvinningar är hjärt–kärlsjukdom en globalt dominerande dödsorsak (ca 18 miljoner fall/år) och orsak till många förlorade kvalitetsjusterade levnadsår. Flertalet fall inträffar i låg- och medelinkomstländer. I Europa har en tidigare nord–sydlig hjärt–kärlsjukdomsgradient bytts mot en väst–östlig, med hög prevalens i forna Sovjetunionens befolkningar. De höga dödstalen och den ojämlika fördelningen av hjärt–kärlsjukdom är inte opåverkbara. Förebyggande åtgärder, rökstopp samt blodtrycks- och kolesterolsänkning minskar förekomsten. Adderar man terapeutiska framsteg når man än längre. Ett svenskt exempel är att en tredjedel av minskningen av antalet hjärt–kärldödsfall under perioden 1986–2002 var relaterad till behandlingsframsteg, medan förebyggande av riskfaktorer (fysisk inaktivitet, rökning, högt blodtryck och kolesterol) bidrog med två tredjedelar, det vill säga hade stor betydelse [1]. Liknande data har presenterats från ett flertal länder [2]. För att nå framgång i det förebyggande arbetet behövs såväl insatser riktade till medel- och högriskindivider som folkhälsoarbete för att med bland annat tobaksskatt och livsstilsåtgärder främja kardiovaskulär hälsa. Det senare, i syfte att hindra eller i vart fall senarelägga sjukdomsdebuten genom en populationsbaserad, preventiv strategi, är inte minst viktigt. En sådan strategi har fördelar genom att på ett kostnadseffektivt sätt (utan screening och läkemedel) påverka sjukdomens orsaker och nå alla jämlikt. Detta är dock inte problemfritt eftersom det kräver politiska ingripanden samt skattelagstiftning och även kan »drabba« personer med mycket låg sjukdomsrisk [3].
Vad gäller individuell riskfaktorscreening och behandling finns regelbundet uppdaterade svenska och internationella riktlinjer. Många av dessa berör personer som redan har drabbats av en hjärt–kärlhändelse eller tillhör en grupp med mycket hög risk. Totalt sett kommer dessa, lyckligtvis relativt få, individer enligt den så kallade Roses paradox [4] att ha stor nytta av förebyggande åtgärder i form av livsstilsförbättringar och medicinska insatser. Detta återspeglas dock inte i en allmänt förbättrad folkhälsa. För det krävs att det stora antal personer som lever med lätt till måttligt ökad risk, eller mer utvecklad men oupptäckt sådan, blir föremål för/accepterar förebyggande åtgärder. Som framgått kan man framgångsrikt arbeta för en bättre folkhälsa med icke-medicinska metoder. Dessa är dock ofta, och kanske speciellt i vissa delar av världen, otillräckliga genom att inte nå den aktuella målgruppen.
Ett nytt sätt att angripa detta preventionsproblem är ett så kallat polypiller (polypill), som i en tablett eller kapsel innehåller flera läkemedel i en fast kombination. Idén lanserades ursprungligen av den brittiske epidemiologen Nicholas Wald och medarbetare 2003 [5]. I deras förslag innehöll polypillret antihypertensiva läkemedel, acetylsalicylsyra (ASA) samt vitaminer. Förslaget väckte stor uppmärksamhet inte minst i medier, och debattens vågor gick höga när kritiker bland annat anmärkte på att den vanligtvis förekommande dostitreringen sattes ur spel, att eventuella biverkningar kunde vara svåra att härleda till någon av komponenterna i en fast läkemedelsberedning och att uppställda målvärden för riskfaktorkontroll inte beaktades. Som förväntat hade även läkemedelsindustrin och myndigheterna synpunkter. Konceptet var inte evidensbelagt i randomiserade kliniska prövningar och beredningsformen inte testad rent farmakologiskt.
Förespråkare för polypillret fanns också. En av dem var den mycket namnkunnige kardiologen Salim Yusuf, född i Indien men numera verksam i Kanada. Han hävdade att strategin är nödvändig och väl lämpad för hjärt–kärlprevention, inte minst i utvecklingsländer, och startade vetenskapliga test. Nu finns två nyligen publicerade storskaliga randomiserade studier, vilka bägge stöder strategin även om vissa aspekter kräver en kritisk diskussion. Den så kallade PolyIran-studien publicerades 2019 [6] och följdes 2020 av TIPS-3 [7, 8].
PolyIran-studien
I studien randomiserades 6 838 individer med lätt till måttligt förhöjd kardiovaskulär risk till antingen behandling med polypiller och förbättrad livsstil eller endast livsstilsåtgärder [6]. Det fanns således ingen placeboarm. I polypillret ingick hydroklortiazid 12,5 mg, ASA 81 mg, atorvastatin 20 mg och enalapril 5 mg. Vid hosta som biverkan byttes enalapril ut mot valsartan 40 mg. Medelföljsamheten till polypillerbehandlingen var 80 procent. Resultaten angav klinisk nytta, och detta har tagits till intäkt för värdet av polypiller. Under uppföljningstiden fick 202 (5,9 procent) av 3 421 deltagare i polypillergruppen en hjärt–kärlhändelse (akut koronart syndrom, hjärtinfarkt, plötslig död, hjärtsvikt, kranskärlsingrepp eller fatal eller icke-fatal stroke) jämfört med 301 (8,8 procent) av de 3 417 deltagarna i kontrollgruppen (justerad hazardkvot [HR] 0,66; 95 procents konfidensintervall [95KI] 0,55–0,80).
En europeisk patientgrupp kanske hade varit mer känslig för ASA-komponenten i detta polypiller, varför resultaten inte utan vidare kan översättas till en svensk kontext.
TIPS-3-studien
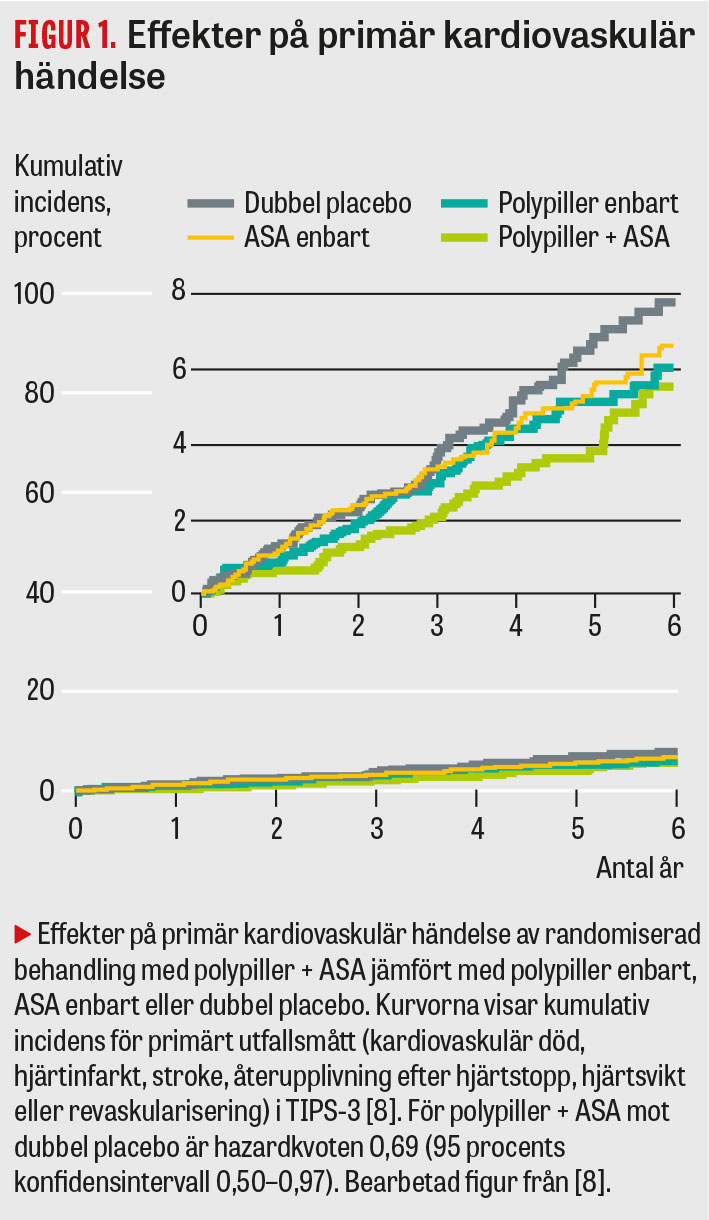
Den andra stora studien är TIPS-3 (International polycap study 3) [7], som nyligen publicerat resultat [8]. I denna internationella studie, under ledning av Salim Yusuf, rekryterades 5 713 individer med måttligt förhöjd kardiovaskulär risk, främst från Indien och Filippinerna men även från en rad andra länder. Primärt utfallsmått var kardiovaskulär död, hjärtinfarkt, stroke, återupplivning efter hjärtstopp, hjärtsvikt eller revaskularisering [7].
Deltagarna randomiserades i en faktoriell design (2 × 2 × 2) till behandling med antingen polypiller, ASA eller D-vitamin som aktiva komponenter eller matchande placebo i ett flertal kombinationer. D-vitaminresultaten har ännu inte redovisats. Däremot rapporterades resultaten för polypiller mot placebo respektive polypiller + ASA (75 mg) mot placebo [8]. I polypillret fanns tre olika blodtryckssänkande substanser samt en statin (atenolol 100 mg, hydroklortiazid 25 mg, ramipril 10 mg samt simvastatin 40 mg). Den genomsnittliga uppföljningstiden var 4,6 år.
Biverkningarna var vanligtvis lindriga, huvudsakligen yrsel och blodtrycksfall hos en del individer i polypillergruppen, utan ökning av allvarliga mag–tarmblödningar (polypillergruppen 9, placebogruppen 12).
Förekomsten av den primära kardiovaskulära utfallsvariabeln var lägre i polypiller- än i placebogruppen både med och utan tillägg av ASA i den aktiva gruppen (Figur 1) [8]. En primär händelse drabbade 126 (4,4 procent) av patienterna med bara polypiller jämfört med 157 (5,5 procent) av patienterna i placebogruppen (HR 0,79; 95KI 0,63–1,00). Motsvarande utfall för gruppen med endast ASA mot placebo var 116 (4,1 procent) mot 134 (4,7 procent) (HR 0,86; 95KI 0,67–1,10). För gruppen med kombinationen polypiller + ASA mot gruppen med dubbel placebo blev utfallet tydligt signifikant, 59 (4,1 procent) mot 83 (5,8 procent) (HR 0,69; 95KI 0,50–0,97).
De sammantagna resultaten har ansetts ge ett starkt stöd för att använda polypiller hos individer med måttlig förhöjd hjärt–kärlrisk. Bland invändningar har angetts att studien dominerades av asiatiska patienter (85 procent), att man hade en inkörningsperiod som sållade bort individer med dålig tolerans eller följsamhet, att det var många som avbröt studien trots inkörningsperiod samt att genomsnittliga effekter på blodtryck och LDL-nivåer var lägre än förväntat.
En polypillerstrategi har föreslagits i inte minst länder med befolkningar präglade av fattigdom, utsatthet och sociala belastningar, till exempel ursprungsbefolkningar [9, 10].
Finns en framtid för polypiller i Sverige?
Hur ska man då se på evidensen för polypiller i vårt land? Det går inte att utan vidare översätta resultaten av de beskrivna studierna till svenska förhållanden på grund av skillnader i etnicitet, riskfaktorpanorama, livsstil, sociala förhållanden samt hälso- och sjukvårdens struktur. Det kan dock vara värt att diskutera om en polypillerstrategi skulle kunna underlätta förebyggandet av hjärt–kärlsjukdomar i vissa definierade patientgrupper med måttlig riskökning. Den målstyrda behandlingsstrategin, med stöd av riktlinjer, bör definitivt kvarstå för patienter med hög risk och komplicerade sjukdomstillstånd där flera organsystem är drabbade.
En intressant fråga är hur ett tänkt svenskt polypiller skulle kunna vara designat och om ett sådant rentav skulle kunna göras fritt tillgängligt på apotek för personer med hjärt–kärlsjukdom i familjen eller suboptimal livsstil eller för utsatta personer som helst inte besöker hälso- och sjukvården. I England är simvastatin 40 mg receptfritt sedan 2004 [11]. Förslaget kan vid en första anblick te sig kontroversiellt, men skulle kunna avlasta primärvårdens läkare från många konsultationer med förment friska individer som enbart har riskfaktorbelastning. En annan fråga, hittills inte belyst, är om en komponent som motverkar uppkomst av diabetes bör finnas med, åtminstone hos därtill benägna personer. Är det inte dags att genomföra en svensk studie för att skapa ökad evidens och bedöma värdet av polypiller i vårt eget land?
Potentiella bindningar eller jävsförhållanden: Peter M Nilsson har deltagit i utbildningsaktiviteter i regi av läkemedelsföretag verksamma inom kardiovaskulär medicin samt i kliniska prövningar av diabetesläkemedel och även med expertsynpunkter i referensgrupper för Sanofi, Boehringer Ingelheim, Novo Nordisk och Novartis. Han har haft uppdrag för International Society of Hypertension (ISH) och World Hypertension League (WHL). Lars Rydén har deltagit i utbildningsaktiviteter i regi av läkemedelsföretag verksamma inom kardiovaskulär medicin samt i kliniska prövningar av diabetesläkemedel samt anlitats av olika läkemedelsföretag som expert och föreläsare inom och utom landet.