Mavacamten är ett nytt läkemedel som selektivt hämmar enzymet myosin-ATPas i hjärtmuskelceller, vilket undertrycker bindningen mellan aktin och beta-myosin.
Fas 2-studier hos patienter med HCM utan utflödesobstruktion har visat minskning av NT-proBNP och troponin I som uttryck för avtagande väggstress.
Fas 3-studier hos patienter med HCM med utflödesobstruktion har visat sänkning av utflödesgradienten, förbättrad funktionsförmåga och förbättrad livskvalitet.
Mavacamten är ett banbrytande läkemedel som förväntas bli ett värdefullt tillskott i behandlingen i utvalda fall av hypertrofisk kardiomyopati.
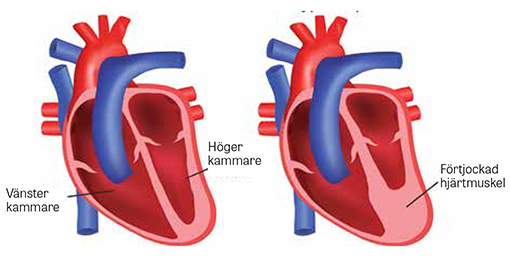
Hypertrofisk kardiomyopati (HCM) innebär en sjuklig förtjockning av hjärtmuskeln som inte enbart kan förklaras av hemodynamisk belastning som vid till exempel hypertoni eller klaffsjukdom [1]. Den rapporterade förekomsten varierar, men skattas ofta till 1 fall per 500 individer i den vuxna befolkningen [2]. Drygt hälften av fallen är ärftliga och förklaras av mutationer i gener som styr sarkomerernas uttryck (mestadels MYBPC3 och MYH7) [1, 2]. Hypertrofin är ofta asymmetrisk med dominerande engagemang av septum, varvid utflödesobstruktion i vänster kammare kan uppstå, men varianter med apikal utbredning förekommer. Hos vuxna indikerar en septumtjocklek ≥15 mm hypertrofisk kardiomyopati, men 13 mm kan räcka för diagnos om sjukdomen finns i släkten [2]. Diagnosen ställs oftast med ekokardiografi, men hos svårundersökta patienter kan undersökning med magnetkamera behövas, vilket även erbjuder nödvändig tilläggsinformation avseende förekomst av myokardiell fibros.
Nedärvningsmönstret är i de flesta fall autosomalt dominant med inkomplett åldersrelaterad penetrans, vilket innebär att sjukdomen varierar påtagligt mellan individer och över tid. Vissa personer förblir asymtomatiska livet ut medan andra utvecklar olika grader av andfåddhet, bröstsmärta, palpitationer, yrsel och svimning. Ungefär en tredjedel har betydelsefull utflödesobstruktion (≥30 mm Hg) under vilobetingelser och ytterligare en tredjedel vid fysisk ansträngning, vilket förklarar en del av symtomen. Förmaksflimmer är vanligt, och plötslig död till följd av ventrikulära arytmier förekommer. Även hjärtsvikt kan uppstå i sent stadium.
Farmakologiskt förstahandsval utgörs av betablockerare i syfte att åstadkomma negativ inotrop effekt, men även kalciumflödeshämmare och i enstaka fall disopyramid har använts [1, 2]. Hos patienter med symtomgivande utflödesgradient (≥50 mm Hg) som inte svarar på medicinsk behandling kan kirurgisk intervention i form av myektomi eller septal alkohol-ablation ge god symtomlindring [1, 2]. Vid ökad risk för livshotande arytmier utgör implanterbar kardiell defibrillator hörnstenen i behandlingen. Pacemaker med apikal kammarpacing kan minska utflödesgradient och vara ett alternativ hos äldre.
Hitintills har sjukdomsspecifik läkemedelsbehandling för hypertrofisk kardiomyopati saknats. Mavacamten är ett läkemedel som riktar sig direkt mot sjukdomens underliggande patofysiologiska mekanism. Preparatet har uppvisat gynnsamma effekter i kliniska studier hos patienter med hypertrofisk kardiomyopati och innebär ett epokgörande farmakologiskt framsteg mot sjukdomen.
Mavacamten vs placebo
EXPLORER-HCM är en dubbelblindad randomiserad kontrollerad fas 3-studie där 251 patienter behandlades med mevacamten eller placebo (1:1) under 30 veckor i tillägg till betablockerare eller kalciumflödeshämmare [3]. Medelåldern uppgick till 59 år, och 41 procent av deltagarna var kvinnor. Huvudsakliga inklusionskriterier utgjordes av utflödesgradient ≥50 mm Hg, med bibehållen ejektionsfraktion och nedsatt funktionsförmåga (NYHA-klass II–III). Patienter med tidigare synkope eller ihållande ventrikulära arytmier exkluderades. Primärt utfall var en komposit av ≥1,5 ml/kg/min ökning i maxi-mal syretransportförmåga (VO2-max) och ≥1 minskning i NYHA-klass, eller ≥3,0 ml/kg/min stegring av VO2-max jämfört med utgångsläget. Viktiga sekundära utfall inkluderade ändringar i utflödesobstruktion och hälsorelaterad livskvalitet.
Patienter som erhöll aktiv behandling uppnådde det primära utfallet i 36,6 procent av fallen, medan motsvarande andel i placebogruppen var 17,2 procent (P < 0,001). Den subvalvulära gradienten sjönk signifikant i mavacamtengruppen som också uppvisade större förbättring i KCCQ-CSS (Kansas City cardiomyopa-thy questionnaire – the clinical summary score) och HCMSQ-SoB (HCM symptom questionnaire – shortness of breath). Mavacamten tolerades väl, och förekomst av biverkningar skilde sig inte signifikant mellan grupperna, men ett observandum var förlängning av QTc (korrigerad QT-tid) hos några patienter och minskning av ejektionsfraktion till under 50 procent hos 9 patienter, 7 av 123 i mavacamtengruppen (5,7 procent) och 2 av 128 (1,6 procent) i placebogruppen.
Diskussion
Mavacamten är en selektiv hämmare av enzymet myosin-ATPas, vilket medför minskad kontraktilitet och optimering av energianvändningen i myocyterna samt korrigering av hemodynamiska störningar i djurmodeller [4]. I fas 2-studien PIONEER-HCM sågs minskad utflödesobstruktion, ökad maximal syreupptagningsförmåga samt minskad symtombörda [5].
I en substudie av EXPLORER-HCM sågs gynnsam effekt av mavacamten avseende remodellering uttryckt som indexerad vänsterkammarmassa, maximal tjocklek och indexerad vänster förmaksvolym vid undersökning med magnetkamera. Däremot sågs ingen skillnad avseende fibrostecken mellan grupperna, vilket inte var att vänta med tanke på långsam sjukdomsprogress och uppföljningstiden för studien [6].
Sammantaget finns en god patofysiologisk grund för läkemedlets effektivitet men också kliniskt relevanta utfallsmått, vilket kunde bekräftas i EXPLORER-HCM. Att det förelåg signifikant skillnad till mavacamtens fördel genom flera olika utfallsmått stärker evidensen för nyttan som kliniskt användbar behandling.
Det bör dock noteras att inklusionskriterierna medför en begränsning vid bredare användning. Patienterna var välbehandlade: 92 procent hade betablockad eller kalciumkanalblockerare [3]. Det är uppenbart att behandlingen var effektiv, uttryckt som NYHA I och utflödesgradienten <30 mm Hg, hos 27 procent av de som behandlades med mavacamten, men enbart 1 procent hos de som fick placebo [3]. Behandlingen skulle då vara ett alternativ till intervention med myektomi eller alkoholablation, åtminstone kortsiktigt. Läkemedlet studerades inte hos HCM-patienter med lindrig eller ingen obstruktion, och användningen bör tills vidare begränsas till de som uppfyller inklusionskriterierna från studien. Däremot vore läkemedlet synnerligen intressant att studera i en större grupp utan obstruktion; en mindre studie (n = 59) visade signifikant minskning av NT-proBNP och troponin [7]. Fram till dess begränsas generaliserbarheten. Vidare behöver användningen av läkemedlet följas noga över tid för att se långtidseffekter, och eventuella biverkningar som är ovanliga kan knappast påvisas i studier med få deltagare. Uppföljande studier pågår [8]. Det vore också särskilt intressant att se effekten på yngre patienter och huruvida läkemedlet kan bromsa sjukdomsutvecklingen. Inte desto mindre utgör mavacamten ett potentiellt värdefullt tillskott i arsenalen vid behandling av hypertrofisk kardiomyopati. Därför ser vi med tillförsikt fram emot hur läkemedlet kommer att värderas av vetenskapliga organisationer och myndigheter.
Potentiella bindningar eller jävsförhållanden: Peter Magnusson har erhållit föreläsningsarvode eller forskningsmedel från Abbott, Alnylam, Amicus Therapeutics, Astra Zeneca, Bayer, Boehringer Ingelheim, Bonnier, Internetmedicin, Lilly, MSD, Novo Nordisk, Octopus Medical, Orion Pharma, Pfizer, Vifor Pharma och Zoll. Kristjan Karason har erhållit föreläsningsarvode från Orion Pharma, Abbott Medical, Vifor Pharma, Novo Nordisk och Boehringer Ingelheim.
(uppdaterad 2021-08-11)