Utanför CNS genererar kapsaicinreceptorn TRPV1 – chilipepparreceptorn – smärtsignaler vid vävnads- och nervskada.
TRPV1-antagonister utanför CNS orsakar hypertermi och oförmåga att känna skadlig värme.
TRPV1 i hjärnan är ett möjligt mål för läkemedelsbehandling av perifert utlöst smärta samt olika sjukdomar och tillstånd i hjärnan som epilepsi, oro och ångest.
Nobelpriset i fysiologi eller medicin tilldelades i år David Julius och Ardem Patapoutian för deras upptäckter av receptorer för temperatur och beröring. David Julius använde det irriterande kemiska ämnet kapsaicin i chilipeppar för att isolera kapsaicinreceptorn TRPV1 från smärtnervtrådarnas cellkroppar [1]. TRPV1 blev också ett svar på frågan hur människan på molekylär nivå känner av smärtframkallande temperaturer över 43 °C [1]. Denna upptäckt har också lett till att flera andra TRP-kanaler (transienta receptorpotentialkanaler) är identifierade som temperaturreceptorer [2, 3]. Läkemedelsindustrin hade redan tagit fram TRPV1-antagonisten kapsazepin [4] och fick nu extra skjuts i utvecklandet av läkemedel för att selektivt lindra smärta orsakad av vävnadsskada eller nervskada i perifera vävnader och organ [3]. Tyvärr övergick entusiasm i besvikelse när det visade sig att TRPV1-antagonister i människa framkallade hypertermi och ökade risken för brännskador, då förmågan att känna skadligt varma temperaturer var satt ur spel. Nya resultat tyder på att det kanske ändå går att ta fram en TRPV1-antagonist som inte har dessa biverkningar, men att det då blir ett smärtläkemedel med begränsad användning [3, 5]. Intresset är nu fokuserat på vitlöksreceptorn TRPA1, som till stor del är samlokaliserad med TRPV1 i perifera smärtnerver [3]. Hämning av TRPA1 påverkar inte kroppstemperaturen eller förändrar normal värmekänslighet, vilket bidrar till att TRPA1 är ett lovande målprotein för smärtläkemedel [3]. Ardem Patapoutian, som var först med att identifiera TRPA1 i smärtnerver, letade efter tryckreceptorer och upptäckte en ny klass av jonkanaler, PIEZO1 och PIEZO2, som känner av beröring och tryck huvudsakligen utanför smärtsinnet [6].
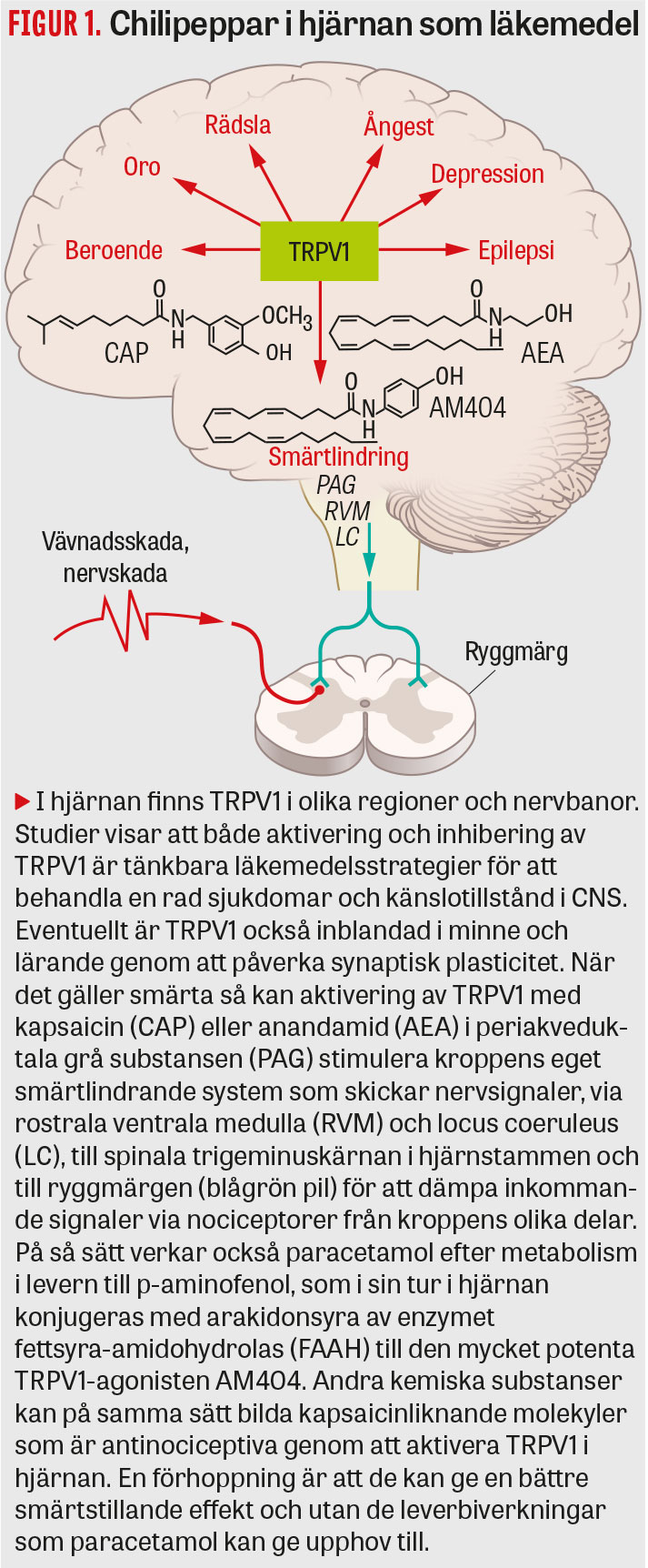
Tidigt efter upptäckten av TRPV1 började man att kartlägga receptorn i kroppen. TRPV1 kunde påvisas i hjärnan, men med en annan roll än att känna lokal smärta eller skadlig värme [7] (Figur 1). Även om nivån av TRPV1 i hjärnan är lägre än i periferin så åstadkommer man tydliga effekter på nervsignalering och beteende i djurstudier genom att stimulera eller inhibera TRPV1 i CNS [7]. Exempelvis stimulerar kapsaicin nedåtgående smärtmodulerande nervbanor som blockerar aktiviteten i nociceptiva primära afferenter.
Kort efter att TRPV1 hade identifierats 1997 visades att anandamid och liknande N-acyletanolaminer är kroppens egen chilipeppar – endovanilloider – som likt kapsaicin aktiverar TRPV1 [8]. Med hjälp av kryoelektronmikroskopi, som visar TRPV1-strukturer i hög upplösning, kan man se att kapsaicin och endovanilloider binder till samma del av TRPV1 [9]. Intressant är att anandamid i fysiologiskt relevanta koncentrationer sänker temperaturtröskeln för aktivering av TRPV1 från 43 °C till under 37 °C [10], vilket styrker att endovanilloider har en viktig fysiologisk roll genom att finjustera TRPV1-medierad nervaktivitet. En annan endocannabinoid, 2-arakidonylglycerol, verkar också på TRPV1. När man hindrar dess nedbrytning i hjärnan är 2-arakidonylglycerol antinociceptivt via aktivering av TRPV1 [11]. Anandamid och 2-arakidonylglycerol har länge ansetts vara viktiga signalsubstanser i hjärnan, och deras koppling till TRPV1 är därför av stort intresse. Det kan vara så att CNS signalering, som tidigare antagits vara cannabinoidreceptor 1-medierad, i själva verket är helt eller delvis beroende av TRPV1. Det öppnar för att utveckla läkemedel som verkar på TRPV1 i hjärnan för behandling av till exempel beroende, oro, ångest, depression, epilepsi och dyskinesier [7, 12-14] (Figur 1). Upptäckten av en ny metabolismväg för paracetamol som bildar kapsaicinliknande molekyler i hjärnan, även hos människa [15], och är antinociceptiva genom att aktivera TRPV1 [16] är ytterligare bevis på att TRPV1 i hjärnan är ett intressant målprotein för läkemedelsbehandling. Kanske är det också mekanismen bakom paracetamols möjliga effekter på oro, ångest och social smärta [17, 18].
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.