Här sammanfattas några nyckelobservationer i Vetenskapsrådets utredning av stödstrukturer för svensk klinisk forskning:
- Utvecklingen mot precisionsmedicin ger nya möjligheter.
- Kraven för införande av ny medicinsk apparatur behöver tydliggöras.
- Det finns ett stort behov av mötesplatser mellan innovation och sjukvård.
- Forskning/utveckling uppfattas inte vara en del av sjukvårdens kärnverksamhet, men samtliga intervjuade är positiva till att bidra.
Stundtals hävdas att svensk klinisk forskning befinner sig i utförsbacke, framför allt baserat på ett sjunkande antal företagsinitierade kliniska läkemedelsprövningar [1, 2]. Detta budskap står dock i strid med slutsatserna i en utredning från 2018, initierad av Vetenskapsrådet (VR), där man bedömer att svensk explorativ klinisk forskning håller mycket hög kvalitet [3]. Sjukvården står sedan länge under hård ekonomisk press, och Läkarförbundet och Sveriges yngre läkares förening har uttryckt stark oro över en sjunkande andel forskarutbildade läkare [4].
Som underlag för forskningspropositionen initierade VR 2020 en granskning av stödstrukturer för klinisk forskning i Sverige [5]. Uppdraget gick till Henrik Sjövall, som i sin tur valde bland andra medförfattarna till denna artikel som rådgivare och samarbetspartner. Vi summerar här några nyckelfynd och ger en samlad och nyanserad bild av dagens situation.
Liknande utredningar har gjorts tidigare [6, 7] och har lett till uppbyggnaden av dagens stödstruktur:
- Sex noder knutna till universitetssjukhusen och med uppdrag att stödja klinisk forskning.
- En nationell strategisk styrgrupp inom VR (Kliniska studier).
- En beredningsgrupp inom VR med föreskriven representation av sjukvårdshuvudmännen (Kommittén för klinisk behandlingsforskning, KKBF).
- Det nationella Life science-kontoret, med ett riktat uppdrag att interagera med näringslivet.
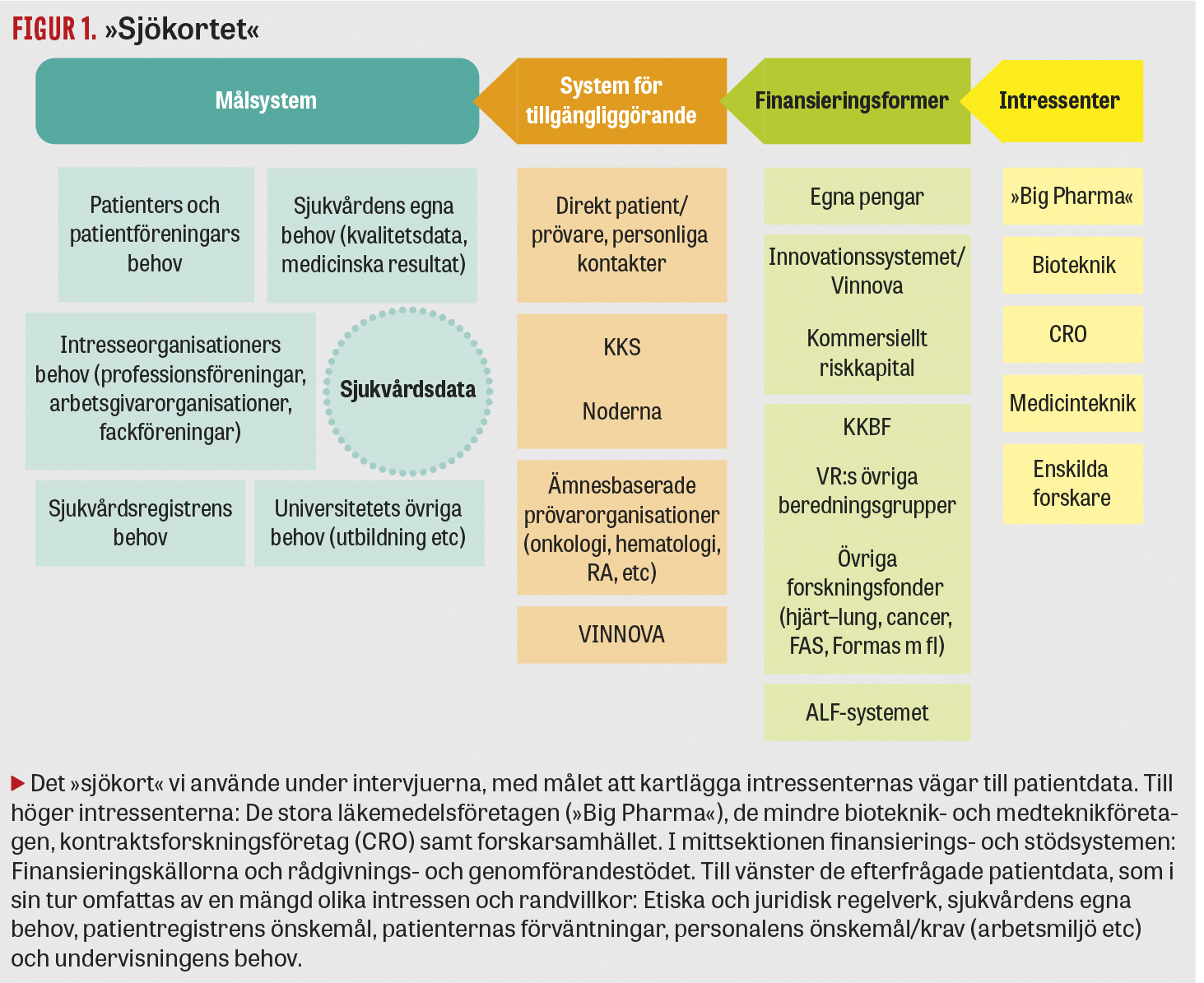
Fynden i vår VR-utredning summerades av pedagogiska skäl i ett enkelt »sjökort« (Figur 1) med grundstrukturen: intressenter till höger, finansieringsformer och stödsystem i mittsektionen och målsystemet (tillgång till patientdata) till vänster.
Kartläggningen gjordes enligt anvisning i utredningsdirektivet med kvalitativ metod baserad på ett relativt stort antal intervjuer med av VR förordade representanter för olika aktörer i systemet, följt av fältanalys:
- Företrädare för ett fåtal stora läkemedelsföretag och intresseorganisationer för bioteknik- och medteknikföretag.
- Ordförandena i styrgruppen Kliniska studier och KKBF samt företrädare för VR:s beredningsorganisation och Vinnova.
- Representanter för sjukvård: ledningssystemsföreträdare, FoU-direktörer, nodföreståndare, föreståndare för icke-nodassocierade prövarnätverk och representanter för patientorganisationer samt några stora fackliga organisationer.
- Representanter för universitet: dekangruppen.
En representant för VR, Marika Hellqvist-Greberg från VR:s enhet för kliniska studier, var utöver utredaren själv närvarande vid samtliga intervjuer. Dessa gjordes av covidskäl via länk, men spelades inte in. Ett antal av svaren redovisas i en bilaga till den slutliga rapporten (sidorna 18-58) [5].
Vi vill inleda med att nyansera vad som faktiskt efterfrågas av de stora läkemedelsföretagen. Det fanns en tid då Sverige ledde jättelika fas III-studier på syntetiska »småmolekyler«. Exempel på detta är framtagandet av metoprolol och omeprazol. Den typen av studier är numera i princip alltid multinationella, och Sverige är helt enkelt ett för litet land för att inneha en nyckelposition. Vårt system med nivåstyrning (stat–region–kommun) gör dessutom att vi i princip aldrig kan lova breddinförande av ett läkemedel, även om studien skulle visa positiva resultat. Detta blir viktigt, eftersom utvecklingen går allt mer i riktning mot krav på post-registreringsdata (»real world data«) [8], det vill säga det som händer när läkemedlet väl är godkänt. Om läkemedlet då inte används i huvudprövarens hemland väcker det förundran.
Detta behöver dock inte betyda att Sverige är ute ur leken. Nya syntetiska småmolekyler börjar bli relativt ovanliga, medan en stark utveckling sker inom fältet biologiska läkemedel, exempelvis monoklonala antikroppar, och då särskilt inom onkologi. Här inleder man test på en avgränsad patientgrupp där man kan förvänta sig goda effekter, för att sedan stegvis vidga indikationen till allt större grupper. Det man som regel eftersträvar är en molekylärt mycket väl karakteriserad patientgrupp, vilken man sedan kan följa över tid (precisionsmedicin) och utan att data saknas. Just detta har Sverige goda förutsättningar att bidra med.
Här anges ett strukturellt problem – företagen uppfattar att det är svårt att få klara besked om villighet att ta ansvar för denna typ av studier. Det tar helt enkelt för lång tid att få besked. Onödiga tidsutdräkter är kostsamma för läkemedelsföretagen, och för lång tid till besked riskerar att uppdraget går till andra aktörer.
Det finns dock ljuspunkter. Det senaste analyserade året (2021) bröts den sjunkande trenden vad gäller ansökningar om läkemedelsprövningar, då antalet ansökningar med icke-kommersiell sponsor ökade från 140 till 193 [1]. Det kan dock inte uteslutas att detta berodde på covid-19-pandemin.
Ett andra intervjutema rörde problem identifierade av medicinteknikindustrin och närliggande entreprenörsbranscher. Man efterlyser större klarhet vad gäller sjukvårdens krav för införande av ny apparatur. Regelverket för läkemedelsdokumentation är mycket väl genomarbetat, men vad gäller medicinteknisk apparatur behöver någon patientnytta förbluffande nog inte visas. Detta håller dock nu på att ändras, både inom EU [9] och i Sverige [10].
Sveriges innovationssystem bedöms vara av högsta internationella klass [11]. Involverade entreprenörer framför ett starkt önskemål om bättre kontakter och samarbete med sjukvårdssystemet. Ett exempel där detta har fungerat väl är de tandimplantat och proteser som utvecklats genom gruppen runt Per-Ingvar Brånemark i Göteborg. I andra fall går det dock trögt. Många sjukvårdsanställda med idéer vill vara kvar i vården, medan personer i entreprenörsvärlden inte alltid förstår sjukvårdens spelregler. Goda exempel är de entreprenörs-ST-block som har startats i Göteborg, där utveckling är en del av utbildningen och i princip likställs med klinisk tjänstgöring [12]. Ett annat exempel är de entreprenörsutbildningar som finns på flera platser i landet och där studenter med olika bakgrund (exempevis juridik, teknik, hälso- och sjukvård, konst) tillsammans med personal genomför utvecklingsprojekt inne i själva sjukvårdssystemet.
Vilka är då hindren? Regelverket kring införande av nya tekniker är som ovan nämnts oklart, och det behöver reformeras i riktning mot det som gäller inom läkemedelsbranschen. Någon typ av krav på effekt (här uttryckt som patientnytta) ses som självklart. En ingång kan vara att svensk vård skapar tydlighet och systematik kring upptag och utvärdering av innovation inom vården, en komponent i det vi kallar evidensbaserad vård. Här finns dock ett problem: att ta fram dokumentation tar tid, och utvärdering i form av så kallade HTA-utredningar är också kompetens- och tidskrävande. Vi måste hitta vägar att påskynda dessa processer, och även möjliggöra att små utvecklingsbolag utan de stora läkemedelsföretagens resurser kan få stöd i dessa utredningar.
Det tredje – och troligen viktigaste – problemet uppfattas vara att forskning och utveckling inte anses utgöra »kärnverksamhet« i sjukvården, utan ses som något man får ägna sig åt antingen på »lediga stunder« [4] eller på ALF-finansierad tid. Sjukvården är som bekant under hård ekonomisk press, och vid sviktande produktion upplevs att FoU nedprioriteras [4]. Vi anser att det i hälso- och sjukvårdslagen bör skrivas in en skyldighet (»skall«) för både sjukhusvård och primärvård att delta i klinisk forsknings- och utvecklingsverksamhet (inklusive läkemedelsstudier) och att detta delfinansieras med synliggjorda medel. Sverige lägger i dag 3–4 procent av BNP på forskning/utvecklingsarbete [13], och kanske kan detta vara ett rimligt riktmärke även för sjukvårdssystemet?
Glädjande nog var det under nästan tre dussin intervjuer ingen som sa »Vi vill inte«. Alla intervjuade uttryckte att de vill bidra, men de upplever att de inte har några förutsättningar att syssla med detta i sin vardag, vilket bekräftas av Läkarförbundets medlemsenkät [4]. Även representanter för patientföreningarna uttrycker en positiv inställning: »Det är klart att vi vill vara med och utveckla vården! Och kanske ibland även kan få berätta för er vad ni skall mäta, ibland mäter ni nämligen fel saker!«
Sverige borde, med sitt personnummersystem, sitt förhållandevis sammanhållna sjukvårdssystem och sin starka entreprenörskultur, kunna ta täten i utvecklingen mot precisionsmedicinbaserad klinisk forskning. Och som en viktig markering i den riktningen har nu VR – baserat på ett delförslag i vår utredning – tillsatt en huvudsekreterare för klinisk forskning som får i uppgift att utveckla stödstrukturer och att anpassa dessa till de nya spelreglerna.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.