Trots att sambandet mellan diabetes och kognitiv nedsättning upptäcktes för 100 år sedan är denna diabeteskomplikation fortfarande relativt okänd.
Fysisk aktivitet har i vissa studier visats reversera såväl insulinresistens i hjärnan som kognitiv nedsättning och patologisk aptitreglering.
Dessutom har bl a intranasalt insulin och GLP-1 (glukagonlik peptid 1)-receptoragonister i vissa studier visat positiva resultat för kognitiv förmåga.
Kopplingen mellan hjärnan och diabetes har varit känd sedan 1855, då den franske fysiologen Claude Bernard upptäckte att diabetes kan framkallas genom att experimentellt skada botten på fjärde ventrikeln hos kaniner [1]. I dag vet vi att specifika regioner i centrala nervsystemet (CNS) har glukoskänsliga neuron [2] och att centralt verksam glukos direkt påverkar blodflöde och funktion hos de insulinproducerande betacellerna i pankreas [3].
Det är välkänt att såväl typ 1- som typ 2-diabetes är förknippade med ökad risk för makroangiopatiska sena komplikationer i CNS, såsom ischemisk stroke. Diabetes är också associerad med ökad risk för såväl perifer som central neuropati. Det senare är inte lika välkänt, trots att det redan 1922 visades att diabetes är starkt associerad med prematur kognitiv nedsättning [4].
Kognitiv nedsättning är överrepresenterad vid diabetes och prediabetes [5-13]. Den kognitiva nedsättningen medför också flera viktiga diabetesspecifika implikationer: förmågan till egenvård (kost, motion m m) och förståelsen av dess betydelse kan påverkas negativt. Detsamma gäller egenmonitorering av glukos samt följsamhet till läkemedelsordinationer och dosjusteringar av insulin.
Etiologi och patogenes
Mekanismerna som gör att patienter med diabetes löper ökad risk för kognitiv nedsättning är inte helt klarlagda. Många anser att det kan bero på cerebral mikroangiopati, men detta har visat sig svårt att leda i bevis. Beträffande insulinbehandlade patienter har det spekulerats kring att återkommande hypoglykemier med neuronal celldöd skulle vara en orsak, men det vetenskapliga stödet är bristfälligt [5].
En klar korrelation mellan ålder, diabetesduration, glykemisk kontroll, depression och vaskulära komplikationer har dock påvisats. Huruvida hyperglykemin per se eller andra diabetesfaktorer är den primära patogenetiska orsaken är oklart. Det uppskattas att uppemot 40 procent av patienter med långvarig eller mindre väl kontrollerad diabetes utvecklar någon kognitionsnedsättning [5].
Litteraturen är påfallande sparsam beträffande histopatologiska förändringar i hjärnan hos patienter med diabetes och kognitiv nedsättning. I diabetiska djurmodeller har emellertid konstaterats en påtaglig förlust av kortikala neuron i takt med stigande ålder [14].
Även om konsensus sedan länge råder om att glukosupptaget i CNS inte är insulinreglerat, så är det viktigt att inse att insulin inte bara är ett blodsockersänkande hormon. Insulin är även ett anabolt hormon som också har potentiellt neuroprotektiva och neurotrofiska egenskaper per se [15, 16].
På senare år har ett ökande forskningsintresse fokuserat på insulinsignalering och -resistens i CNS, och inte minst på deras roll för kognition. Sammantaget indikerar dessa studier att insulin har en viktig roll i CNS för kontrollen av systemisk metabolism, glukostolerans och kroppsvikt. Patienter med fetma, med eller utan diabetes, uppvisar insulinresistens även i hjärnan, och detta är i vissa ‒ men inte alla ‒ studier kopplat till kognitiv nedsättning och störd aptitreglering [15, 16].
Symtom
Symtomen vid kognitionsnedsättning hos patienter med diabetes skiljer sig inte från dem hos personer utan diabetes, men som framgår nedan kommer diabetesspecifika aspekter in i bilden. Medvetenheten hos vårdgivare om den betydande samsjukligheten är ofta begränsad, speciellt jämfört med mer välkända diabeteskomplikationer. Den kognitiva nedsättningen omfattar ett spektrum av tillstånd, med olika grader av kognitionsdefekter. I tidiga stadier är tillståndet reversibelt.
Demens. Detta är den allvarligaste och mest uttalade graden, och till skillnad från nedanstående påverkar den klart patientens allmänna dagliga livsfunktioner negativt. Det har rapporterats att patienter med typ 1- eller typ 2-diabetes har 40‒60 procent ökad risk för demens, framför allt vaskulär demens [5-8].
Lätt kognitiv försämring. Detta tillstånd innebär avvikelser i en eller flera kognitiva domäner vid testning, men med minimal eller ingen påverkan på allmänna dagliga livsfunktioner. Patienter med typ 2-diabetes har ca 20 procent ökad risk för detta tillstånd [5-8], och även en ökad risk för övergång till demens [17, 18].
Diabetesspecifik kognitiv nedsättning. Detta avser subtila avvikelser från normal kognitiv funktion som inte är tillräckligt uttalade för att klassificeras inom ovanstående kategorier. Patienter med typ 2-diabetes har uppemot en halv standardavvikelse sämre testresultat på flertalet kognitiva domäner (minne, exekutiva funktioner m m) än personer utan diabetes [6-8, 19]. Avvikelsen hos patienter med typ 1-diabetes har rapporterats vara något mer uttalad än vid typ 2-diabetes [6-8].
Differentialdiagnos
Andra demensformer, depression och neurodegenerativa sjukdomar är överrepresenterade vid diabetes och kan ge likartade symtom. Kliniskt är det synnerligen viktigt att utesluta hypoglykemi, som hos äldre kan ge likartade symtom som vid kognitiv nedsättning. Undvik därför att pressa HbA1c alltför ambitiöst med läkemedel som kan ge hypoglykemi (dvs insulin och sulfonylurea) hos de allra äldsta samt hos sköra patienter, speciellt vid lågt BMI och svängande blodsocker.
Andra behandlingsbara tillstånd måste också uteslutas, t ex vitamin B12-brist, tyreoidearubbningar och hyperkalcemi m fl.
Utredning
Utredningsgången vid misstänkt kognitiv nedsättning hos individer med diabetes skiljer sig inte från den vanliga. Svårigheten för kliniker ligger i att vara medveten om och observant på tillståndet. Detta görs genom
- återkommande, åtminstone årliga, kontroller av blodtryck, P-glukos, HbA1c, lipider, vitamin B12, folat och tyreoideaprofil
- monitorering av kontinuerliga glukosmätningar (CGM) hos insulin- eller sulfonylureabehandlade patienter för att identifiera frekvens och grad av hypoglykemi samt glykemisk variabilitet.
Behandling
Det har tidigare visats att blodtryckssänkning vid systolisk hypertoni minskar risken för demensutveckling [20].
Livsstilsintervention. Fysisk aktivitet liksom rökstopp bör aktivt uppmuntras. Kostråd, framför allt medelhavskost, fysisk aktivitet och kognitiv träning har visats bromsa kognitiv försämring hos äldre individer [21]. Detta är dock inte specifikt för diabetes. Intressant nog har det helt nyligen rapporterats att fysisk aktivitet förbättrar såväl insulinkänslighet i CNS som kognitiva förmågor (oavsett om diabetes föreligger) samt minskar hungerkänslor [22].
Farmakologisk behandling. Utöver de specifika farmaka som redan finns tillgängliga mot demens utgör valet av antidiabetiska läkemedel en grannlaga uppgift med speciella utmaningar hos denna utsatta patientgrupp. Internationella riktlinjer understryker vikten av individualiserad behandling, enkla behandlingsregimer och att i möjligaste mån undvika läkemedel som kan ge hypoglykemi [23].
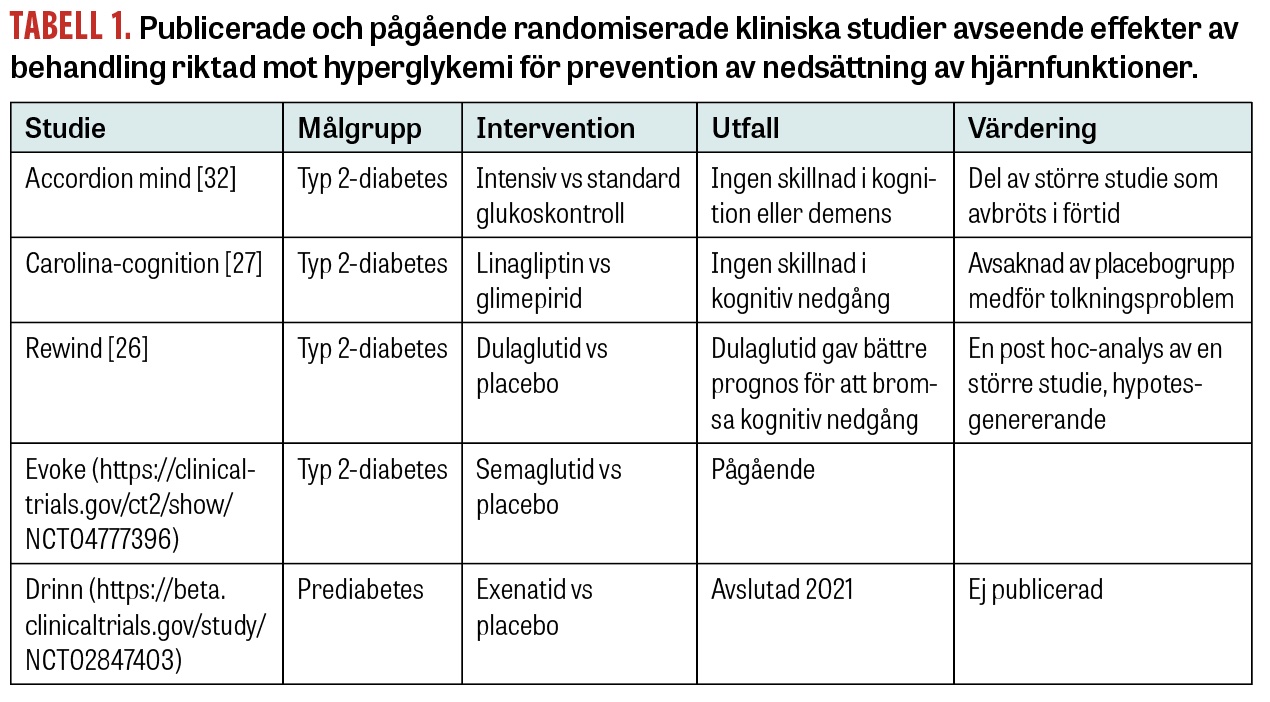
GLP-1 (glukagonlik peptid 1) framstår av flera skäl som intressant i detta sammanhang. Plasmanivåerna av GLP-1 är sänkta vid typ 2-diabetes, höga plasmanivåer av GLP-1 korrelerar med god kognition [10] och GLP-1 har rapporterats produceras i CNS [24], som också uttrycker GLP-1-receptorn inom olika regioner [25]. I Rewind-studien noterades en förbättring av kognitiv nedsättning hos de patienter med typ 2-diabetes som fick behandling med GLP-1R-agonisten dulaglutid [26].
I studier med DPP-4-hämmaren linagliptin, som inte passerar blod‒hjärnbarriären men måttligt höjer plasmanivåerna av GLP-1 [25], noterades dock ingen förändring i kognitiva funktioner jämfört med ett sulfonylureapreparat hos patienter med typ 2-diabetes [27, 28]. Trots att patienter i sulfonylureagruppen drabbades av hypoglykemier sågs ingen skillnad i kognition jämfört med linagliptingruppen. Studien saknade dock en placebogrupp.
Systemisk insulinbehandling har inte övertygande visats påverka kognitionsgraden och har uppenbara nackdelar, såsom risk för hypoglykemi och viktuppgång. Däremot har intranasalt insulin i vissa, men inte alla, studier visats förbättra såväl kognition som insulinresistens i CNS hos icke-diabetiska individer, men utan systemiska effekter på glukos eller kroppsvikt [16, 29].
I en prospektiv observationsstudie med >550 000 äldre patienter med typ 2-diabetes visades att behandling med sulfonylureapreparat var associerad med en ökad risk för demens jämfört med metformin, och att behandling med PPAR-gamma-agonister (glitazoner) var associerad med en minskad risk för demens [30]. I en annan nyligen publicerad studie på >112 000 patienter med typ 2-diabetes visades att metforminbehandlade patienter hade 20 procent lägre incidens av demens under en 5-årsperiod jämfört med patienter som behandlades med sulfonylurea [31]. Data från bl a Svenska demensregistret har visat att behandling med metformin eller DPP-4-hämmare var associerad med en långsammare nedgång i kognitiv funktion [12].
En viktig fråga är huruvida det är hyperglykemi per se som ligger bakom den prematura kognitiva nedsättningen associerad med diabetes. Det är mycket svårt att dissekera ut detta från andra avvikelser som följer med diabetes (obesitas, dyslipidemi, hypertoni, mikroangiopati m fl). Flertalet studier som citeras här är observationsstudier. Det går därför inte att hävda att förbättrad glykemisk kontroll per se påverkar kognitionsnedsättningen, något som heller inte har kunnat beläggas genom intensifierad glukossänkande behandling [32].
Ett antal kliniska prövningar med olika antidiabetiska läkemedel mot kognitiv nedsättning hos individer med eller utan diabetes pågår, enligt Clinicaltrials.gov (Tabell 1).
Potentiella bindningar eller jävsförhållanden: Åke Sjöholm har uppburit föreläsnings- och konsultarvoden från Boehringer Ingelheim, Novo Nordisk, Novartis, Amarin, MSD, Astra Zeneca, Sanofi och Pfizer. Peter M Nilsson har uppburit föreläsningsarvoden från Boehringer Ingelheim, Novo Nordisk, Novartis, MSD, Astra Zeneca och Sanofi samt ingått i en regional rådsgrupp för lipidläkemedel (Sanofi).