Många kliniska studier i Norden rapporteras med lång fördröjning eller inte alls.
Ofta registreras studier retrospektivt, och registren är inte alltid uppdaterade.
Det finns stort utrymme för forskningshuvudmän att förbättra registrering och rapportering.
Administrativt stöd för registrering och rapportering bör införas för att avlasta enskilda forskare.
Vi har nyligen lett ett stort internationellt samarbetsprojekt som undersökte rapportering av registrerade kliniska studier i Norden [1]. Vi följde upp studier som registrerats i EU:s prövningsregister (EU Clinical Trials Registry; EUCTR) eller i det amerikanska registret Clinicaltrials.gov, som hade avslutats 2016–2019 och vars huvudman var ett nordiskt universitet eller universitetssjukhus. Vi fann att ungefär hälften av studierna inte hade rapporterat resultat två år efter avslutningsdatum, och fler än var femte studie saknade rapportering över huvud taget. Denna bristande rapportering undergräver kunskapsbasen för evidensbaserad medicin, är ett slöseri med resurser samt leder till att de kunskapsvinster som ska väga upp risker för patienter som deltar i studierna uteblir eller försenas.
Rapportering av resultat från kliniska studier är en förutsättning för tillförlitlig evidens för kliniska beslut. Den etiska skyldigheten att registrera och rapportera resultat av kliniska studier har kodifierats på flera sätt. Världshälsoorganisationen (WHO) har deklarerat att kliniska studier ska registreras innan data börjar samlas in, samt att resultat ska rapporteras senast inom 12 månader i det register där prövningen registrerats och senast inom 24 månader genom traditionell tidskriftspublicering [2]. I EU gäller som huvudregel att alla studier registrerade i EUCTR (sedan 2022 i det nya Clinical trials information system; CTIS) ska rapportera resultat senast efter 12 månader [3]. Registrering innebär att man beskriver studiens design, huvudutfallsmått, planerat start- och slutdatum med mera i ett prövningsregister, så att informationen blir fritt tillgänglig på internet. Därmed blir det möjligt att se vilken forskning som pågår och att bedöma om det finns studier som borde ha rapporterat resultat men där resultaten saknas. Avslutning av studien innebär enligt WHO:s definition att den sista datapunkten är insamlad från den sista forskningspersonen som deltagit i studien.
Prövningsregistren har standardiserade format för rapportering av resultat. Denna rapportering är summarisk och omfattar grundläggande information, såsom hur många forskningspersoner som rekryterats och som slutfört studien, deras karakteristika före intervention (till exempel kön, genomsnittlig ålder och symtomnivå), huvudutfall per behandlingsgrupp samt negativa händelser. När resultat rapporteras i tidskriftsartiklar kan forskaren naturligtvis inte styra hur lång tid det tar för tidskriften att granska och hantera manuskriptet. Denna tidsutdräkt kan göra det svårt att leva upp till WHO:s riktlinje om 24 månader. I vår studie har vi inkluderat både tidskriftsartiklar och »preprints« som forskare publicerat på öppna plattformar.
Utrymme för förbättring
Vår studie är den första som systematiskt har följt upp rapportering av registrerade kliniska studier vid akademiska institutioner i Norden. Vi inkluderade 2 113 studier, av vilka 1 019 hade huvudman i Danmark, 525 var från Sverige och övriga var från Norge, Finland och Island. En tredjedel av studierna (675) var läkemedelsstudier. Övriga var antingen kliniska prövningar av icke-farmakologiska interventioner (exempelvis kirurgiska tekniker eller psykoterapi) eller kliniska studier i en vidare mening, som inte undersökte interventioner som var möjliga vårdåtgärder. Enligt WHO:s definition av kliniska studier [4] ska alla studier registreras som innehåller en intervention samt mäter hälsorelaterade utfall. Därmed omfattas även många studier som innefattar interventioner på människor, även om de inte är avsedda att informera klinisk praktik.
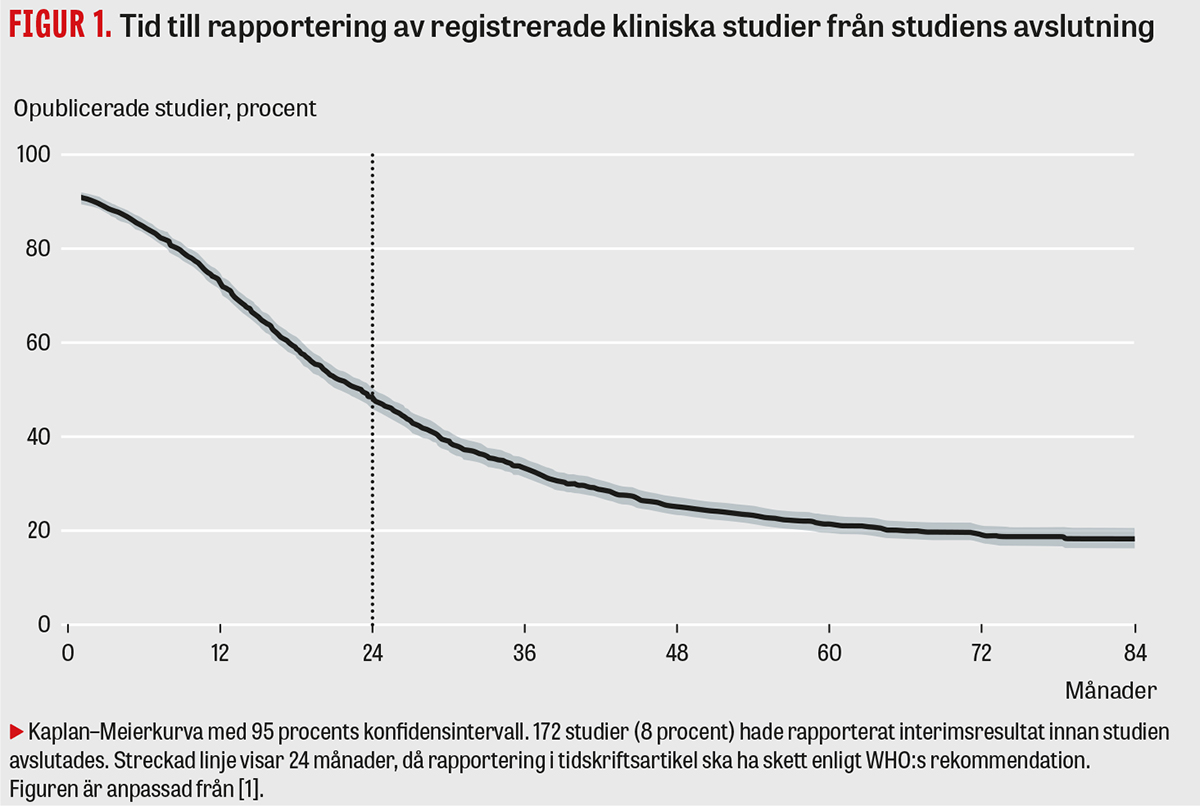
Vi fann att endast 1 procent av studierna i vårt urval hade rapporterat resultat inom ett år från avslutning i aktuellt register och därmed följt WHO:s första rekommendation. Huvuddelen av rapporteringen skedde i stället genom vetenskapliga publikationer (artiklar eller konferensabstrakt). Genom omfattande manuella sökningar identifierade vi artiklar som matchade de registrerade studierna. Figur 1 visar tiden till rapportering för samtliga registrerade studier i urvalet. Vi fann att 1 092 studier (51,7 procent) hade följt WHO:s andra rekommendation och rapporterat resultat inom två år från avslutning, och 1 638 studier (77,5 procent) hade rapporterat resultat under uppföljningstiden. Mediantiden till rapportering var 698 dagar. För studier registrerade i Clinicaltrials.gov kunde vi även bedöma om registreringen var prospektiv eller ej; vi fann då att endast 856 av 1 681 studier (50,9 procent) var prospektivt registrerade.
Våra resultat begränsas av tillgången till information i de undersökta registren. Vissa studier registreras aldrig, vissa registreras men markeras aldrig som slutförda, och vissa registreras i efterhand, vilket kan bero bland annat på att tidskrifter efterfrågar registrering i samband med publicering. Därför visar våra resultat sannolikt en högre andel rapporterade studier än vad fallet vore om hela den möjliga populationen av studier kunde undersökas. Samtidigt bör noteras att vissa registreringar troligen var inaktuella och/eller felaktiga. Det kan exempelvis förekomma studier som enligt registreringen både startat och nått planerat slutdatum, men som i verkligheten inte insamlat några data och vars status därför behöver uppdateras i registret för att visa att studien aldrig genomförts. Våra resultat visar således på utrymme inte bara för förbättrad rapportering utan även för förbättrad registrering.
Bättre rapportering en global angelägenhet
Systematiska undersökningar av rapportering av kliniska studier har gjorts förut i andra länder. I Tyskland visade en uppföljning av studier registrerade i Clinicaltrials.gov och det tyska registret DRKS, avslutade 2014–2019, att färre än hälften hade rapporterat resultat inom två år och en tredjedel inte hade rapporterat resultat inom fem år från avslutning [5]. En uppföljning av studier från Kanada registrerade i Clinicaltrials.gov 2009–2014 visade att 55 procent hade publicerats i en tidskrift [6]. Detta antyder att problemet med rapportering av kliniska studier är globalt och att forskningshuvudmän överallt behöver ta sig an frågan.
Vi hoppas att vår studie kommer att väcka debatt om hur resultatrapportering bäst kan följas upp och stödjas. Vi menar att ett förstärkt institutionellt ansvarstagande är nödvändigt. Det är ohållbart att hela ansvaret för registrering och rapportering är decentraliserat till enskilda forskargruppsledare. Olika saker kan hända som gör att forskaren inte lyckas rapportera resultat i tid, och då behövs ett stöd från forskningshuvudmannen så att rapporteringen ändå genomförs. Forskningshuvudmän bör som ett första steg tillse att de har en aktuell överblick över sina kliniska studier och deras registrering och rapportering. Forskningsfinansiärer bör kräva att studier registreras och rapporteras samt följa upp att så sker.
Vi tror att det finns stort utrymme för att förbättra registrering och rapportering av kliniska studier utan att belasta forskningen med fler betungande administrativa kontrollpunkter. Exempelvis skulle registrering kunna utföras av stödpersonal i samband med etikprövning, vilket skulle göra att forskaren bara behövde tillhandahålla informationen en gång och inte själv behövde navigera genom registrens användargränssnitt, som kan upplevas som krångliga. Lärosäten arbetar redan med att förbättra rapporteringen av sina studier, men ett behov av förbättring kvarstår. Ett exempel på hur arbetet med att förbättra rapportering av registrerade studier kan påbörjas vid ett svenskt lärosäte har tidigare givits i Läkartidningen [7].
Vidare forskning
Det är angeläget att fortsätta följa utvecklingen av registrering och rapportering av kliniska studier i Sverige och Norden. Vi avser att följa upp med ett kommande projekt som utsträcker uppföljningen över tid och möjliggör jämförelser. Vi planerar också att undersöka viktiga aspekter av kvalitet och transparens. Här ingår indikatorer för transparens, exempelvis om man delat data och kod som gör det möjligt att verifiera statistiska analyser och se om resultaten håller för olika antaganden. En annan viktig fråga är om det som rapporterats är vad som planerades enligt registreringen, eller om utfallsmått har bytts ut utan att detta har angivits i den publicerade studien. Genom dessa ytterligare undersökningar hoppas vi kunna visa upp en rik och nyanserad bild av kvaliteten på rapportering i denna kohort av kliniska studier från Norden.
Förbättrad registrering och rapportering av kliniska studier ligger i patienternas, vårdgivarnas och akademins eget intresse. Våra resultat visar att lärosäten och universitetssjukhus har utrymme för förbättring. Vi hoppas att våra resultat kommer att kunna ligga till grund för åtgärder i syfte att nå snabbare och mer fullständig rapportering av kliniska studier.
Potentiella bindningar eller jävsförhållanden: Det beskrivna forskningsprojektet har finansierats av Knut och Alice Wallenbergs stiftelse genom Wallenberg Foundation Postdoctoral Scholarship Program at Stanford (Cathrine Axfors, KAW 2019.0561).