Det finns generellt sett mycket få studier om påverkan på det diande barnet efter att en ammande kvinna genomgått narkos [1-5]. Den effekt som läkemedlet har på barnet beror på ett flertal faktorer. För det första är plasmakoncentrationen hos mamman beroende av den dos som administreras samt medlets farmakokinetik i hennes kropp. Vid behandling med fettlösliga läkemedel som har en stor distributionsvolym finns en stor del av läkemedlet utanför blodbanan och endast en liten del finns tillgängligt för överföring till bröstmjölken. Graden av proteinbindning i mammans blodbana är också av betydelse eftersom endast fritt läkemedel kan gå över i mjölken.
Nästa steg är bröstkörtelns farmako-kinetik för överföring av ämnen mellan mammans blod och bröstmjölken. Denna överföring är en jämviktsfunktion, vilket innebär att läkemedelsinnehållet i mjölken hela tiden reflekterar den aktuella plasmakoncentrationen hos mamman. Bröstmjölk innehåller dock mer fett än plasma och fettlösliga ämnen kommer att koncentreras i bröstmjölken. Bröstmjölk har också ett lägre pH än plasma vilket innebär att svaga baser går över i högre grad än svaga syror. Laddade ämnen har svårare att passera än neutralt laddade ämnen.
Mjölk/plasma-kvoten (M/P-kvoten) används ofta som ett mått på hur mycket läkemedel som går över i bröstmjölk. M/P-kvoten anger förhållandet mellan läkemedelskoncentrationen i bröstmjölk och i mammans plasma. Eftersom denna kvot beror på ett jämviktsförhållande mellan bröstmjölk och plasma som är beroende av tid bör man använda sig av arean under koncentration–tids-kurvan för bröstmjölk i relation till plasma.
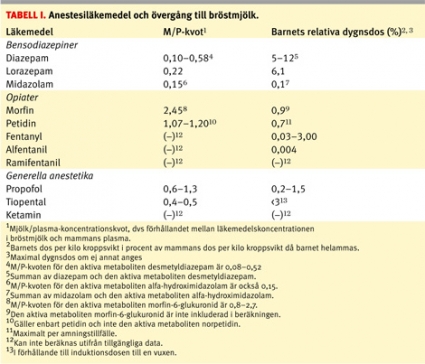
Ett helammat spädbarn får i sig ungefär 150 ml bröstmjölk per kilo kroppsvikt och dygn. Om man känner till koncentrationen av läkemedlet i bröstmjölk (eller koncentrationen i mammans plasma och M/P-kvoten) kan man räkna fram barnets totala dygnsdos. För att kunna jämföra denna dos med mammans dos brukar man viktjustera doserna, det vill säga att man beräknar barnets dos per kilo kroppsvikt i procent av mammans dos per kilo kroppsvikt. M/P-kvoter och relativa dygnsdoser till barnet för vanliga narkosmedel presenteras i tabell I.
Plasmakoncentrationen hos barnet beror också på hur väl barnet absorberar läkemedlet från mag–tarmkanalen och på läkemedlets farmakokinetik hos barnet. Nyfödda och spädbarn har en mycket oregelbunden peristaltik och en långsam ventrikeltömning. De har också en omogen lever, lägre albuminnivåer och en sämre förmåga att utsöndra läkemedel via njurar och avföring. Därmed kan även doser som tycks vara försumbara ackumuleras hos barnet och ge ogynnsamma effekter vid längre tids användning av läkemedlet hos mamman. Hos prematura barn är denna risk större än hos normalburna barn.
Generellt kan mödrar med normalburna barn och äldre spädbarn amma efter narkos när de känner sig vakna och alerta eftersom detta är ett tillräckligt bra tecken på att narkosmedlet har försvunnit ur mammans plasma [6]. Det kan dock finnas läkemedel kvar i kroppen i fettvävnad men man anser att denna långsamma utsöndring inte påverkar barnet. Eftersom läkemedel redistribueras från mjölken och tillbaka till mammans plasma när koncentrationen i plasma sjunker, är det generellt sett inte nödvändigt att pumpa ur och slänga första portionen mjölk. I det individuella fallet beror handläggningen på vilka läkemedel som använts vid narkos och vilket barn det gäller.
Bensodiazepiner
Bensodiazepiner används framför allt som premedicinering. De olika substanserna har olika farmakokinetik och går över i mjölk i varierande utsträckning.
Diazepam och dess aktiva metabolit, N-desmetyldiazepam, har långa halveringstider och ska användas med försiktighet till ammande mödrar eftersom halveringstiden är ännu längre hos spädbarn [4]. Detta har framför allt betydelse vid upprepade doseringar till modern, med risk för ackumulering och biverkningar hos barnet till exempel i form av dålig sugförmåga och somnolens [4, 6].
I den kaukasiska befolkningen har 4 procent en genvariant som innebär att enzymet CYP2C19, som bryter ner diazepam är inaktivt. Ammande kvinnor med denna genvariant kommer att ha högre plasmakoncentrationer vilket troligen ökar risken för påverkan av barnet.
Lorazepam har kortare halveringstid och ingen aktiv metabolit [2]. Vid låga till måttliga doser (2,5 mg iv) har man inte sett någon sedering av spädbarnet. De plasmakoncentrationer som har uppmätts hos barnet efter att lorazepam använts som premedicinering av mammor (3,5 mg po) indikerar att de är så låga att de inte har klinisk relevans.
Midazolam har kort halveringstid och dess aktiva metabolit alfa-hydroxy-midazolam har ungefär samma halveringstid som modersubstansen [4). Efter en engångsdos av 15 mg midazolam sjunker halterna snabbt i mjölk och efter 4 timmar är varken midazolam eller dess metabolit detekterbara i mjölk [7]. Dessa låga nivåer har verifierats i en relativt ny studie [8]. Utifrån dessa data anses det vara säkert att fortsätta att amma barnet utan avbrott.
Opioider
Morfin går snabbt över till bröstmjölk och koncentration–tidskurvorna för blod och mjölk är ungefär parallella [2, 4, 9]. Vid användning av enstaka doser av morfin till modern är risken för påverkan på barnet liten och en sådan situation bedöms därmed vara förenlig med amning. Vid kontinuerlig behandling verkar man dock kunna uppnå kliniskt signifikanta nivåer hos barnet vilket också innebär ökade risker för bieffekter. Detta gäller särskilt för nyfödda barn som har en 5–7 gånger längre halveringstid jämfört med vuxna. Detta beror till stor del på den aktiva metaboliten morfin-6-glukuronid, som man har uppmätt 38 gånger högre nivåer av i bröstmjölk än i plasma [10].
Petidin går över i bröstmjölk men har en kort halveringstid [2, 4]. Den aktiva metaboliten norpetidin har dock en halveringstid på 14–21 timmar, vilket gör att den även finns kvar länge i bröstmjölken. Tillsammans med en ännu längre halveringstid hos barnet ökar det risken för ackumulering. Detta kan förklara större beteendemässiga problem som visats för barn till mödrar som behandlats med petidin jämfört med morfin. Man bör därför vara försiktig med petidin till ammande kvinnor och framför allt undvika upprepade doser eller långvarig behandling.
Fentanyl har mycket kort halveringstid, vilket tillsammans med snabb redistribution från mammans blodbana gör att enbart mycket låga nivåer uppmäts i bröstmjölk [2, 8]. I två studier med doser på 50–400 mikrogram respektive 2 mikrogram/kg var fentanyl efter 4–7 respektive 10 timmar inte detekterbart i bröstmjölk [4, 9]. Användning av fentanyl i de flesta kliniska situationer och med terapeutiska doser utgör därmed förmodligen en försumbar risk för det diande barnet.
(Obs! I den tryckta versionen av Läkartidningen anges felaktig mängd fetanyl i bröstmjölk. Det är här korrigerat, se ovan. LT beklagar det inträffade).
Alfentanil har en trefasisk elimination med halveringstider på 1, 14 och 100 minuter [11]. I en studie av nio kvinnor mättes koncentrationer i kolostrum som motsvarade att ett helammat spädbarn skulle få i sig 0,2 g/kg per dygn [12]. Även behandling med alfentanil med enstaka doser vid kirurgiska ingrepp bör vara förenligt med amning ett par timmar senare.
Remifentanil är fettlösligt och har låg molekylvikt vilket talar för att det går över i bröstmjölk. Detta har också visats hos råtta [9]. Det finns ingen tillgänglig information om användning av remifentantil vid amning. Halveringstiden, som är mellan 3 och 10 minuter, är jämförbar för spädbarn från fem veckor och för vuxna. Detta talar för att enstaka doser bör vara förenligt med amning ett par timmar senare.
Generella anestetika
Tiopental är en barbiturat som använd som intravenöst induktionsmedel ger ett snabbt anslag och en snabb redistribution [4]. En normal induktionsdos bör, trots en förmodad längre halveringstid hos barnet, vara förenlig med amning. Om tiopental ges som upprepade doser eller som infusion kan det dock ackumuleras hos barnet och neonatala bieffekter har rapporterats.
Propofol är ett annat vanligt induktionsmedel som går över till barnet i liten mängd [4, 8]. Den låga bröstmjölkskoncentrationen, kombinerat med sannolikt relativt låg absorption av propofol från gastrointestinalkanalen, och en viss första-passagemetabolism hos nyfödda gör det mycket osannolikt att friska barn påverkas av propofol i bröstmjölk [4]. Dessutom finns hållpunkter för att propofol metaboliseras snabbt också hos nyfödda.
Ketamin har en bifasisk elimination med en halveringstid i betafasen på 80 minuter [9]. Det har hög fettlöslighet och biotillgängligheten är 90 procent. Det finns ingen information om koncentrationer i bröstmjölk. Den relativt korta halveringstiden talar för att användning vid enstaka tillfällen bör vara förenligt med amning.
Inhalationsanestetika
Det finns mycket begränsat med information om halogenerade inhalationsanestetika.
Den studie som alla översiktsartiklar i ämnet refererar till är utförd på en ammande anestesiolog. Efter fem timmar i operationssalen var halten av halotan i hennes bröstmjölk överensstämmande med de halter som kunde uppmätas i operationssalen; bröstmjölk/gas-koefficienten var ungefär lika som blod/gas-koefficienten [9].
Utsöndring i utandningsluften har rapporterats kvarstå i upp till 20 dagar efter exponering och man kan förvänta sig att utsöndring i bröstmjölk kvarstår lika länge. I de översikter som har penetrerat frågan råder konsensus om att det går bra att amma när det är praktiskt möjligt för mamman efter kirurgi [4, 9].
Vad gäller övriga inhalationsaneste-tika finns inga data tillgängliga för amning men samma förhållanden bör föreligga för enfluran, isofluran och sevofluran.
Muskelrelaxantia
och reverserande läkemedel
Informationen om utsöndring av muskelrelaxerande läkemedel i bröstmjölk är mycket bristfällig.
Succinylkolin har en halveringstid på 3–5 minuter och mycket lite borde hinna utsöndras till mjölk och orsaka att barnet få i sig signifikanta mängder av läkemedlet [4].
Alla andra muskelrelaxerande läkemedel som till exempel atrakurium, pankuronium och vekuronium är kvartära aminderivat som är laddade vid fysiologiskt pH och har låg fettlöslighet. Därmed borde minimala mängder utsöndras i bröstmjölk och absorptionen från barnets mag–tarmkanal vara försumbar.
Reverserande läkemedel som neostigmin, som är en tertiär amin, har i äldre studier av ammande kvinnor med myasthenia gravis visats inte gå över i bröstmjölk [9]. Nyare studier med mer känslig analysteknik har dock visat att det närbesläktade ämnet pyridostigmin går över i bröstmjölk med en M/P-kvot på 0,3–0,6. Vilken påverkan det kan ha på barnet är dock okänt.
Sammanfattningsvis kan kvinnor med normalburna barn och äldre spädbarn generellt amma sina barn efter narkos när de känner sig vakna och alerta, eftersom detta är ett tillräckligt bra tecken på att narkosmedlet har försvunnit ur plasma och därmed ur praktisk synvinkel även ur bröstmjölken.
Läkemedel med långa halveringstider, eller läkemedel som har aktiva metaboliter med långa halveringstider, bör undvikas eller användas med stor försiktighet eftersom det finns risk för ackumulering hos barnet. Detta gäller till exempel diazepam och petidin.
Amning under långtidsbehandling med övriga bensodiazepiner och opioider måste värderas individuellt.