Anestesiologens metoder är inriktade på att modulera medvetande och muskelfunktioner med bla farmaka så att patienten kan opereras. Sjukdomar i nervsystem och muskulatur kan medföra att vanliga rutiner behöver modifieras eller omprövas helt. Att söva patienter med ärftliga muskelsjukdomar är förenat med ökad risk för komplikationer hos dessa patienter, som dessutom sövs/opereras oftare än normalbefolkningen. Av den anledningen är det viktigt för anestesiologen att ha kunskap om diagnos och patofysiologi för att kunna förebygga och vid behov behandla anestesiutlösta komplikationer och till och med död.
I ett svenskt material var prevalensen ärftliga muskelsjukdomar bland barn 1/1900 [1]. Med ärftlig perifer muskelsjukdom avses här en genetiskt orsakad sjukdom vars patofysiologiska störning ligger perifert om synapsen.
I bedömningen av vilken anestesimetod som skall användas måste hänsyn tas till sjukdomens patofysiologi, anestesiologens erfarenhet och preferenser samt patientens önskemål. Det är viktigt att veta vilka problem som kan uppstå och hur man skall agera. Vi beskriver i här några typsjukdomar.
Malign hypertermikänslighet
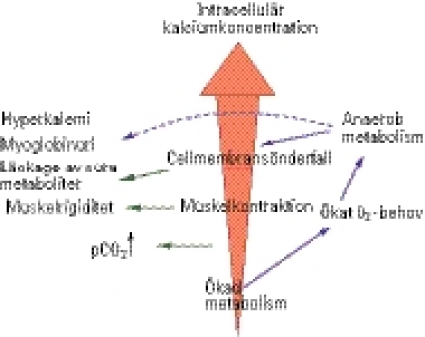
Malign hypertermikänslighet (malign hypertermi, MH) är en ärftlig subklinisk myopati. Bärare av anlaget är helt friska men kan utveckla en potentiellt livshotande extrem hypermetabolism om de sövs med potenta inhalationsanestetika och/eller suxametonklorid. Ökningen av ämnesomsättningen kan leda till mycket hög och snabb temperaturstegring, därav namnet MH-känslighet.
MH-känslighet orsakas av mutationer i ryanodinreceptorgenen på kromosom 19. Receptorn är en intracellulär kalciumkanal som styr frisättningen av kalcium från det sarkoplasmatiska retiklet i muskelcellen. Central core disease (CCD) orsakas också av en mutation i ryanodinreceptorgenen, och patienter med CCD är oftast MH-känsliga.
Beroende på anestesiteknik räknar man med en incidens av misstänkta MH-reaktioner på 1:4200–16000 generella anestesier. MH-reaktioner uppträder oftast hos yngre patienter.
MH-känslighet är spritt i alla folkgrupper och över hela världen. Under de senaste åren har vi i Sverige haft två dödsfall i fulminanta MH-reaktioner.
En MH-reaktion karakteriseras av både metabola och muskulära symtom. Den ökande ämnesomsättningen noteras numera oftast som ett hastigt stigande koldioxidinnehåll i utandningsluften, mätt som endtidalt CO2 (EtCO2). Det numeriska värdet av EtCO2 måste alltid sättas i relation till minutventilationen. Andra respiratoriska tecken är takypné eller en het CO2-absorber på anestesisystemet. Absorbern kan därför behöva bytas ut snabbt. Temperaturstegring är ett sent och prognostiskt ogynnsamt tecken – då är det bråttom med behandling och kylning.
Muskelsymtomen är av två slag: generell muskelrigiditet och masseterspasm. Generell muskelrigiditet kommer sällan momentant utan uppträder efter kortare eller längre tids anestesi med potenta inhalationsgaser. Generell muskelrigiditet är ett relativt specifikt tecken, men det är inte patognomont. Det kan även ses vid andra sjukdomar, tex myotonier. Masseterspasm utlöst av suxametonklorid är ett mer ospecifikt tecken. Efter en injektion av suxametonklorid är det normalt med en temporärt övergående tonusökning av massetermuskulaturen [2]. Masseterspasm är när en lång och kraftigt ökad tonus leder till trismus. Det finns inget sätt att mäta masseterspasm, men vår erfarenhet är att en van anestesiolog omedelbart känner igen det.
Sällsynta symtom är snabbt muskelsönderfall ledande till hyperkalemi och/eller kompartmentsyndrom. I efterförloppet till en MH-reaktion kan allvarliga komplikationer från i stort sett alla organsystem uppträda.
Behandling. Den intracellulära ökningen av kalciumkoncentrationen stoppas med dantrolen, en intracellulär kalciumhämmare. I övrigt är behandlingen symtomatisk. Patienter som reagerat med en misstänkt MH-reaktion skall utredas med sk in vitro-kontrakturtest (IVCT). Det är för närvarande det enda test som kan användas för att utesluta MH-känslighet. Testet utförs in vitro på levande muskel (endast i Lund). Diagnosen MH-känslighet kan i vissa fall ställas men inte uteslutas med ett genetiskt test, vilket beror på att alla mutationer inte är kända.
Perioperativ vård. Förutom uppgifter om MH-reaktion finns det inga anamnestiska data som kan fastställa eller utesluta MH-känslighet. Patienter med fastställd eller misstänkt MH-känslighet måste sövas MH-säkert utan triggande medel, vilket också gäller vid sjukdomen CCD. Dantrolen skall inte ges profylaktiskt.
Duchennes muskeldystrofi
Duchennes muskeldystrofi är den vanligaste muskeldystrofin. Sjukdomen drabbar pojkar, och prevalensen i skolåldern är ca 1/4700 [1]. Kardinalsymtomen är tilltagande muskelsvaghet med pseudohypertrofi, mest uttalad i vadmuskulaturen. Sjukdomen diagnostiseras i tidiga barnaår och progredierar till döden i unga år. Förutom muskelsymtom ses bla andnings- och hjärtinsufficiens, skolios samt nedsatt tarmmotilitet. Beckers muskeldystrofi och X-bunden dilaterad kardiomyopati är nära relaterade till Duchennes muskeldystrofi. Orsaken till sjukdomen är en mutation i den på X-kromosomen belägna gen som kodar för dystrofin. Dystrofin uttrycks i både tvärstrimmig skelettmuskulatur och myokardium. Skadan vid Duchennes muskeldystrofi ger bla störd intracellulär kalciumhomeostas och skört cellmembran. Det sistnämnda är orsaken till den höjning av kreatinfosfokinas (CK) som ses hos dessa patienter.
Anestesikomplikationer av många typer finns beskrivna, bla från respiration, cirkulation, muskler, njurar och metabolism.
Hjärtmuskelpåverkan är mycket vanligt, då dystrofin också finns i hjärtat. Det finns ingen relation mellan hjärtsymtomen och muskelsymtomen. Hjärtsvikt ses framför allt hos lite äldre patienter. Det finns beskrivet fall där EKG och ekokardiografi visat normala förhållanden preoperativt och där pojken några timmar in i en stabil anestesi under noggrann övervakning utvecklar hjärtsvikt/hjärtstillestånd.
Frågan har ställts om ekokardiografi är bra för att bedöma myokardiet i dessa sammanhang [3]. I ett stort material på 444 anestesier till patienter med Duchennes muskeldystrofi uppstod 6 fall av hjärtstillestånd [4]. Patogenesen till dessa hjärtstillestånd är vanligen hyperkalemi. Vid perioperativa hjärtstillestånd utan uppenbar förklaring, särskilt hos barn, bör man misstänka hyperkalemi. Det är då viktigt att omedelbart kontrollera serumkalium. Kan man inte få svar inom mycket kort tid föreslår vi att man behandlar med kalcium intravenöst, utan att invänta svar. Det finns många fallbeskrivningar med rabdomyolys utlöst av anestesi hos dessa patienter. Sannolikt är risken för detta störst tidigt i sjukdomsförloppet, när muskulaturen inte är helt fettomvandlad.
Patienterna har nedsatt lungfunktion beroende på muskelsvaghet. Lunginflammation/lungsvikt är vanligaste dödsorsak hos dessa patienter. Motiliteten i mag–tarmkanalen är nedsatt, vilket ökar risken för regurgitation.
Feber per- och postoperativt är en annan komplikation. Det finns ett flertal fallbeskrivningar med feber som kommer långsamt och som ibland har ett letalt förlopp. I en del äldre litteratur kopplas Duchennes muskeldystrofi och MH ihop, men något direkt samband finns inte.
Perioperativ vård. Noggrann preoperativ bedömning är viktig. En grov tumregel är att om patienten kan stå upp är lungfunktionen acceptabel ur anestesiologisk synvinkel.
Någon ideal, »riskfri« narkos till dessa pojkar finns inte. Regionalanestesi kan med fördel användas. Epidural bedövning har tex använts med framgång men utgör sannolikt ingen garanti för att komplikationer inte skall uppträda. För att minska risken för aspiration vid generell anestesi bör man vara generös med att sätta V-sond. Viss ökad känslighet för icke-depolariserande muskelrelaxantia finns beskriven, men kliniskt saknar det betydelse. Suxametonklorid är kontraindicerat, då det kan utlösa rabdomyolys och hyperkalemiskt hjärtstillestånd. Användandet av potenta halogenerade inhalationsanestetika, tex sevofluran, är kontroversiellt, beroende på ett flertal fallbeskrivningar där dessa medel kopplats till bla hjärtstillestånd. Enligt vår mening bör halogenerade inhalationsanestetika om möjligt undvikas. Vid ett rundabordssamtal vid American Society of Anesthesiologists möte i Orlando 2002 där anestesi till patienter med Duchenne diskuterades avrådde de flesta från användning av potenta inhalationsanestetika.
Postoperativa lungkomplikationer orsakade av muskelsvaghet och/eller skolios är vanliga, därför bör den postoperativa övervakningen vara längre än normalt.
Myotoni
Myotoni är en ofrivillig ökning av muskeltonus med oförmåga till relaxation. De vanligaste myotonierna är myotonia congenita och dystrophia myotonica. Myotoni som uppträder under anestesi kan i sällsynta fall bli så allvarlig att den omöjliggör ventilation av patienten. Så långt som möjligt skall man därför undvika de faktorer som kan utlösa en myotoni. Varken regional eller generell anestesi förebygger myotoni, och det finns ingen effektiv behandling av myotoni.
Det måste understrykas att en myotoni inte kan brytas med muskelrelaxantia, beroende på att dessa verkar på synapsen, medan en myotoni utlöses intracellulärt och distalt om synapsen. Att muskelrelaxera patienter med någon form av myotoni kräver eftertanke. Suxametonklorid får anses kontraindicerat vid myotona sjukdomar, bla beroende på att det kan utlösa en myotoni [5]. Om det behövs muskelrelaxation bör man använda kortverkande icke-depolariserande muskelrelaxantia och monitorera patienten. Att bryta effekten med neostigmin är olämpligt – det kan utlösa en myotoni.
Dystrophia myotonica (Steinerts sjukdom) är den vanligaste myotonin. Prevalensen anges vara 1/10000–100000. I Sverige finns lokala anhopningar i Norrbotten och Örebro län. Kardinalsymtomen är myotoni och långsamt tilltagande muskelsvaghet, presenil katarakt och överledningsrubbningar i hjärtat. Utmärkande för sjukdomen är att många organsystem är involverade. Dystrophia myotonica orsakas av ett fel i en gen som kodar för ett proteinkinas. Sjukdomen uppvisar antecipation, dvs symtomen förvärras för varje generation.
Anestesikomplikationer. Det är viktigt att vid anestesi vara medveten om att dystrophia myotonica är en generell sjukdom. Förutom av myotoni kan anestesin kompliceras på flera sätt. Anestesirelaterade komplikationer ses i 35–50 procent av fallen [6]. Dessa patienter är mycket känsliga för den sederande och andningsdeprimerande effekten av farmaka som tex opioider och bensodiazepiner. Det finns en fallrapport om svår andningsdepression efter morfin givet epiduralt. Postoperativa respiratoriska komplikationer är vanliga och kan förklaras både med muskelsvaghet och central hypoventilation. Oförklarlig apné postoperativt kan vara debutsymtom vid dystrophia myotonica. Vid psykisk påverkan bör hypoventilation uteslutas. Att det inte är ovanligt med odiagnostiserad dystrophia myotonica beror på att patienterna ser myotonin som »normal«, eftersom släktingar ofta har samma besvär. Hjärtpåverkan är mycket vanlig, och den är inte alltid relaterad till muskelsymtomen. För patienter med mitralisprolaps bör antibiotikaprofylax ges enligt gängse rutiner. Gonadal/endokrin insufficiens ses ofta. Vid cirkulationssvikt som inte svarar på inotropi kan man överväga att ge steroider, då en latent binjurebarksinsufficiens kan vara orsaken. Risken för regurgitation/aspiration är förhöjd på grund av att peristaltiken i gastrointestinalkanalen kan vara nedsatt. Frekvensen kejsarsnitt liksom atoniska efterblödningar är förhöjd beroende på påverkan även på glatt muskulatur.
Perioperativ vård. Genom hela vårdförloppet är det viktigt att både anpassa doseringen av alla farmaka efter den ökade känsligheten och förebygga avkylning och shivering. Både regional och generell anestesi kan användas. Regionalanestesi har fördelen att tillförseln av sederande farmaka kan minimeras. Generell anestesi kan inledas med tiopental eller propofol. Det finns ett material publicerat där patienterna sövts med propofol kontinuerligt intravenöst utan komplikationer [7], men det finns också fallbeskrivningar där smärtan vid en propofolinjektion utlöst myotoni.
Det finns inget som hindrar att potenta inhalationsanestetika används i en balanserad anestesi, men anestesi enbart baserad på inhalationsanestetika bör inte användas, då detta medför ökad risk för aspiration [8]. Patienterna bör få ventrikelsond. Den postoperativa övervakningen bör vara längre än normalt [9], och det är mycket viktigt att vårdavdelningen får noggrann och tydlig information om patientens ökade känslighet för sederande farmaka.
Myotonia congenita (Thomsens sjukdom) är en icke-progressiv sjukdom där endast skelettmuskulaturen är drabbad. Myotonin är ofta mer uttalad vid detta tillstånd än vid dystrophia myotonica. Prevalensen i Skandinavien är ca 9 per 100000. Sjukdomen orsakas av fel på en kloridkanal. De anestesiologiska problem som kan uppstå är myotoni.
Det viktigaste i den preoperativa vården är att förebygga myotoni. Patienterna har ingen ökad känslighet för opioider, sederande farmaka eller icke-depolariserande muskelrelaxantia.
Periodiska paralyser
Periodiska paralyser är en grupp av sjukdomar som karakteriseras av attacker av muskelsvaghet/paralys som inte drabbar andningsmuskulaturen. Vid hypokalemisk periodisk paralys är symtomen attacker av muskelsvaghet, som vanligen varar i 3–4 timmar. Under en attack sjunker serumkalium. I en fallrapport finns det rapporterat koppling mellan MH-känslighet och hypokalemisk periodisk paralys i en familj [10]. Vid hyperkalemisk periodisk paralys är symtomen ungefär desamma. Under en attack stiger serumkalium vanligen till över 6 mmol/l, ofta kombinerat med hemokoncentration.
Perioperativ vård. Preoperativt och genom det perioperativa förloppet bör elektrolyter kontrolleras och vid behov korrigeras. Per- och postoperativt bör patienternas EKG-övervakas för att få indikationer på hypo- och hyperkalemi. Shivering och hypotermi kan utlösa en attack, och därför bör patienterna hållas normoterma. Både regional och generell anestesi kan användas. Hos patienter med hypokalemisk periodisk paralys finns viss risk för MH-känslighet, vilket man bör ta hänsyn till. Vid en attack av hypokalemisk periodisk paralys bör kalium ges och glukosinfusion undvikas. Vid hyperkalemisk periodisk paralys är primär behandling glukosinfusion, eventuellt med insulin. Patienter med dessa sjukdomar har ett svårförutsägbart svar på muskelrelaxantia, varför övervakningen bör vara noggrann.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.