Sepsis är ett tillstånd med hög morbiditet och mortalitet som kan förekomma överallt i vården. Tidig upptäckt och behandling är avgörande för prognosen, men försvåras många gånger av att sjukdomsbilden initialt kan vara diffus. Följsamhet till behandlingsriktlinjer kan förbättra prognosen. Åtskilliga liv beräknas kunna räddas globalt om fler patienter behandlas enligt riktlinjerna i Surviving Sepsis Campaign [1, 2].
Också i Sverige finns utrymme för förbättring [3]. God kunskap om tidig upptäckt och initial behandling är därför viktig.
Definition
Sepsis har tidigare definierats som överdriven inflammation (systemiskt inflammatoriskt svarssyndrom, SIRS) orsakad av infektion med undergrupperna svår sepsis (infektionsorsakad akut organdysfunktion) och septisk chock (infektionsorsakad vätskerefraktär cirkulationssvikt) [4].
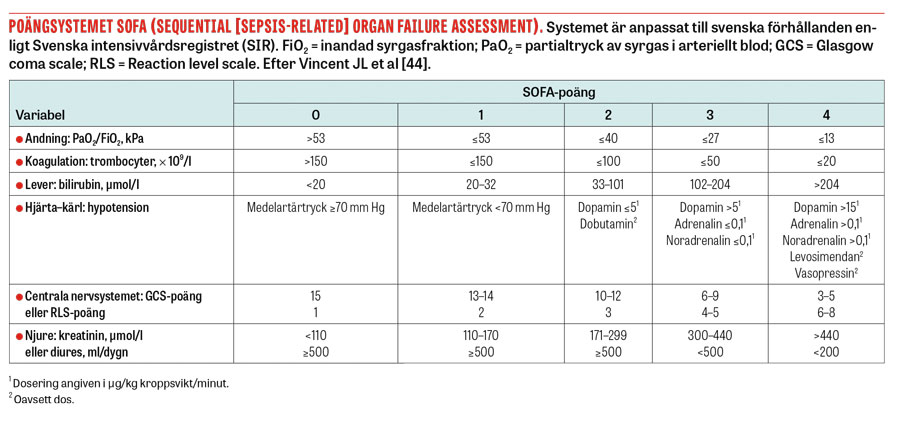
I februari 2016 presenterades nya definitioner för sepsis hos vuxna [5]. De nya definitionerna betonar att sepsis är livshotande jämfört med infektion utan sepsis. Sepsis definieras numera som infektion med livshotande organdysfunktion orsakad av felreglerat systemiskt immunsvar [5]. Eftersom organdysfunktion ingår i definitionen stryks begreppet svår sepsis. Organdysfunktionen graderas utifrån poängsystemet SOFA (Sequential [sepsis-related] organ failure assessment). Kliniskt definieras sepsis som en ökning med ≥2 SOFA-poäng på basis av misstänkt infektion. Det är värt att betona att bakteriemi liksom tidigare inte ingår i definitionen av sepsis.
För att underlätta klinisk bedömning av patienter inom öppenvård och ambulansverksamhet samt på akutmottagning eller vårdavdelning lanserades den förenklade qSOFA (Quick SOFA) för att identifiera patienter med sämre prognos, men ytterligare validering behövs [5, 6]. Mätning av laktat förbättrade inte det prediktiva värdet av qSOFA men rekommenderas för att identifiera patienter med intermediär risk, för att vägleda terapi och som indikator på sjukdomens allvarlighetsgrad [5-7].
Septisk chock definieras nu som en undergrupp av sepsis, där cirkulatoriska och metabola förändringar är så pass uttalade att de innebär en påtagligt förhöjd mortalitetsrisk jämfört med sepsis utan chock [8]. Kliniskt definieras septisk chock som att det trots adekvat vätskebehandling föreligger ett laktatvärde >2 mmol/l samt ett behov av vasopressorbehandling för att upprätthålla medelartärtryck >65 mm Hg [8].
Epidemiologi
Svåra infektioner kan drabba alla människor, men hög ålder [9] och förekomst av samsjuklighet är kopplade till ökad förekomst av sepsis [10].
En ökning med ≥2 SOFA-poäng är kopplad till en sjukhusmortalitet på >10 procent [5]. Vid septisk chock är sjukhusmortaliteten >40 procent [5]. Mortaliteten vid sepsis har sjunkit över tid [11], troligtvis på grund av snabbare upptäckt och behandling. Positiva blododlingar förekommer endast i cirka en tredjedel av fallen [12].
Förekomsten av sepsis och septisk chock enligt de nya definitionerna är ännu inte tillräckligt utredd. Enligt de gamla definitionerna drabbades ca 3 av 1 000 personer i USA årligen av sepsis [13], och i en holländsk studie konstaterades 29,5 procent av intensivvårdade patienter ha svår sepsis vid en specifik tidpunkt [9].
Incidensen i Sverige är ofullständigt känd, delvis eftersom diagnoskodningen för sepsis inte används fullt ut och slutsatser därför blir svåra att dra utifrån registerdata [3, 14].
Orsaker
Vid samhällsförvärvad sepsis är Escherichia coli, Staphylococcus aureus, pneumokocker, grupp A-streptokocker, meningokocker och Haemophilus influenzae de viktigaste patogenerna [14]. Vårdrelaterad sepsis kan orsakas av betydligt fler patogener, t ex olika Enterobacteriaceae, enterokocker och Pseudomonas aeruginosa, och orsakas oftare av mer resistenta patogener [14, 15].
Vanligaste infektionsfokus för patienter som inkommer via medicinsk akutmottagning är i fallande ordning lunga, urinvägar och buk samt hud och mjukdelar [16]. Okänt fokus är också vanligt förekommande [3, 14].
Initial diagnostik
Ansvarig läkare ska bedöma 1) om en infektion föreligger och 2) graden av systempåverkan genom att utgå från anamnes och symtom i kombination med vitalparametrar och laboratorieprov. Om läkaren endast konstaterar att en infektion föreligger utan att ta tillräcklig hänsyn till systempåverkan riskerar patienten att få felaktig och/eller fördröjd antibiotikabehandling. Om läkaren å andra sidan noterar en allvarlig systempåverkan utan att uppfatta att det rör sig om en infektion, t ex hos en äldre afebril patient [17], kanske läkaren inkorrekt avstår från antibiotika.
Måttlig systempåverkan visar sig ofta som matthet och sjukdomskänsla, feber och takykardi. Tecken som bör tas som varningssignaler för svår systempåverkan är hypotermi, medvetandesänkning, konfusion, förhöjd andningsfrekvens, minskad syresättning av blodet, blodtrycksfall och förhöjt laktatvärde. Dessa tecken är inte specifika för infektioner, och det är en utmaning att diagnostisera fall där fokala infektionstecken är subtila eller saknas. CRP-stegring och LPK-stegring med neutrofilövervikt (eller LPK-sänkning) talar för bakteriell infektion, men i synnerhet CRP-värdet är ofta lågt eller måttligt förhöjt om patienten söker tidigt i förloppet.
Initial behandling
Eftersom specifik behandling för sepsis saknas, består framgångsrik initial behandling av två viktiga principer: organstödjande respektive antimikrobiell behandling. I organstödjande behandling ingår rätt volym intravenös vätska given tidigt i förloppet och tidig effektiv syrgasbehandling. Den antimikrobiella behandlingen utgörs av tidigt insatt behandling med adekvata antibiotika i tillräcklig dos.
Organstödjande behandling
Tidigt insatt intensiv vätskebehandling har visats rädda liv vid sepsis och septisk chock [1, 18]. Alla patienter med misstänkt sepsis ska skyndsamt ges intravenös vätska. Kristalloida lösningar rekommenderas [1, 15, 19], i första hand Ringer-acetat [14, 20]. Isoton natriumkloridlösning bör undvikas eftersom den kan orsaka hyperkloremisk acidos [21, 22], öka risken för njursvikt [23] och har associerats med ökad mortalitet [24].
Kolloida lösningar har bättre volymexpanderande effekt än kristalloida lösningar, vilket innebär lägre infusionsbehov och mindre vävnadsödem [25], men har inte visats ha några fördelar avseende överlevnad [1, 19, 26]. Preparaten har också flera nackdelar (beroende på typ av preparat), t ex ökade kostnader, risk för allergiska reaktioner, koagulopati och/eller påverkan på inflammatoriska processer [14, 19, 26, 27]. Kolloiden hydroxietylstärkelse (HES) har visats öka risken för njursvikt och död och ska därför inte alls användas [1, 14, 28-30]. Sammanfattningsvis rekommenderas inte kolloida lösningar för initial behandling av patienter med sepsis eller septisk chock [1, 14].
Ofta måste stora volymer vätska ges omedelbart och infunderas snabbt. Denna intensiva behandlingsstrategi har ifrågasatts på senare tid, och ett mer konservativt tillvägagångssätt med fokus på hemodynamiskt vätskesvar och tidigare behandling med noradrenalin har föreslagits [20].
Syrgas bör ges generöst tidigt eftersom hypoxi bidrar till organsvikt. Vid måttlig hypoxi (SpO2 91–95 procent) ges 2–3 l O2 via näsgrimma, medan ansiktsmask med 5–15 l O2 bör användas vid mer uttalad hypoxi (SpO2 ≤90 procent). Målvärde för SpO2 är >93 procent eller patientens habituella värde [14].
Antimikrobiell behandling
Efter påbörjad vätskebehandling ska antibiotika ges skyndsamt. Odlingar och vidare utredning av fokus för infektionen (inklusive röntgen) får inte fördröja insättandet av antibiotika [1]. En ofta citerad studie från 2006 fann att fördröjd adekvat antibiotikabehandling vid septisk chock ledde till minskad överlevnad med 8 procent per timme de första 6 timmarna och var den faktor som i högst grad påverkade prognosen [31]. Målet är att antibiotika ska ges inom 1 timme från ankomst till akuten eller identifiering på vårdavdelning [1, 14].
Dessa mål har ifrågasatts i en senare metaanalys där tidigt given antibiotikabehandling inte medförde signifikant bättre överlevnad [32]. Eftersom patienterna i de studier som ingick inte var randomiserade till att få antibiotika vid en viss tidpunkt, kan det dock misstänkas att de som fick antibiotika tidigt i genomsnitt var sjukare än de som fick antibiotika sent.
Ju svårare sjuk en patient är, desto viktigare är det att det initiala antibiotikavalet blir rätt. Felaktigt initialt antibiotikaval leder till högre mortalitet [33]. En svårt sjuk patient ska initialt ha bred empirisk antibiotikabehandling, oavsett misstänkt fokus eller agens. Tidig kontakt med infektionsläkare bör tas (utan att fördröja antibiotikabehandlingen).
Antibiotikavalet [14, 34] bör baseras på faktorer som misstänkt infektionsfokus, infektionens svårighetsgrad, underliggande sjukdomar, pågående eller nyligen avslutad antibiotikabehandling, vårdhistoria, epidemiologiska data och eventuell kännedom om kolonisering med svårbehandlade patogener.
Kombinationsbehandling med betalaktamantibiotika och aminoglykosid är omdiskuterad [14, 35]. Kombinationsbehandling har visats reducera mortaliteten vid septisk chock [36, 37] men öka mortaliteten hos patienter utan allvarlig infektion [37]. Utifrån detta rekommenderas kombinationsbehandling med betalaktamantibiotika med brett spektrum och aminoglykosid vid manifest septisk chock, vid sepsis där det finns risk att septisk chock utvecklas och vid misstanke om sepsis orsakad av multiresistent gramnegativ bakterie [14, 35]. Vid misstanke om multiresistent gramnegativ bakterie är amikacin den rekommenderade aminoglykosiden [35].
På grund av ökad distributionsvolym och vävnadshypoperfusion vid septisk chock och dess förstadier krävs höga laddningsdoser av antibiotika för att uppnå tillräckliga vävnadskoncentrationer [38-40]. För betalaktamantibiotika ska MIC (minsta antibiotikakoncentration som förhindrar bakterietillväxt) överstiga en tillräckligt stor del av dosintervallet, varför upprepade administrationstillfällen under dygnet krävs [41]. Utifrån detta rekommenderas en extra dos betalaktamantibiotika efter halva dosintervallet mellan första och andra ordinarie dosen [14]. Aminoglykosiders bakterieavdödande effekt korrelerar däremot bäst med högsta serumkoncentration (Cmax), och de ska därför ges som en hög bolusdos 1 gång/dag [14, 35, 42].
Initialt ska dosering av antibiotika inte styras av njurfunktion utan av förmodad distributionsvolym och infektionsfokus [1, 14], medan fortsatt antibiotikadosering ska ske med hänsyn till njurfunktion och idealt med koncentrationsbestämningar på grund av de uttalade skillnader i farmakokinetik som kan ses vid svår sjukdom [38, 43]. Aminoglykosider ges oftast som engångsdos, och en första dos tolereras som regel av alla [14, 35]. Vid upprepad dosering finns ökad risk för skador på njurar och hörsel, och det är därför viktigt med koncentrationsbestämningar [35]. Vid känd hörselskada eller svår njursvikt bör aminoglykosider undvikas [35].
Övrig behandling
Steroider rekommenderas initialt endast till patienter med känd binjurebarkssvikt eller pågående steroidbehandling. Ofta ges 50–100 mg hydrokortison som initial dos [1, 14].
Fortsatt handläggning
Efter initial behandling och stabilisering är det viktigt att snabbt – inom 12 timmar [1] – åtgärda eventuellt underliggande infektionsfokus, t ex avlägsna infekterade katetrar, dränera abscesser, åtgärda läckande tarmanastomoser osv.
Risken för att utveckla organdysfunktion och cirkulationssvikt är störst inom 1 dygn efter ankomst till sjukhus [14] och nödvändiggör tät övervakning av vitalparametrar och fortsatt intravenös vätskebehandling under det första dygnet även om målvärdena nås och patienten stabiliserats. Hos patienter som primärt inte bedömts som intensivvårdskrävande men som uppfattas vara instabila bör kontroll av vitalparametrar ske var 15–30:e minut, och dessa patienter bör vårdas där sådana resurser finns. Om ingen förbättring sker bör intensivvårdsläkare kontaktas. Övriga patienter kan i regel övervakas på vårdavdelning med kontroll av vitalparametrar initialt 1 gång/timme. Trender i mätvärden är väl så viktiga som ett enstaka avvikande värde, och omvårdnadspersonalen bör ha tydliga riktlinjer för åtgärder vid försämring.
Ny läkarbedömning med utvärdering av behandlingsresultat bör ske inom 3–6 timmar efter behandlingsstart [14]. Kontrollera att patienten behandlas med adekvata antibiotika i tillräcklig dos, kontrollera laktatvärdet och ta ställning till behov av att åtgärda infektionsfokus. Vid tydlig förbättring kan kontroller därefter glesas ut.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.






![Förslag på algoritm för identifiering av sepsis och septisk chock [5]](https://lakartidningen.se/wp-content/uploads/EditorialFiles/3Z/%5bED3Z%5d/2016-027_02_webb.jpg)
![Initial handläggning [45]](https://lakartidningen.se/wp-content/uploads/EditorialFiles/3Z/%5bED3Z%5d/2016-027_fakta-2_webb.jpg)
![Vanliga fallgropar vid bedömningen [14]](https://lakartidningen.se/wp-content/uploads/EditorialFiles/3Z/%5bED3Z%5d/2016-027_fakta-3_webb.jpg)


![Förslag på algoritm för vätskebehandling [14]](https://lakartidningen.se/wp-content/uploads/EditorialFiles/3Z/%5bED3Z%5d/2016-027_03_webb.jpg)




















