Infektiös endokardit är en förhållandevis ovanlig diagnos med cirka 500 fall årligen i Sverige, vilket motsvarar en incidens på 5 per 100 000 invånare [1, 2]. Endokardit engagerar hjärtats innersta hinna, endokardiet, företrädesvis klaffarna. Sjukdomen uppstår i samband med bakteriemi, framför allt hos predisponerade individer. Svamporsakad infektiös endokardit förekommer också, men är mycket ovanlig. Ett tidigare klaffvitium ökar risken drastiskt, liksom förekomst av klaffprotes (mekanisk eller biologisk), men är inte obligat för utveckling av sjukdom. Särskilt S aureus-endokardit drabbar individer utan tidigare känt vitium [3].
En fråga som genom åren varit kontroversiell är om antibiotikaprofylax ska ges inför exempelvis odontologiska ingrepp för att minska endokarditrisken hos predisponerade individer. Internationell konsensus saknas, och evidensläget har bedömts som svagt både för att rekommendera och avråda från antibiotikaprofylax. Gällande riktlinjer från Läkemedelsverket förordar ingen generell profylax utan uppmanar till individuell bedömning av patienter med hög risk att utveckla endokardit i samband med transient bakteriemi [4].
Diagnosen infektiös endokardit baseras på kliniska, mikrobiologiska och ekokardiografiska tecken enligt Duke-kriterierna [5]. Nyare avbildningsmodaliteter (18F-FDG [fluor-18-märkt fluordeoxiglukos]-positronemissionstomografi [PET]/datortomografi [DT]) har föreslagits av European Society of Cardiology, men inte inkluderats i Duke-kriterierna [6].
Obehandlad har infektiös endokardit ofta dödlig utgång, men effektiv behandling finns. Mortaliteten i svenska material (enligt Endokarditregistret) uppgår till 10–12 procent [1]. Endokardit kan delas in i en akut och en mer subakut form, vilka i stort reflekterar virulensen hos orsakande agens. Denna indelning säger dock lite om prognos och behandling. Kliniskt är det därför av större värde att indela sjukdomen i fyra olika grupper:
- Vänstersidig infektiös endokardit i nativ klaff
- Strikt högersidig infektiös endokardit i nativ klaff
- Protesendokardit
- Infektion i pacemakersystem/implanterbar kardiell defibrillator (berörs inte i denna artikel)
Hörnstenen i behandlingen är antibiotika i höga doser under lång tid, men i många fall blir även toraxkirurgi aktuell. I Sverige hanteras patienterna i allmänhet på infektionsklinik, och oftast sköts hela behandlingen inneliggande. I utvalda fall kan poliklinisering övervägas efter två veckor – enligt nuvarande rekommendationer primärt vid okomplicerad endokardit orsakad av alfa-hemolyserande streptokocker [1].
För optimal handläggning krävs ett nära samarbete mellan infektionsläkare, kardiolog, klinisk fysiolog, klinisk mikrobiolog och toraxkirurg. På regionsjukhusen organiseras detta samarbete i form av ett endokarditteam bestående av representanter från berörda specialiteter.
Diagnostik
Symtom och tecken
Infektiös endokardit är ett tillstånd med stor symtomvariation och utgör därför en diagnostisk utmaning. Symtomen härrör från fyra patofysiologiska mekanismer [6]:
- Lokal infektion i endokardiet
- Systemisk infektion/bakteriemi
- Embolisering till andra organ (exempelvis centrala nervsystemet, njurar, skelett)
- Uppreglering av immunförsvaret med cirkulerande immunkomplex.
Söksymtomen kan därmed vara mycket olika beroende på vilken mekanism som dominerar, och därför är det viktigt att ha diagnosen under aktivt övervägande – även vid symtom som inte ter sig primärt infektiösa. Detta gäller i synnerhet hos personer med intravenöst missbruk.
Feber är ett kardinalsymtom (85–90 procent), men saknas ibland hos äldre och kraftigt immunsupprimerade patienter. Nytillkommet insufficiensblåsljud är ett så kallat huvudkriterium och bör vid febril infektion väcka misstanke om endokardit. På grund av sjukdomens epidemiologi – med stor överrepresentation av äldre och patienter med tidigare känt klaffvitium – är det dock mycket vanligt med preexisterande blåsljud. Hos 15–20 procent av patienterna (särskilt med akut och högersidig infektiös endokardit) saknas blåsljud helt [7].
Mikrobiologi
Förutom anamnes och kliniska fynd är det också viktigt att utifrån mikrobiologiska resultat överväga infektiös endokardit. Grampositiv bakteriemi bör alltid inge misstanke och föranleda fortsatt utredning, liksom fynd i blododling av HACEK-gruppens bakterier. Misstanken stärks ytterligare vid förekomst av en eller flera av följande riskfaktorer: samhällsförvärvad infektion utan känt fokus, intravenöst missbruk, predisponerande klaffvitium eller klaffprotes/pacemaker/implanterbar kardiell defibrillator. Särskild uppmärksamhet bör iakttas vid S aureus-bakteriemi. Tumregeln är att dessa patienter ska handläggas i samråd med infektionsläkare, och ekokardiografisk utredning bör övervägas hos samtliga. Den optimala tidpunkten för att initiera utredning är omdiskuterad, men tillgängliga data talar för att en riskstratifiering vid dag 1 och dag 5 kan utgöra ett effektivt användande av resurser utan att signifikant försena angelägen handläggning eller försämra den diagnostiska träffsäkerheten [8].
Frånvaro av detekterbar bakteriemi gör inte att infektiös endokardit kategoriskt kan uteslutas. I en ansenlig mängd av endokarditfallen är blododlingar negativa, 19–27 procent enligt svenska siffror [9]. Även vid blododlingsnegativ endokardit förmodas dock bakteriemi föreligga, även om den av någon anledning inte kan detekteras. Detta kan bero på att orsakande agens är svårodlat/långsamväxande, exempelvis propionibakterier vid förekomst av klaffprotes [10]. Alternativt kan bakteriemin ha maskerats genom att patienten getts antibiotika före provtagningstillfället. Falskt negativt resultat kan också uppstå vid otillräcklig mängd material eller felaktig preanalytisk hantering av provet.
Bilddiagnostik
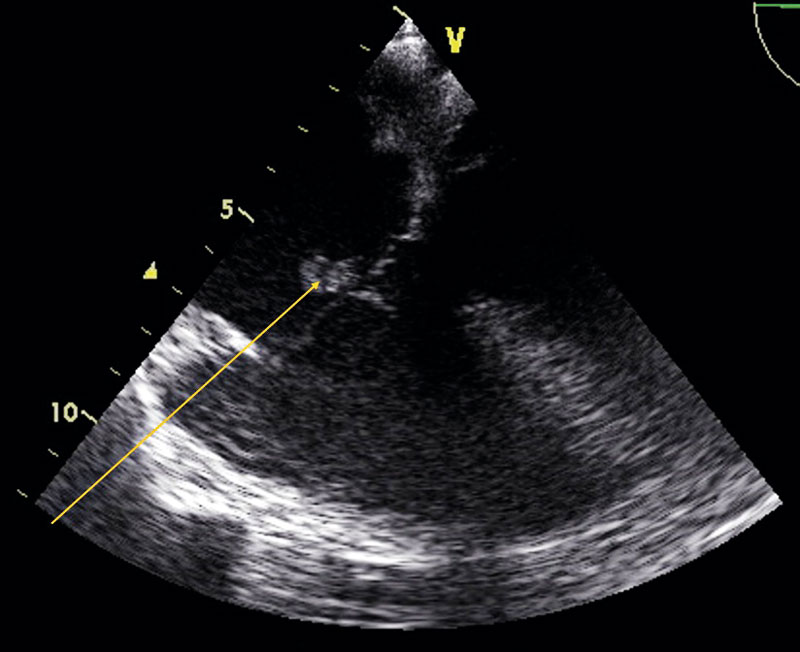
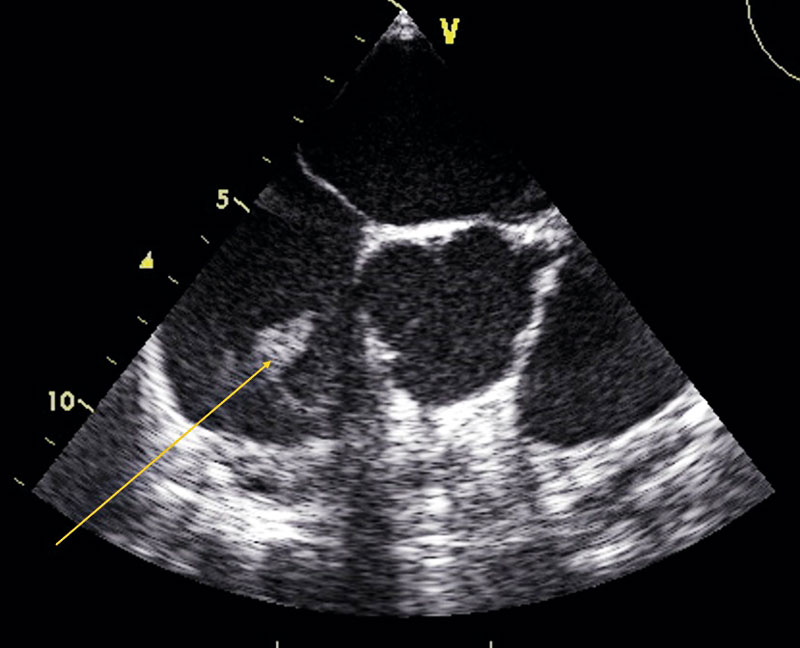
Om kliniska eller mikrobiologiska parametrar ingett misstanke om endokardit drivs utredningen vidare med ekokardiografi, som kan utföras transtorakalt eller transesofagealt. Med transesofageal ekokardiografi kommer ultraljudproben betydligt närmare hjärtat, vilket möjliggör högre upplösning och bättre visualisering av samtliga klaffar, även vid förekomst av protesmaterial i området. Metoden medför större obehag, är mer resurskrävande, och är därtill förenad med risker hos patienter med ökad blödningsbenägenhet generellt (antikoagulantia, koagulopatier) eller lokalt (esofagusvaricer). Den tekniska utvecklingen har också bidragit till en större diagnostisk precision med transtorakal modalitet, vilket gör att transtorakal ekokardiografi i gällande riktlinjer anses tillfyllest för att utesluta infektiös endokardit vid nativ klaff och goda transmissionsförhållanden. Vid närvaro av klaffprotes anses transesofageal ekokardiografi fortfarande överlägsen.
En pragmatisk metod är att i alla lägen börja med transtorakal ekokardiografi. Vid goda transmissionsförhållanden och låg klinisk endokarditmisstanke kan utredningen avbrytas vid negativt fynd. Vid positivt fynd, diagnostisk tveksamhet, ogynnsamma transmissionsförhållanden, komplicerande faktorer eller stark klinisk misstanke kompletteras utredningen med transesofageal ekokardiografi – gärna i samma seans [11]. Den optimala tidpunkten för ekokardiografi får bedömas individuellt. Vid tecken till hjärtsvikt bör undersökning göras utan dröjsmål. Detsamma gäller hos patienter med hög risk för endokardit. Hos patienter med låg till medelhög risk kan dock utredningen med fördel genomföras efter fem dygns aktiv observation.
I gällande europeiska riktlinjer framhålls andra avbildningsmodaliteter. Paravalvulära lesioner vid EKG-triggad DT utgör här ett huvudkriterium för endokarditdiagnosen. Vid förekomst av klaffprotes förordas 18F-FDG-PET, där onormalt upptag kring protesen eftersöks [6]. I svenska riktlinjer (baserade på Duke-kriterierna) är ekokardiografi alltjämt den enda bilddiagnostiska modalitet som utgör diagnosunderlag [1].
Behandling
Effektiv behandling av infektiös endokardit förutsätter att orsakande agens elimineras. Detta åstadkoms med hjälp av antibiotika, som ordineras utifrån tillgängliga odlingssvar och anpassas utifrån resistensbestämning. I vissa fall uppnås inte god infektionskontroll med enbart antibiotika, och då krävs kirurgi för att debridera infekterat material och dränera eventuella abscesser. Bakterier inneslutna i en vegetation är svårtillgängliga för immunförsvaret, som inte kan förväntas bidra i någon större utsträckning. Därför rekommenderas antibiotika med baktericid (bakterieavdödande) snarare än bakteriostatisk (bakteriehämmande) effekt. Det anses därtill föreligga en koncentrationsgradient mellan blodbanan och vegetationen, och följaktligen ett behov av höga serumkoncentrationer för att erhålla en adekvat baktericid effekt. Enligt samma resonemang administreras antibiotika vid infektiös endokardit i högre doser och med kortare doseringsintervall jämfört med de flesta andra indikationer [12]. För att åstadkomma adekvata doser och för att eliminera absorptionens inverkan gör nuvarande rekommendationer gällande att hela behandlingen ska ges intravenöst. En ny dansk studie har dock visat att peroral behandling kan vara lämplig under senare delen av endokarditbehandlingen hos ett selekterat urval av stabila patienter [13].
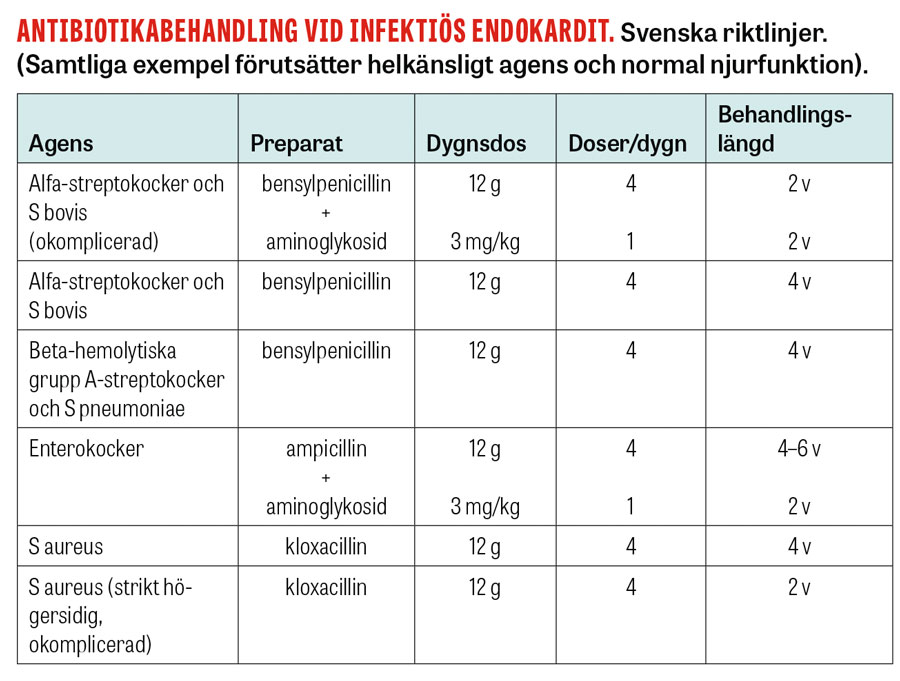
Antibiotikabehandling med föreslagna doser och behandlingslängder vid olika agens (enligt svenska riktlinjer) sammanfattas i tabellen intill. I de flesta fall rekommenderas 4 veckors behandling. I vissa fall (strikt högersidig infektiös endokardit orsakad av S aureus och okomplicerad infektiös endokardit orsakad av alfa-hemolyserande streptokocker) är 2 veckor tillfyllest. Vid komplicerad infektiös endokardit och vid förekomst av protesmaterial krävs 6 veckor, eller i särskilda fall ännu längre [14].
Penicilliner utgör förstahandsval i de fall där det är lämpligt. Dessa preparat utmärker sig genom sin baktericida effekt och låga toxicitet, vilket är viktigt mot bakgrund av den höga kumulativa dos för vilken patienten exponeras under (2–) 4 (–6) veckors endokarditbehandling. Vankomycin är ett beprövat alternativ vid naturliga eller förvärvade penicillinresistenta organismer, liksom i de fall då penicillin inte tolereras. Daptomycin kan vara ett terapeutiskt alternativ till vankomycin vid infektiös endokardit orsakad av meticillinresistenta S aureus. Jämfört med penicillinerna har det dock ett snävare terapeutiskt fönster och är behäftat med fler biverkningar. Rifampicin är aktuellt som tillägg vid protesendokardit på grund av sin goda effekt på bakterier i biofilm, men ska inte användas som singelterapi på grund av risk för resistensutveckling.
Aminoglykosider kan övervägas som tilläggsterapi för att förkorta behandlingsdurationen vid alfa-streptokockendokardit. De uppvisar också synergi med cellväggsaktiva antibiotika (exempelvis penicillin och vankomycin) vid enterokockendokardit. Aminoglykosidernas nefro- och ototoxiska effekter är dock välkända; vid längre tids användning är det därför viktigt att noggrant monitorera serumkoncentrationer och att kontinuerligt väga risken mot nyttan.
Indikationer för toraxkirurgi
Ungefär 13 procent av alla patienter med infektiös endokardit i Sverige genomgår toraxkirurgisk intervention i tillägg till antibiotikabehandling [2]. Internationellt ligger siffran högre, omkring 50 procent [3]. Kirurgi kan förbättra överlevnaden i komplicerade fall, men kan vara tekniskt svår, och det föreligger hög risk för postoperativa komplikationer och recidiv. Det är därför angeläget att, i samråd med övriga berörda specialiteter, väga risk mot nytta i varje enskilt fall [15]. Operationsindikationerna vid infektiös endokardit redovisas i ruta på föregående sida.
Sammanfattningsvis är toraxkirurgisk kompetens viktig i hanteringen av de mest komplicerade fallen. Tröskeln för kontakt med sådan enhet bör vara låg, och vidtas omgående vid tecken på att förloppet avviker från det förväntade.
Uppföljning
I Sverige erbjuds som regel ett återbesök till patientansvarig läkare cirka en månad efter utskrivning. Inför återbesöket kontrolleras rutinblodprov inklusive inflammations- och njurprov. Vid besöket genomförs, förutom sedvanlig kliniskt status, en anamnestisk genomgång av det många gånger traumatiska sjukdomsförloppet. Patienten instrueras om att genomgången endokardit är en riskfaktor för reinfektion, och om vikten av att uppsöka sjukvården vid framtida uppkomst av symtom som vid infektiös endokardit. Särskilt eftersöks anamnesuppgifter och statusfynd talande för persisterande hjärtsvikt eller klaffvitium. Om indicerat remitteras patienten för fortsatt utredning och uppföljning vid lämplig instans.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Duke-kriterierna för diagnos av infektiös endokardit
För klinisk diagnos av infektiös endokardit krävs
– två huvudkriterier, alternativt
– ett huvud- och tre bikriterier, alternativt
– fem bikriterier.
Huvudkriterier:
- Fynd av mikroorganism typisk för infektiös endokardit i två olika blododlingar eller fynd av mikroorganism förenlig med infektiös endokardit i upprepade blododlingar
- Ekokardiografiska hållpunkter för endokardiellt engagemang
- Nytt insufficiensblåsljud (förändrat preexisterande blåsljud inte tillräckligt)
Bikriterier:
- Predisponerande hjärtsjukdom eller intravenöst missbruk
- Feber (här definierat som kroppstemperatur >38 °C)
- Tecken på septisk embolisering i form av arteriell emboli, septisk lungemboli, mykotiskt aneurysm, konjunktival blödning, kutana mikroabscesser (s k Janeway lesions)
- Immunologiska fenomen i form av glomerulonefrit, deposition av immunkomplex i huden (s k Oslers noduli), immunkomplexmedierad retinal vaskulit (s k Roth spots), reumatoid faktor
- Mikrobiologiska fynd förenliga med infektiös endokardit, men som inte uppfyller huvudkriterium (enstaka positiv odling eller serologiska tecken på mikroorganism förenlig med diagnosen)
Mikroorganismer förenliga med infektiös endokardit
Fynd av följande bakterier i blododling bör väcka misstanke om endokardit:
- Staphylococcus aureus
- Alfa-hemolyserande streptokocker
- Streptococcus bovis
- HACEK (här avses bakterier tillhörande arterna Haemophilus, Aggregatibacter, Cardiobacterium, Eikenella och Kingella)
- Enterokocker.
Misstanken stärks ytterligare vid samhällsförvärvad infektion utan fokus, samt vid upprepad växt trots insatt behandling. I dessa sammanhang bör infektiös endokardit misstänkas även vid andra agens än ovan nämnda. Konsultera infektionsspecialist vid behov.
Ekokardiografiska fynd förenliga med infekiös endokardit
Förekomst av följande ekokardiografiska förändringar ger stöd för endokarditdiagnos och uppfyller huvudkriterium:
- Oscillerande förändring (vegetation) på klaff, stödjevävnad eller implanterat material
- Abscess
- Nytillkommen avlossning av klaffprotes (paravalvulärt läckage).
Överväg förnyad ekokardiografi vid försämring eller utebliven förbättring. Observera att ovanstående förändringar kan vara svåra att visualisera vid sklerotiskt förändrade klaffar, varvid endokardit inte kan uteslutas ekokardiografiskt.
Indikationer för toraxkirurgi vid infektiös endokardit
- Hjärtsvikt. Ses i varierande grad hos upp till 60 procent av patienterna, vanligast vid aortaklaffendokardit. Beror vanligen på nedsmältning av klaffen med akut insufficiensutveckling. Det förekommer även obstruktion av utflödet, till exempel vid abscess.
- Okontrollerad infektion. Här ingår lokalt okontrollerad infektion (framför allt abscessutveckling), systemiskt okontrollerad infektion (persisterande feber alternativt bakteriemi trots adekvat antibiotikabehandling) samt hyperresistent organism (Pseudomonas aeruginosa, svampar, vissa koagulasnegativa stafylokocker och vissa intracellulära bakterier).
- Emboliförebyggande. Den viktigaste prediktorn för embolisering under sjukdomsförloppet är vegetationens storlek: >10 mm är associerat med ökad embolitendens.
Konsensus
De flesta är ense om att
- infektiös endokardit är ett potentiellt dödligt tillstånd som är viktigt att snabbt identifiera för att minska mortalitet och morbiditet
- behandling innefattar en långvarig kur med antibiotika i hög dos
- diagnosen baseras på ett flertal kliniska, mikrobiologiska och ekokardiografiska kriterier
- optimalt omhändertagande kräver nära samarbete mellan berörda kliniska och diagnostiska specialiteter.
Åsikterna går isär vad gäller
- nödvändigheten av intravenösa antibiotika under hela behandlingen
- betydelsen av nyare avbildningstekniker i diagnostiken
- endokarditprofylax vid operativa ingrepp.