De flesta är ense om att
- paroxysmal sympatisk hyperaktivitet uppträder med sex huvudsymtom: takykardi, takypné, hypertension, hypertermi, hyperhidros och episodisk hög muskeltonus
- det är av största vikt att utesluta andra bakomliggande orsaker till symtomen
- diagnoskriterier finns framtagna för att identifiera och diagnostisera paroxysmal sympatisk hyperaktivitet
- behandlingen är farmakologisk och icke-farmakologisk, oftast multimodal
- tillståndet troligtvis är underdiagnostiserat och ökad medvetenhet behövs.
Det råder delade meningar gällande
- individuella skillnader i patofysiologin som inte är helt kartlagda
- optimal behandling på grund av individuella skillnader mellan patienterna.
Paroxysmal sympatisk hyperaktivitet (PSH) är ett tillstånd som främst beskrivits efter traumatisk hjärnskada och är även känt under beteckningarna »autonom storm« och »dysautonomi« [1]. Tillståndet drabbar mellan 8 och 10 procent av patienter efter traumatisk hjärnskada, men kan också drabba patienter efter andra neurologiska åkommor såsom anoxisk hjärnskada, stroke, tumörer eller infektioner [2-4]. Hos en patient med misstänkt paroxysmal sympatisk hyperaktivitet är det viktigt att utesluta andra tillstånd såsom sepsis, abstinenssymtom och lungemboli för att undvika felbehandling. Tillståndet är vanligare hos män och yngre vuxna patienter [4].
För nästan ett sekel sedan publicerade Penfield en fallbeskrivning där en patient med traumatisk skallskada uppvisade paroxysmala episoder av sympatisk hyperaktivitet [5]. 2010 publicerade Perkes et al en större serie med 349 identifierade fall med det gemensamma fenomenet sympatisk hyperaktivitet med symtom såsom takykardi, förhöjt blodtryck, ökad andningsfrekvens, ökad muskeltonus, ökad kroppstemperatur och svettningar [6]. Sedan dess har tillståndets karaktär, symtombild och patofysiologi kartlagts, och verktyg för att ställa diagnos har utformats.
Paroxysmal sympatisk hyperaktivitet kan som tidigare nämnts ses efter flera olika tillstånd, och specialiteter som kan bli inblandade i vården omfattar neurologi/stroke, neurokirurgi, rehabiliteringsmedicin, allmänmedicin, infektion och intensivvård. En ökad medvetenhet behövs genom alla steg i vårdkedjan eftersom tillståndet kan kvarstå under flera veckor, månader och år.
Patofysiologi
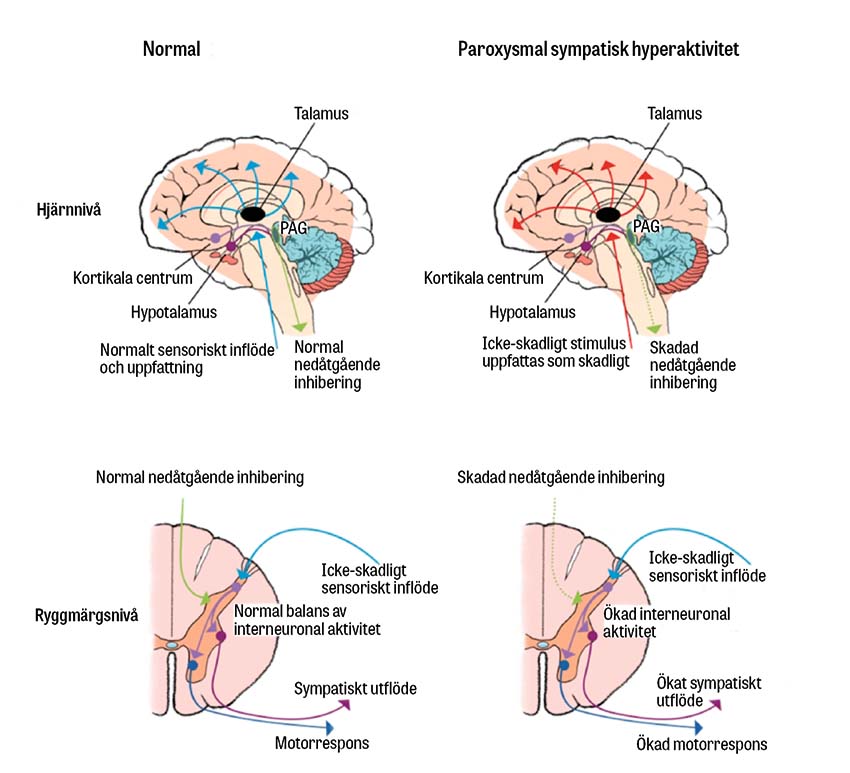
Den autonoma dysregleringen hos patienter med paroxysmal sympatisk hyperaktivitet tros vara resultatet av funktionella felkopplingar relaterade till skador i djupa hjärnstrukturer [1]. Baguley et al presenterade 2008 den excitatoriska–inhiberande modellen (excitatory–inhibitory ratio model, EIR) hos patienter med överlappande tillstånd som involverar autonom hyperaktivitet [7]. I modellen förklaras de vanligaste symtomen (ökad motoraktivitet och sympatisk hyperaktivitet) genom två parametrar som agerar på ryggmärgsnivå genom modulering från högre centrum. Den första av dessa parametrar är omfattningen och ökningstakten mellan excitatoriska och inhibitoriska influenser som modulerar spinala afferenta signaler (EIR), och den andra parametern är individens tendens att utveckla en överreaktion på icke-smärtsamt stimulus som respons på förändringen [7].
Mekanismerna bakom paroxysmal sympatisk hyperaktivitet inkluderar en genererad sympatisk tonus i hjärnstam, hypotalamus och ryggmärgen, samtidigt som det föreligger en inhiberad sympatisk signalering från kortikala regioner, vilket omfattar insulär kortex, dorsolateral prefrontal kortex, hippokampus och amygdala [8]. Det förekommer teorier om att paroxysmal sympatisk hyperaktivitet inträffar i tre stadier, där det första ofta är asymtomatiskt på grund av tung sedering. I andra stadiet observeras debut av symtomkluster och i tredje stadiet ses en tillbakagång av episodisk hög muskeltonus och dystoni [1].
Kliniska aspekter
Den kliniska bilden utgörs av ett spektrum med sex huvudsymtom som orsakas av både sympatisk och motorisk hyperaktivitet. Symtomen inkluderar takykardi, takypné, hypertension, hypertermi, hyperhidros och ökad muskeltonus. Dock är bilden komplex, och individuella skillnader mellan patienter föreligger, men takykardi verkar förekomma hos majoriteten av patienterna [4, 9-11]. Mellan 8 och 10 procent av patienter med traumatisk hjärnskada har angetts drabbas av paroxysmal sympatisk hyperaktivitet [3, 4].
Paroxysmal sympatisk hyperaktivitet uppkommer inom 1 vecka efter skadetillfället, och incidensen minskar allt eftersom patienterna återhämtar sig efter sin hjärnskada [12, 13]. Episoder med sympatisk hyperaktivitet har i studier visat sig vara mellan få minuter upp till två timmar; dock varierar detta mellan individer, och det finns även beskrivningar av att det inträffar omkring sex gånger per dag [4, 10, 14]. Symtomen börjar oftast när patienterna fortfarande är kvar på intensivvårdsavdelningen, då med risk för feldiagnostisering. I akutfasen är det viktigt att utesluta andra orsaker till den kliniska symtombilden som kan kräva annan behandling [15].
De flesta patienter återhämtar sig från paroxysmal sympatisk hyperaktivitet inom ett par veckor, medan de svårare fallen med behandlingskrävande symtom kan kvarstå i flera veckor, månader eller år efter skadan samt under rehabiliteringsfasen [4, 12]. Tillståndet är även associerat med viktnedgång, troligtvis på grund av ökad muskeltonus. Det tycks föreligga en korrelation mellan allvarlighetsgraden av hjärnskadan och paroxysmal sympatisk hyperaktivitet, där studier har visat att patienter med hjärnskada och paroxysmal sympatisk hyperaktivitet har lägre poäng på Glasgow coma scale (GCS) jämfört med patienter med hjärnskada utan paroxysmal sympatisk hyperaktivitet [16, 17].
Diagnostisering
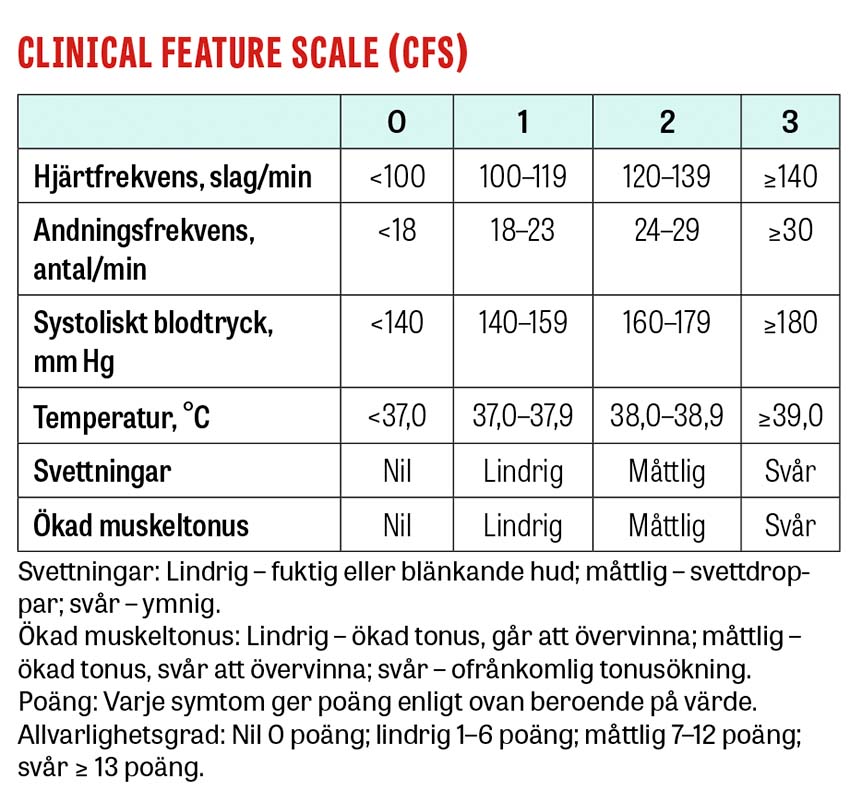
Verktyget PSH-AM (Paroxysmal sympathetic hyperactivity-assessment measure) är ett kliniskt graderingssystem som är utvecklat av Baguley et al för att identifiera kliniska symtom och egenskaper som kan vara förenliga med paroxysmal sympatisk hyperaktivitet [9]. Skalan består av två komponenter: CFS (Clinical feature scale) för att uppskatta allvarlighetsgraden av den sympatiska aktiviteten och motoraktiviteten (på en skala från 0–3), och DLT (Diagnosis likelihood tool) för att mäta kompatibla kännetecken. Observera att man hos patienter mellan 0 och 15 år använder Pediatric PSH scoring reference, som föreslagits av Pozzi et al [18].
Totalsumman av DLT och CFS ger PSH-AM och sannolikheten för diagnos [15]. En totalsumma på mindre än 8 poäng talar emot paroxysmal sympatisk hyperaktivitet, 8–16 poäng talar för möjlig diagnos och 17 poäng eller mer talar för en diagnos av paroxysmal sympatisk hyperaktivitet [19]. PSH-AM kan inte bara användas för att identifiera tillståndet, utan även för att utvärdera dynamiken i tillståndet. Verktygets begränsningar inkluderar de symtom som kan uppstå vid andra kliniska tillstånd under en vårdtid efter traumatisk hjärnskada, såsom sepsis, hypoglykemi och smärta, med risk för feldiagnostisering som följd [19].
Behandling
Initialt krävs en bedömning för att identifiera vilket symtom som behandlingen främst ska riktas mot, till exempel så är patienter med hyperhidros och efterföljande vätskeförlust i behov av vätskeersättning, och patienter med hypertermi är i behov av kylande terapi [20, 21]. Behandlingen kan delas in i en farmakologisk del och en icke-farmakologisk del, där optimering av icke-farmakologiska åtgärder såsom miljöanpassning rekommenderas före påbörjande av farmakologiska insatser.
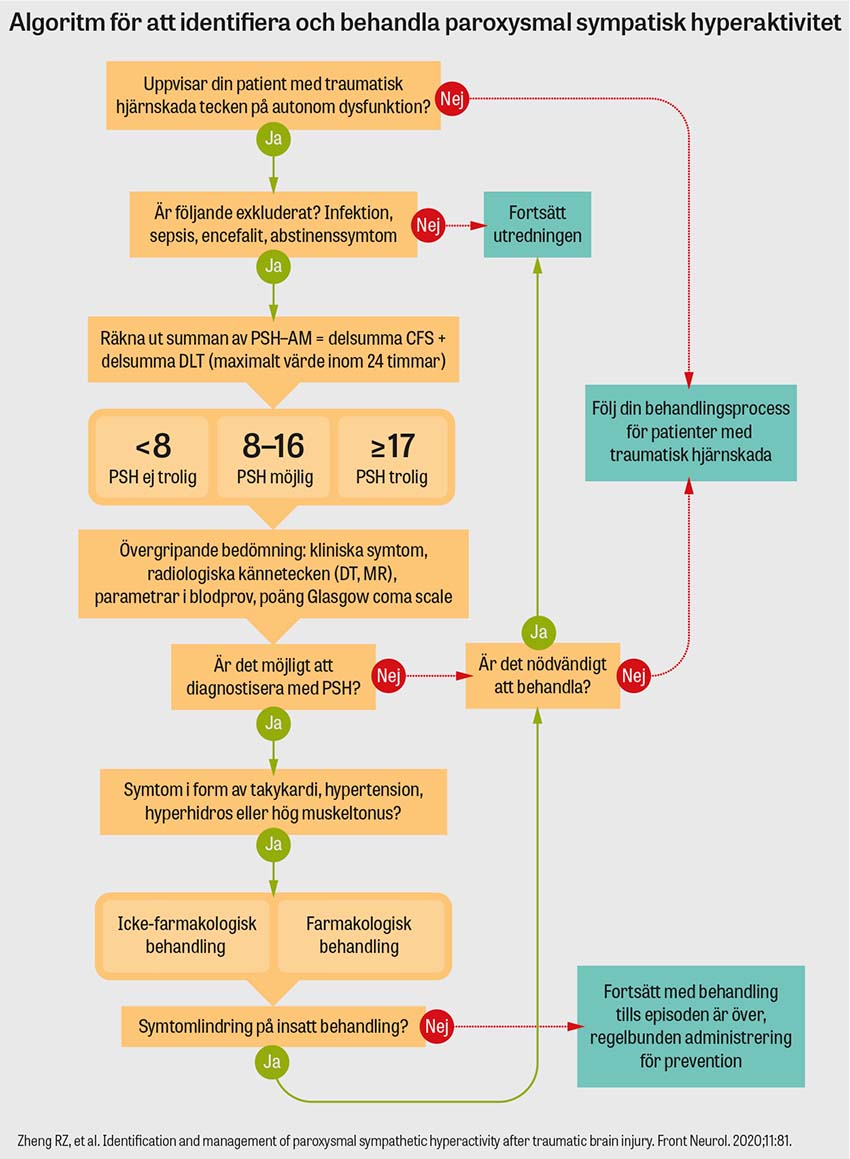
I den icke-farmakologiska behandlingen ingår miljöanpassningar som till exempel att kontrollera rumstemperaturen för att minska hypertermi samt att tillgodose adekvat nutrition, eftersom dessa patienter ofta har ett högre kaloribehov och riskerar att drabbas av näringsbrist [22]. En algoritm för att identifiera och behandla paroxysmal sympatisk hyperaktivitet är framtagen av Zheng et al med motiv att minska antalet missade diagnoser och feldiagnoser, undvika övermedicinering och förbättra vården för patienter med paroxysmal sympatisk hyperaktivitet efter traumatisk hjärnskada [15].
Tyvärr är inget enskilt läkemedel särskilt effektivt mot paroxysmal sympatisk hyperaktivitet. Aktuella läkemedel som kan användas i symtomatisk behandling ingår i läkemedelsgrupperna opioider, intravenösa bedövningsmedel, betablockerare, alfa-agonister, benzodiazepiner och neuromodulatorer [23, 24].
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Diagnosis likelihood tool (DLT)
1. Kliniska symtom förekommer samtidigt
2. Episoderna är paroxysmala
3. Sympatisk hyperaktivering vid normalt icke-smärtsamt stimulus
4. Symtom kvarstår ≥3 på varandra följande dagar
5. Symtom kvarstår ≥2 veckor efter skada
6. Symtom kvarstår trots behandling av alternativa differentialdiagnoser
7. Symtom ≥2 episoder dagligen
8. Behandling insatt för att minska sympatiska symtom
9. Avsaknad av parasympatiska kännetecken under episoder
10. Avsaknad av andra möjliga orsaker till symtombild
11. Tidigare förvärvad hjärnskada
Poäng: Varje punkt ger 1 poäng och avsaknad ger 0 poäng, totalpoäng mellan 0–11.
Icke-farmakologisk och farmakologisk behandling
Icke-farmakologisk behandling
- Vätskeersättning
- Miljöanpassning för att minska stimuli
- Kylande terapi
- Anpassad nutrition
Farmakologisk behandling
Opioider
- Morfin. Modulerar centrala signalvägar ansvariga för autonom dysreglering. Mest effektiva läkemedlet för att lindra episoder och lindrar de flesta symtom, såsom hypertension, takykardi och allodyni.
- Fentanyl. my-receptoragonist i hjärna och ryggmärg. Effektiv mot de flesta symtom (speciellt hypertension, takykardi och allodyni).
Intravenösa bedövningsmedel
- Propofol. GABAA-receptorer i hjärna. Kan användas i den akuta fasen mot de flesta symtom, dock behövs respiratorstöd.
Betablockerande läkemedel
- Propranolol. Icke-selektiv betablockerare (central, kardiell och perifer) som är effektiv i att reducera cirkulerande nivå av katekolaminer och sänker vilometabolismen. Mest frekvent använda betablockerande läkemedlet med möjlighet att passera blod–hjärnbarriären, normalisera blodtryck, sänka hjärtfrekvensen och förbättra myokardiell funktion.
- Metoprolol. Beta-1-blockerare effektiv mot hypertension och takykardi, kan användas för långtidsbehandling.
- Labetalol. Beta-1, beta-2- och alfa-blockerare, både central och perifer. Effektiv mot hypertension, takykardi och svettningar.
Alfa-2-agonister
- Klonidin. Presynaptisk alfa-2-receptoragonist (i hjärna och ryggmärg), sänker effektivt katekolaminniåver i cirkulerande plasma, sänker sympatetiska signaler från hypotalamus och ventrolaterala medulla. Mest effektiv mot hypertension och takykardi.
- Dexmedetomidin. Alfa-2-agonist i hjärna och ryggmärg, inhiberar centralt sympatetiskt utflöde utan att påverka sympatisk feedback. Effektiv mot hypertension, takykardi, dystoni, smärta och ångest.
Bensodiazepiner
- Diazepam, lorazepam, midazolam, klonazepam. Binder mot GABAA-receptorer. Diazepam förstahandsval mot agitation, i övrigt samtliga effektiva mot hypertension, takykardi, dystoni och spasticitet.
Neuromodulatorer
- Bromokriptine. Syntetisk dopaminagonist, mekanismen för behandling av dysautonomi är oklar. Främst behandling mot ökad temperatur och svettningar.
- Gabapentin. GABA-agonistderivat. Effektiv mot spasticitet, ökad kroppstemperatur och allodyni.
- Baklofen. GABAB-agonist, resulterar i en primär effekt i dorsalhornet i ryggmärgen om administrerad intratekalt. Används mot spasticitet, dystoni, klonus och posttraumatisk smärta.
Adapterad från Zheng RZ, et al. Identification and management of paroxysmal sympathetic hyperactivity after traumatic brain injury. Front Neurol. 2020;11:81.