De flesta är ense om att
- alla ska ges medicinsk behandling med blodtryckssänkning och smärtlindring
- typ A-dissektion i första hand bör opereras
- komplicerad typ B-dissektion bör behandlas med TEVAR.
Åsikterna går isär vad gäller
- D-dimers användbarhet för att utesluta akut aortasyndrom
- behandling med TEVAR vid okomplicerad typ B-dissektion.
Akut aortadissektion presenterar sig klassiskt med plötsligt påkommen kraftig bröst- och/eller ryggsmärta. Den kliniska bilden är dock ofta ospecifik [1], och en tredjedel av patienterna får initialt fel diagnos [2]. Inte sällan misstas tillståndet för hjärtinfarkt, lungembolisering eller muskuloskeletal smärta [2]. Samtidigt är enligt en studie enbart 2,7 procent av alla utförda DT aorta med frågeställning dissektion positiva [3]. Incidensen av akut aortadissektion uppskattas till 5–6/100 000 personer per år, motsvarande 1–2/dag i Sverige [4, 5], vilket kan jämföras med antalet hjärtinfarkter, som är ca 85/dag [6].
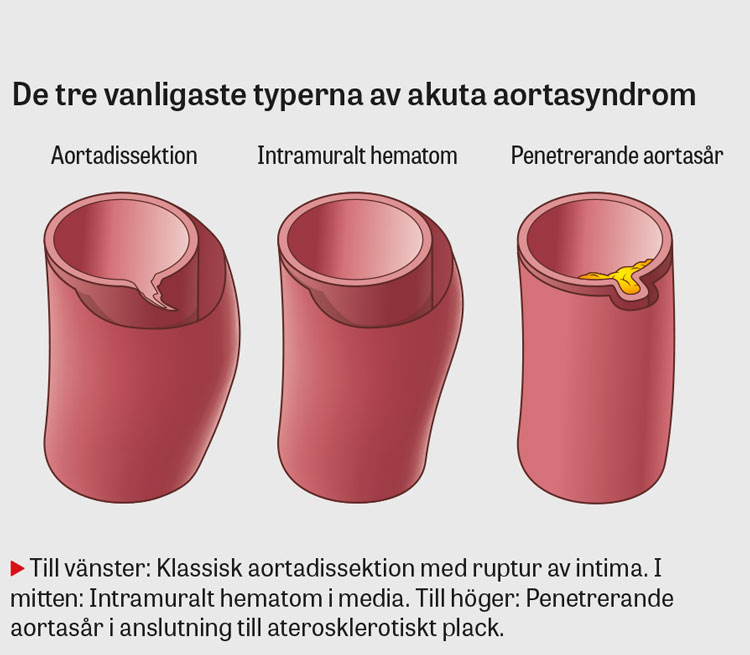
Akut aortadissektion utgör ca 75 procent av fallen i gruppen akuta aortasyndrom [7]. De övriga är intramuralt hematom, diskret dissektion med lokaliserad buktning av aorta, penetrerande aortasår och iatrogen/traumatisk aortadissektion; oftast inräknas även aortaruptur [8]. Gemensamt för gruppen är att de har liknande patofysiologi, klinik och behandling [8]. Dissektionen är akut om den förelegat < 14 dagar [8].
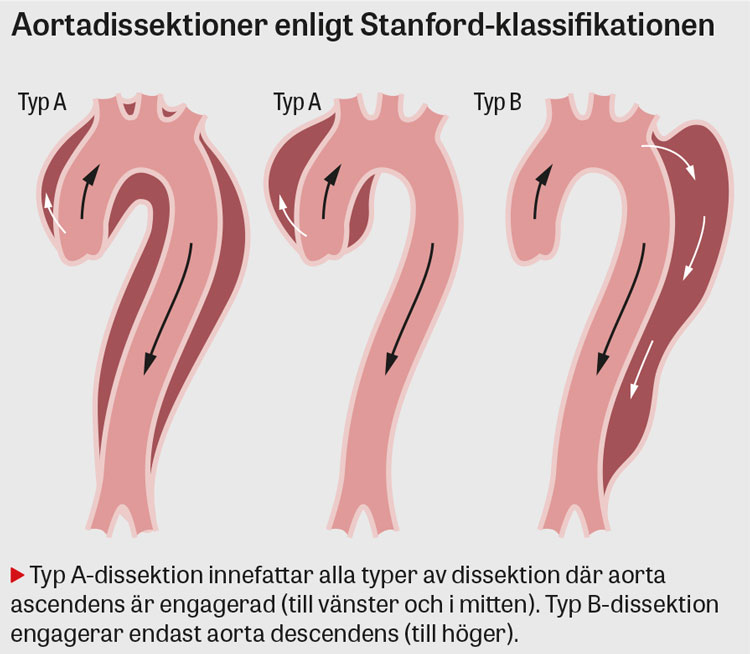
Aortadissektioner indelas oftast enligt Stanford-klassifikationen, som utgår från om aorta ascendens är engagerad (typ A) eller inte (typ B) [9]. Typ A är ungefär dubbelt så vanlig som typ B [4, 10] och har i frånvaro av akut kirurgi 1–2 procents mortalitet per timme och ca 50 procents mortalitet under de första två dygnen [11-13]. Okomplicerad typ B-dissektion har ca 10 procents tidig mortalitet [13].
Typ A har ofta sitt ursprung 2–3 cm ovan kranskärlsavgångarna och typ B 1–2 cm efter avgången för vänster arteria subclavia [11]. Dissektionen kan sedan propagera såväl distalt som proximalt om den ursprungliga skadan.
Bakgrund
Aortaväggen består av tre lager: intima, media samt ytterst adventitia. Vid aortadissektion leder en intimaskada till att blod tränger in i media (»entry«) och separerar aorta till ett sant och ett falskt lumen. Detta följs av aortaruptur, om adventitia går sönder, eller av ett återträde (»re-entry«) vid en andra intimaskada i annan del av aorta [8]. Vid ett intramuralt hematom uppstår ett hematom i media utan att intimaskada kan påvisas, och en hypotes är att detta orsakats av en ruptur av vasa vasorum [14]. Penetrerande aortasår är en skada i intima som ses i anslutning till aterosklerotiska plack [8]. Intramuralt hematom och penetrerande aortasår kan båda progrediera till en dissektion [14].
Aortadissektion drabbar till två tredjedelar män, och medelåldern är 63 år [10, 13]. Kvinnor insjuknar i genomsnitt 7 år senare än män [15]. Hypertoni är vanligt förekommande (ca 70–80 procent) och ses framför allt vid typ B-dissektioner [4, 10, 13]. Blodtryckshöjande tillstånd som styrkelyft [16] och kokainmissbruk [17] är associerade med aortadissektion. Ca 90 procent av de drabbade är eller har varit rökare [4]. Tidigare aortadissektion är en stark riskfaktor för ny aortadissektion [18].
Personer under 40 år med akut aortadissektion har sällan hypertoni utan oftare biskupid aortaklaff eller någon form av bindvävssjukdom, ca hälften har Marfans syndrom [19]. Andra bindvävssjukdomar associerade med aortadissektion är vaskulär Ehlers–Danlos och Loeys–Dietz syndrom [20]. Utöver dessa finns även en andel där patienterna har en förstagradssläkting som diagnostiserats med antingen aneurysm eller dissektion utan att ha en specifik bindvävssjukdom [21]. Graviditet, sannolikt beroende av hemodynamiska och hormonella omställningar, är en riskfaktor och då särskilt i kombination med Marfans syndrom [22, 23].
Aortaaneurysm är en riskfaktor, men 60 procent av de som drabbas av dissektion har inte påtagligt förstorad aortadiameter [24].
Symtom och tecken
Det vanligaste symtomet på dissektion är smärta (90 procent), som ofta beskrivs som plötsligt påkommen och som skarp/knivliknande/sönderslitande [10]. Patienten uppfattas inte sällan av handläggande läkare som svårt sjuk. Typ A-dissektioner ger framför allt bröstsmärta, medan typ B-dissektioner lika ofta ger bröst- som ryggsmärta [13]. Om smärtan är förlagd till buken tenderar patienten få fördröjd diagnos och har sämre prognos [25]. Ifall dissektionen progredierar kan smärtan även förflytta sig, vilket ses hos ca 15 procent [13] och bör inge misstanke om aortadissektion.
Sidoskillnad i puls eller blodtryck > 20 mm Hg mellan extremiteter noteras hos 20–30 procent av patienterna och är prognostiskt ogynnsamt [10, 26]. Fyndet bör vid akut bröstsmärta inge misstanke om dissektion.
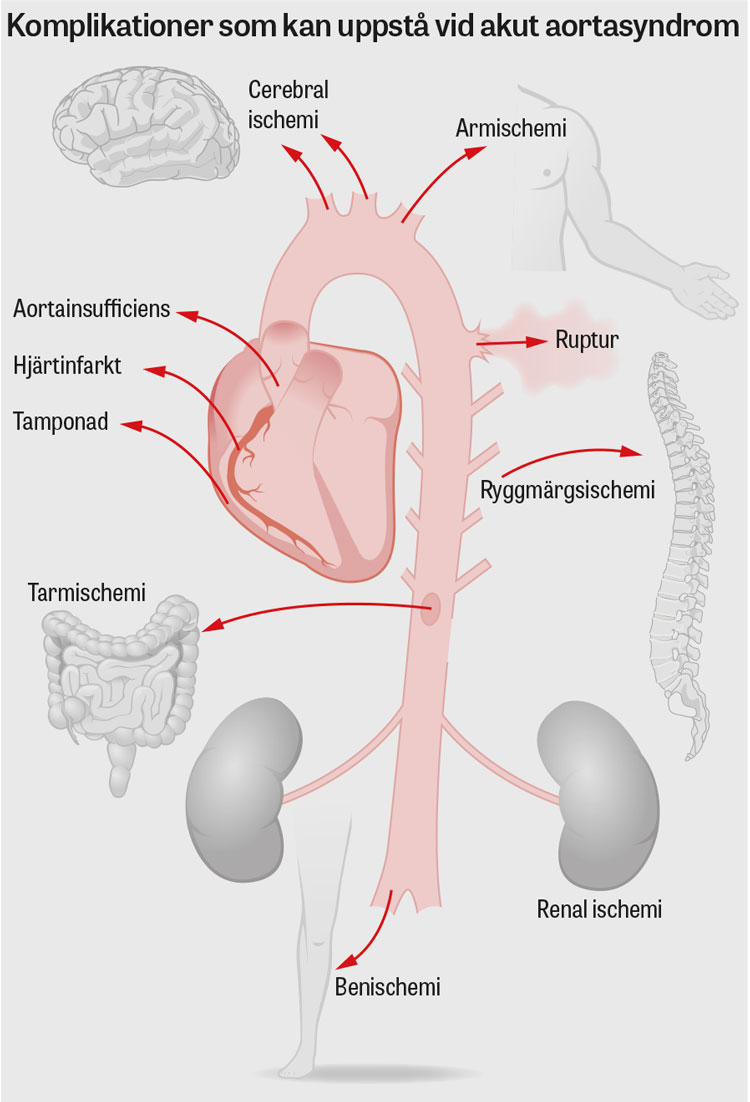
Diastoliskt blåsljud i samband med insjuknande i svår bröstsmärta kan vara ett tecken på dissektion med engagemang av aortaklaffen, vilket ses hos ca 50 procent med typ A-dissektion [24].
Hypotension/chock vid insjuknandet medför avsevärt sämre prognos och ses hos 30 procent av dem med typ A-dissektion [27]. Orsaker kan vara aortaruptur, akut stor aortainsufficiens, utbredd myokardischemi eller hjärttamponad.
EKG talande för ischemi ses hos ca 15 procent av patienterna [13]. Vid typ A-dissektion kan ST-höjning ses orsakat av engagemang av kranskärl [28], men en större andel, ca 40 procent, har ospecifika ST–T-förändringar [13]. Avvikande EKG är vanligt och kan leda till fördröjd diagnos [29].
Mindre mängder pleuravätska ses hos 15–20 procent av patienterna [13]. Stora mängder pleuravätska orsakad av blödning är sällsynta då dessa patienter vanligtvis avlider prehospitalt [8].
Neurologiska symtom ses hos ca 20 procent [30], där medvetslöshet/stroke drabbar 5–10 procent [31] av patienterna med typ A-dissektion. Paraplegi orsakat av ryggmärgsischemi ses hos ca 5–10 procent av patienterna [32].
Samtidig njursvikt kan ses vid både typ A- och B-dissektion [33, 34]. Orsaken kan vara att dissektionen engagerar njurartärerna, men också sekundärt till chock. Njursvikt ökar risken för terapiresistent hypertension samt är associerad med högre sjukhusmortalitet [35].
Diagnostik
Skyndsam diagnostik är av avgörande betydelse, och direktkontakt med radiolog bör övervägas för både mer korrekt och icke fördröjd handläggning.
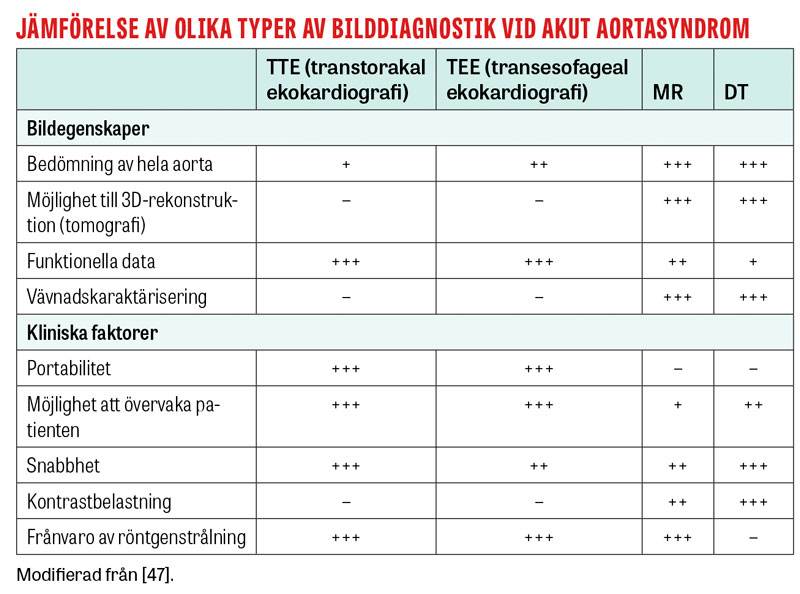
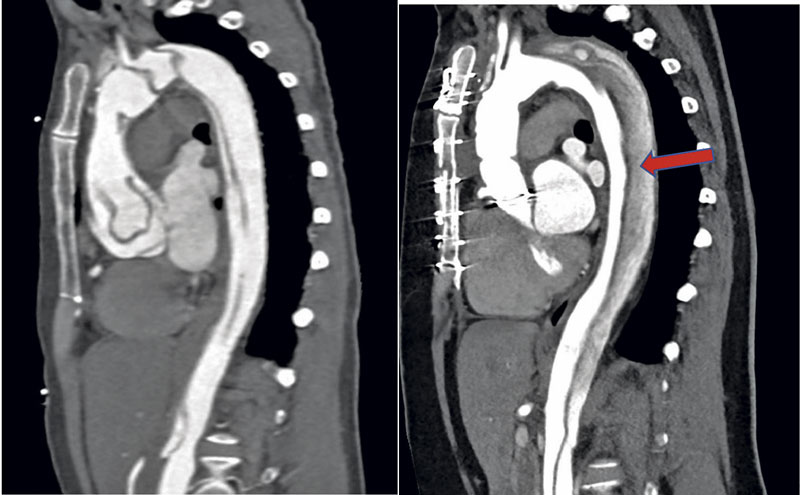
DT aorta, angiografi från hals till ljumskar inkluderande torakal- och bukaorta, är den vanligast använda bilddiagnostiken vid misstanke om akut aortadissektion [10] och är snabb med en sensitivitet på närmare 100 procent och en specificitet på 98 procent [36]. Utöver att ge svar på frågan huruvida dissektion föreligger ses också utbredning i kärlträdet, vilken är av betydelse för behandlingsstrategin.
Magnetkameraundersökning har sensitivitet och specificitet jämförbar med DT [36], men användbarheten begränsas av längre insamlingstid och sämre tillgänglighet.
Transtorakalt hjärtultraljud kan snabbt finna eventuella akuta livshotande komplikationer såsom stor aortainsufficiens eller hjärttamponad, men har för låg sensitivitet för att ensamt utesluta akut aortasyndrom [37, 38]. Transesofagealt hjärtultraljud (TEE) har högre sensitivitet [39], men används sällan diagnostiskt [10].
Lungröntgen kan påvisa fynd som mediastinal vidgning, avvikande aortakontur eller pleuravätska [40]. Endast en tredjedel av dem med bekräftad aortadissektion har helt normal lungröntgen [10, 40].
Blodprovsanalyser utgör ett komplement till bilddiagnostik, och den främst använda biomarkören för akut aortadissektion är D-dimer [8]. Provet är dock ospecifikt och kan vara förhöjt vid andra differentialdiagnostiska tillstånd [41, 42]. D-dimer < 0,5 mg/l talar emot akut aortadissektion. En metaanalys med denna brytpunktsgräns visade på 98 procents sensitivitet för akut aortadissektion [43]. För penetrerande aortasår är sensitiviteten så låg som 64 procent [44]. Normalt D-dimervärde anses inte ensamt kunna utesluta akut aortasyndrom.
Övrig blodprovtagning syftar till att finna indirekta tecken på organischemi eller differentialdiagnoser såsom allvarlig infektion/sepsis. Särskilt kan noteras att troponin är förhöjt hos 25 procent av dem med typ A-aortadissektion [45], vilket riskerar att medföra initial handläggning som vid akut koronart syndrom.
Det har även utarbetats ett poängsystem som har föreslagits att användas tillsammans med D-dimer för att utesluta akut aortasyndrom [7], men ytterligare studier fordras innan detta kan användas kliniskt.
Behandling/handläggning
Både hos patienter med typ A- och typ B-aortadissektion ska medicinsk behandling omedelbart inledas, med syfte att minska tryckbelastningen på aortaväggen och därigenom minska risken för ruptur. Intramurala hematom och penetrerande aortasår handläggs i akutskedet på samma sätt som klassisk aortadissektion [8].
Kraftigt förhöjda blodtryck vid insjuknandet är vanligt, och systoliskt målblodtryck 100–120 mm Hg [8] samt hjärtfrekvens under 60/min eftersträvas [20]. Förstahandsval för blodtryckssänkning är intravenös betablockad; ofta används labetalol, som minskar både hjärtfrekvens och afterload [8, 46]. Innan betablockadbehandling inleds ska signifikant aortainsufficiens uteslutas. Ofta krävs flera preparat, och då kan vasodilaterare som infusion med glyceryltrinitrat/nitroprussid eller kalciumantagonist användas. Betablockerare bör ha administrerats först för att undvika reflexiv takykardi [47].
Smärtfrihet ska uppnås, och oftast krävs intravenös opioid. Utöver smärtlindring fås indirekt minskad sympatikusaktivering och sekundärt även blodtrycks- och hjärtfrekvensminskning [8, 20].
Vid chockbild kan volymexpansion och vasopressorbehandling krävas, men med samma målblodtryck som ovan. Viss hypotension är önskvärd för att undvika progress av dissektionen [48]. Vid akut tamponad ska minsta mängd perikardvätska tappas för att upprätthålla perfusion [20].
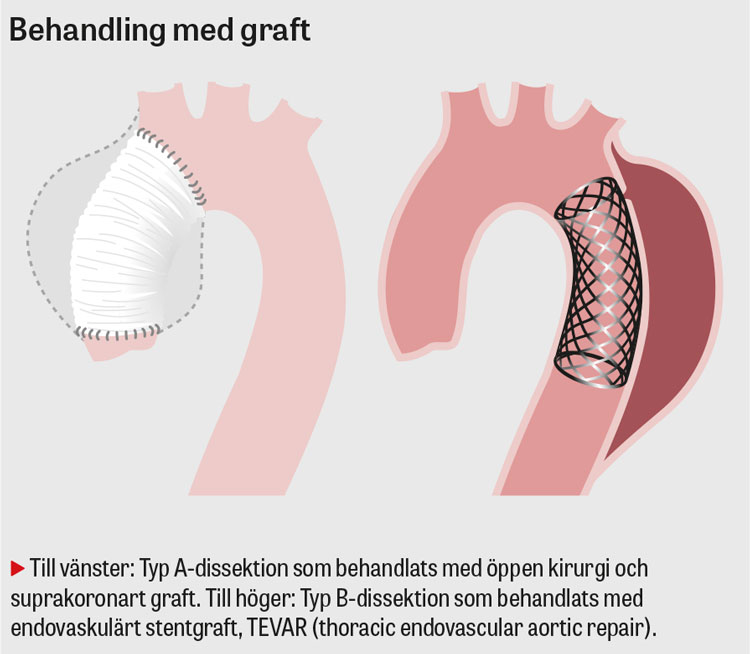
Specifik handläggning av typ A-dissektioner. Typ A-dissektion utan toraxkirurgisk åtgärd har hög mortalitet, varför samtliga patienter bör övervägas för akut öppen kirurgi, vilket > 90 procent genomgår [10]. I Sverige opererades 169 patienter år 2020 för typ A-dissektion [49]. I det nordiska NORCAAD-registret var 5-årsöverlevnaden för dem som opererades 86 procent, och endast en låg andel krävde reoperation [50, 51]. Insjuknande associerat med hjärtinfarkt, stroke/medvetandesänkning eller chockbild utgör en negativ prediktor, men dessa är inte absoluta kontraindikationer för kirurgi [8]. Då typ A-dissektion kan imitera hjärtinfarkt förekommer det att patienten administrerats dubbel trombocythämning (DAPT) innan korrekt diagnos ställts. En nordisk studie indikerar att DAPT före kirurgi var associerad med blödningskomplikationer men utan förhöjd mortalitet, varför inte heller detta är en kontraindikation [52].
Målet med kirurgisk intervention är att återdirigera blodflödet till kärlets äkta lumen genom att stänga ingången till falskt lumen samt att säkerställa organperfusion. I majoriteten av fallen behöver inte aortaklaffen bytas [53], och målet kan då uppnås med ett så kallat suprakoronart graft där aorta ascendens ersätts upp till truncus brachiocephalicus. Om aortaklaffens funktion är påverkad behöver patienten förses med en ny hjärtklaff (biologisk eller mekanisk) i kombination med ett graft (så kallat kompositgraft) eller aortaklaffbevarande kirurgi. Vid engagemang av arcus aortae och distalt därom kan operationen behöva utvidgas ytterligare för att säkerställa perfusion till hjärna samt perifer vävnad [8].
Specifik handläggning av typ B-dissektioner. Majoriteten av typ B-dissektioner kan hanteras genom medicinsk behandling enligt ovan och klassificeras då som okomplicerad. Vården sker initialt vanligen på Iva/Miva/Ima/Hia med blodtrycksreglering och invasiv blodtrycksmätning. Handläggningen sker multidisciplinärt, inkluderande kardiolog, och i samråd med kärlkirurger som regelbundet värderar behovet av förnyad datortomografi samt indikation för behandling. När blodtrycket ligger stabilt med enbart perorala blodtrycksmediciner kan patienten flyttas till vårdavdelning.
Komplicerad typ B-dissektion definieras som persisterande eller återkommande smärta, okontrollerbar hypertension trots optimal behandling, tidig expansion av aortadiameter, malperfusion (till exempel njursvikt, paraplegi, tarm- eller extremitetsischemi) eller tecken på hotande ruptur [8].
Vid komplicerad typ B-dissektion är endovaskulär åtgärd indicerad, där ett stentgraft (TEVAR, thoracic endovascular aortic repair) används för att stänga ingången, vilket därigenom förhindrar flödet till falska lumen som i stället trombotiseras. Resultatet blir att flödet återupprättas i äkta lumen och det sker en remodellering och stabilisering av aorta [8]. TEVAR har visat sig överlägset öppen kärlkirurgisk åtgärd med betydligt lägre mortalitet [54], och 5-årsöverlevnaden i ett svenskt material var 87 procent [55]. Öppen kirurgi används därför sällan men kan krävas vid särskilda situationer, till exempel då landningszoner saknas för stentgraftet eller vid bindvävssjukdom [8].
TEVAR har även i selekterade fall föreslagits vara gynnsamt jämfört med farmakologisk behandling vid okomplicerad typ B-dissektion och har uppvisat lägre aortarelaterad mortalitet vid en 5-årsuppföljning, dock utan signifikant skillnad i total mortalitet [56]. Vidare studier krävs för att klargöra rollen av endovaskulär åtgärd vid okomplicerad typ B-dissektion.
Uppföljning
Akut aortasyndrom övergår sedermera i ett kroniskt sjukdomsförlopp. Detta kan då antingen vara okomplicerat och stabilt eller kompliceras av aortadilatation eller dissektionsprogress. Med anledning av detta följs patienterna med upprepade DT- eller MR-undersökningar. Det viktigaste på sikt är dock god blodtryckskontroll med målblodtryck under 130/80 mm Hg [8].
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Möjliga riskfaktorer för aortadissektion
Tillstånd som leder till ökad väggbelastning
- Hypertoni, särskilt underbehandlad
- Feokromocytom
- Användning av kokain eller andra centralstimulantia
- Tyngdlyftning
- Trauma
- Decelerations- eller vridvåld (till exempel motorcykelolycka eller fall)
- Aortakoarktation
Genetiska tillstånd relaterade till avvikelser i intima media
- Marfans syndrom
- Vaskulärt Ehler–Danlos syndrom
- Biskuspid aortaklaff (inklusive tidigare aortaklaffkirurgi)
- Turners syndrom
- Loeys–Dietz syndrom
- Familjära torakala aortaaneurysm och dissektioner (TAAD)
Inflammatoriska tillstånd relaterade till avvikelser i intima media
- Takayasus arterit
- Jättecellsarterit
- Behçets sjukdom
Övriga riskfaktorer
- Tidigare aortadissektion
- Ateroskleros
- Graviditet
- Polycystisk njursjukdom
- Långtidsbehandling med kortikosteroider
- Infektion som engagerar aortaväggen
- Kinolonantibiotika
Modifierat från den europeiska kardiologföreningens riktlinjer [8].
Differentialdiagnoser vid akut aortasyndrom
- Hjärtinfarkt
- Akut aortainsufficiens
- Perikardit/myokardit
- Lungemboli
- Stroke
- Extremitetsischemi
- Pneumotorax
- Pneumoni med smärta
- Pleurit
- Akut buk (till exempel pankreatit, ulkus, gallstensanfall, njurstensanfall, ileus)
- Lumbago/muskuloskeletal smärta
Förslag till handläggningsgång
Av författarna föreslagen handläggningsgång vid diagnostiserad akut aortadissektion
- Två grova intravenösa nålar (eventuellt CVK)
- Artärnål för blodtrycksövervakning (ej arteria femoralis, då detta kärl används vid eventuell kirurgi)
- EKG och telemetriövervakning
- Blodprovtagning, överväg blod- och bastest
- KAD (timdiures som mått på organperfusion)
- Blodtrycksoptimering med systoliskt målblodtryck 100–120 mm Hg:
– I första hand betablockerare labetalol 25-50 mg som långsam intravenös injektion eller som infusion; intravenös injektion kan upprepas efter 5–10 minuter
– I andra hand infusion med glycerylnitrat/nitroprussid - Smärtlindring: Morfin 5–10 mg iv vid behov, kräver ofta upprepade doser
- Typ A-dissektion:
– Akut kontakt med toraxkirurg, oavsett tid på dygnet
– Ekokardiografi, med syfte att undersöka förekomst av aortainsufficiens och perikardexsudat
– Akut transport till toraxkirurgisk enhet - Typ B-dissektion:
– Vid tecken på komplicerad typ B-aortadissektion tas akut kontakt med kärlkirurg oavsett tid på dygnet; vid okomplicerad typ B-aortadissektion kontakt med kärlkirurg dagtid
– Vid komplicerad typ B-aortadissektion transport till sjukhus med till kärlkirurgisk enhet
Anamnes och status vid misstanke om akut aortadissektion
Av författarna föreslagen anamnestagning och status vid misstanke om akut aortadissektion
- Bakomliggande riskfaktorer:
– Bindvävssjukdom, egen eller i nära släkt
– Aortasjukdom, egen eller i nära släkt
– Aortaklaffsjukdom
– Hypertoni
– Rökning
– Plötslig, oförklarlig död i nära släkt - Smärtbeskrivning:
– Plötslig debut
– Svår/kraftig intensitet
– Sönderslitande - Hjärtstatus (diastoliskt blåsljud?)
- Lungstatus
- Bukstatus (pulserande, breddökad aorta?)
- Blodtryck i extremiteter, palpera perifera pulsar (sidoskillnader?)
- Neurologiskt status
Inspiration hämtad från riktlinjer från den europeiska kardiologföreningen [8].