De flesta är ense om att
- pneumotorax hos patient med grav hypoxi eller hypotoni måste behandlas skyndsamt med grovt drän
- tunna drän med framgång kan användas för att behandla primär och sekundär spontan pneumotorax.
Åsikterna går isär vad gäller
- vilka patienter som överhuvudtaget ska behandlas med drän
- rollen av nålaspiration vid handläggning av pneumotorax
- om patienter med traumatisk pneumotorax kan behandlas med tunna drän
- poliklinisering av patienter med pneumotorax.
Pneumotorax innebär att det finns luft mellan pleurabladet som klär lungvävnaden och pleurabladet som klär bröstkorgen. Handläggningsstandard vid millennieskiftet innebar att man förde in ett grovt drän i pleurarummet, sugbehandling och slutenvårdsbehandling. Sådan handläggning bör i dag enbart sällan förekomma. Denna artikel presenterar ett systematiskt förhållningssätt till handläggningen av patienter med pneumotorax på akuten baserat på studier och översiktsartiklar publicerade under senaste 20 åren.
Genes
Pneumotorax uppkommer på två principiellt olika sätt: endera genom att luft kommer in i pleurarummet genom en öppning i bröstkorgen eller genom ett läckage från lungparenkymet ut i pleurarummet. Pneumotorax delas in i olika grupper beroende på genesen [1]:
- Spontan pneumotorax innebär att luftläckaget från lungparenkymet uppstår i avsaknad av externa faktorer såsom trauma eller ingrepp.
- Primär spontan pneumotorax är en spontan pneumotorax som uppstår hos en lungfrisk patient.
- Sekundär spontan pneumotorax är en spontan pneumotorax som uppstår hos en patient med känd lungsjukdom såsom kroniskt obstruktiv lungsjukdom, cystisk fibros eller lungcancer.
- Traumatisk pneumotorax innebär att luftläckaget från lungparenkymet eller öppningen i bröstkorgen uppstår som en följd av trauma mot bröstkorgen. Öppen pneumotorax föreligger när luften passerar genom ett hål i bröstkorgen vid andning.
- Iatrogen pneumotorax innebär att luftläckaget uppstår till följd av att lungvävnaden punkteras av misstag i samband med ett ingrepp, till exempel anläggning av central venkateter.
Diagnostik
Pneumotorax bör misstänktas utifrån en kombination av symtom (pleuritisk bröstsmärta med plötslig debut, dyspné), kliniska fynd (ensidiga nedsatta andningsljud, hyperresonant perkussionston), situation (trubbigt eller penetrerande våld mot bröstkorgen inklusive hjärt–lungräddning och anläggning av central venkateter) och riskfaktorer (framför allt underliggande lungsjukdom). Om trycket i pleurarummet överstiger atmosfäriskt tryck under både in- och utandning (så kallad övertryckspneumotorax) påverkas ventilationen till den friska lungan och det venösa återflödet till hjärtat. Detta medför i sin tur att hypotoni, hypoxi, halsvenstas, trakealdeviation och hjärtstopp kan förekomma.
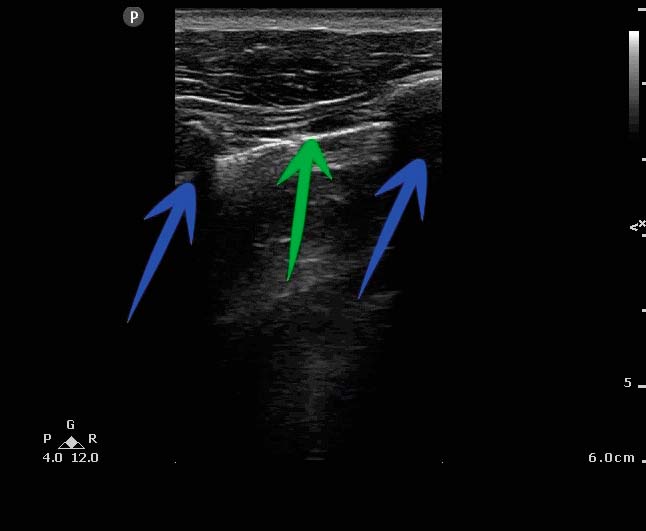
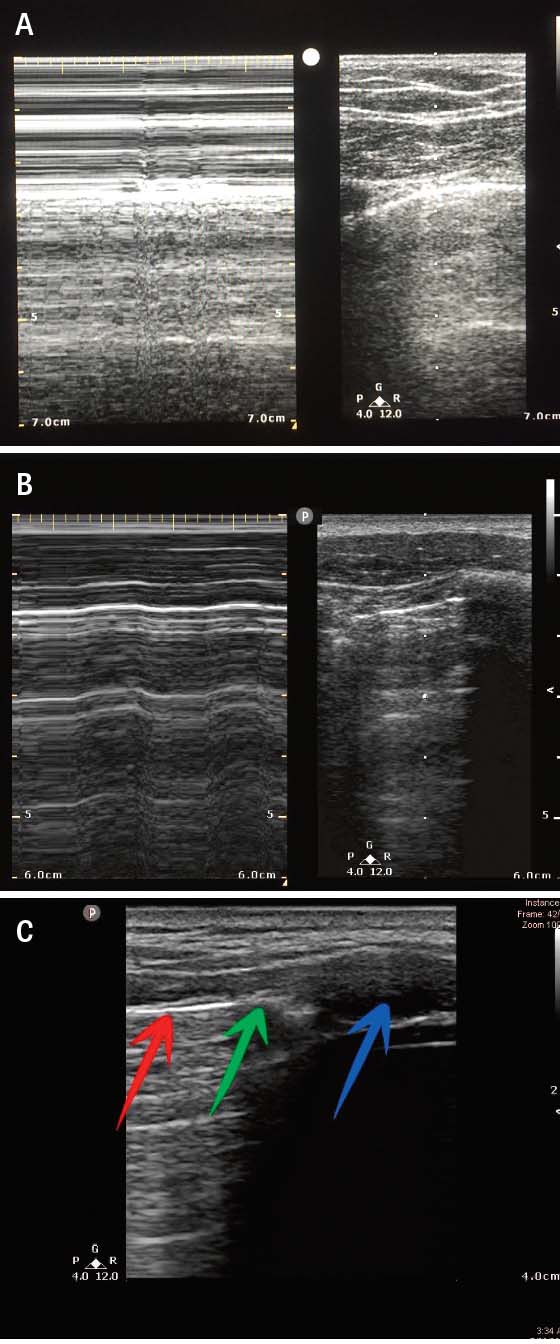
Hos hemodynamiskt stabila patienter används i första hand konventionell lungröntgen med patienten stående för att diagnostisera pneumotorax [2]. En anteroposterior lungröntgen med patienten i ryggläge har dock en känslighet av enbart 47 procent (95 procents konfidensintervall [95KI] 31–63 procent) för traumatisk pneumotorax [3]. Förekomst av lungglidning (»lung sliding«) vid ultraljudsundersökning utesluter pneumotorax, och ultraljud genomfört av ickeröntgenologer på akuten har en känslighet av 91 procent (95KI 85–94 procent) för traumatisk pneumotorax [3]. DT är känsligare än lungröntgen och ultraljud för att identifiera luft i pleurarummet [2].
Handläggningsmål
Målen vid handläggningen av pneumotorax är att
- luften i pleurarummet ska försvinna och att lungan helt reexpanderar
- minimera biverkningar såsom blödning, infektion, smärta och recidiv av pneumotorax
- minimera onödig resursförbrukning såsom slutenvårdsbehandling.
Steg 1: Grovt drän?
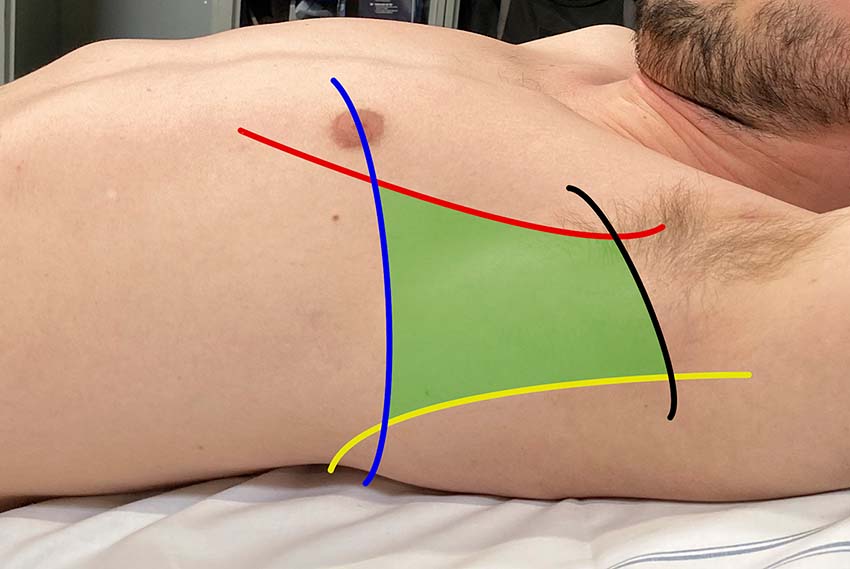
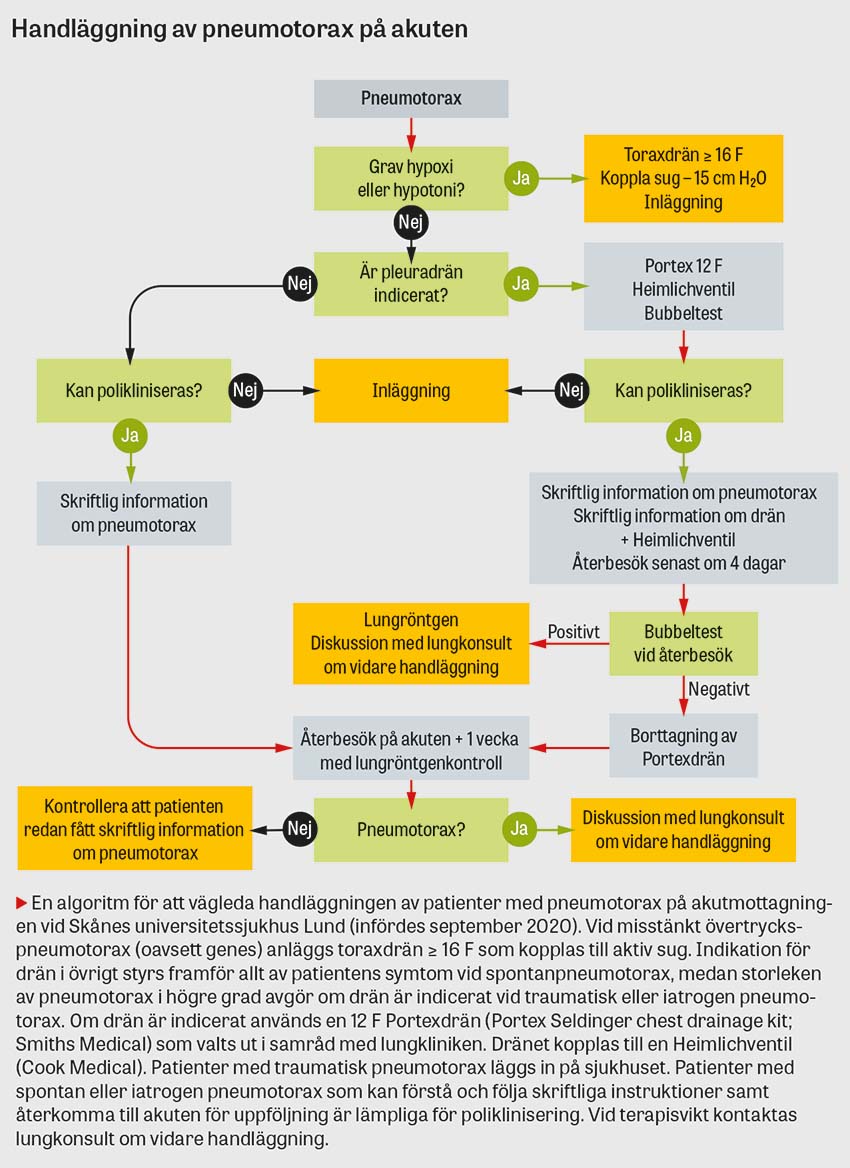
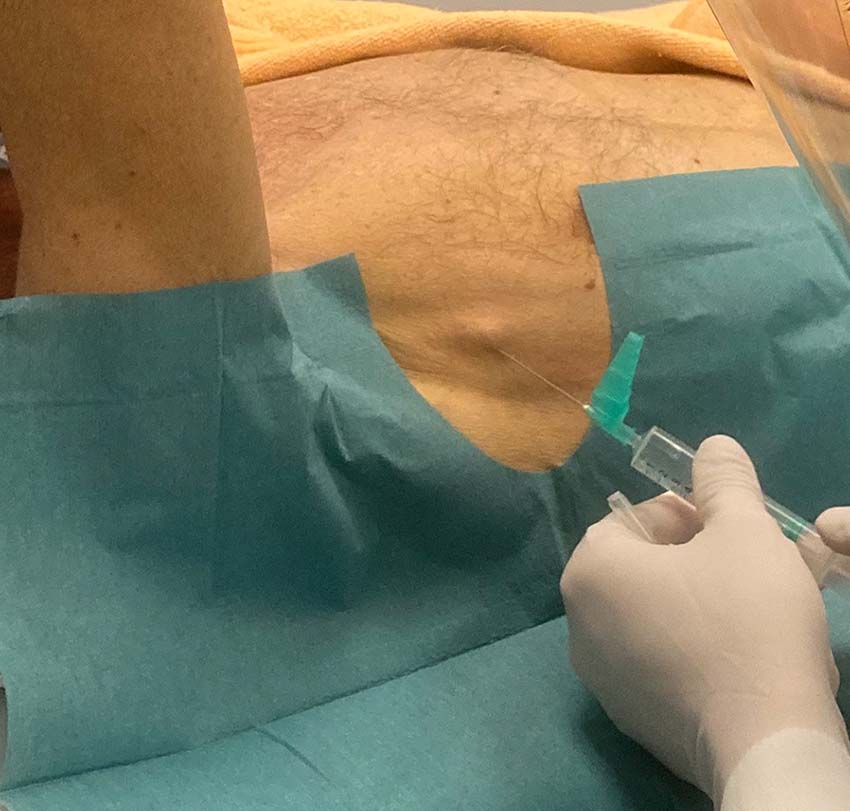
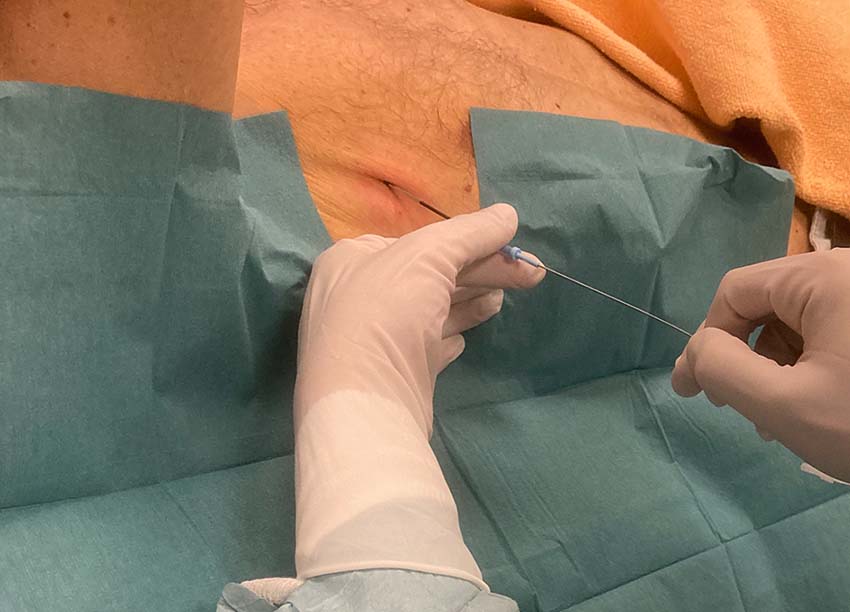
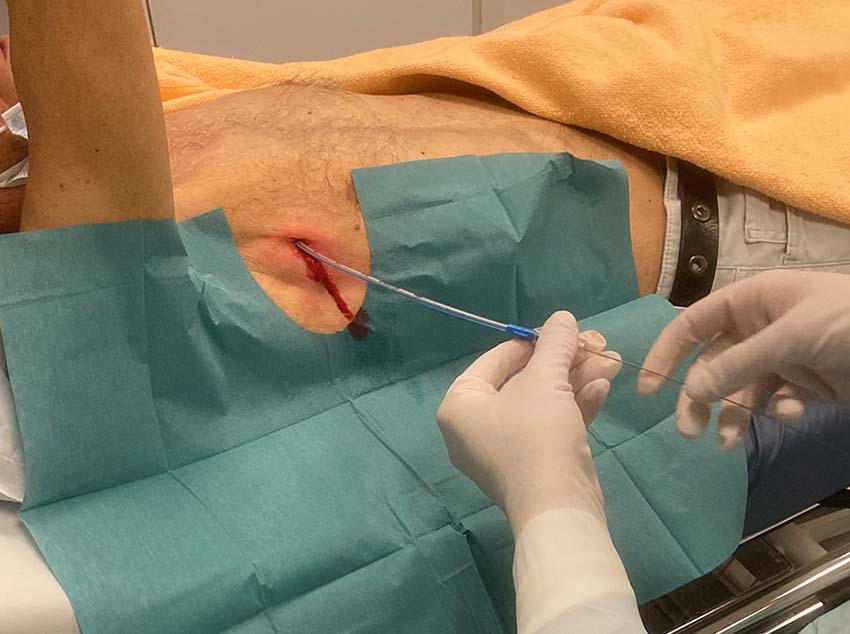
I vissa sammanhang bör en misstänkt pneumotorax åtgärdas innan dess närvaro kan bekräftas eller uteslutas röntgenologiskt. Det gäller när patienter med misstänkt pneumotorax lider av hypoxi, hypotoni eller hjärtstopp, det vill säga när en klinisk misstanke om övertryckspneumotorax föreligger. Handläggningen består av torakostomi i den säkra triangeln följt av införandet av ett grovt drän [4]. Nåldekompression är mer framgångsrik när den genomförs i den främre axillärlinjen (4:e eller 5:e interkostala området) än när den genomförs i mittklavikulärlinjen [5]. Tekniken för införande av ett grovt drän täcks i en annan ABC-artikel [6].
Steg 2: Konservativ eller invasiv behandling?
Konservativ behandling
Traditionellt sett har man grundat beslutet om konservativ respektive invasiv behandling på storleken av pneumotoraxen. Har man bedömt den som stor har man valt att sätta drän. Det finns dock inget enhetligt sätt att mäta och klassificera storleken av en pneumotorax. Enligt brittiska riktlinjer klassificeras en pneumotorax som stor om det föreligger > 2 cm luftspalt mellan lungan och bröstkorgen vid hilusnivån [7]. Enligt amerikanska riktlinjer klassificeras en pneumotorax som stor om det föreligger > 3 cm luftspalt mellan lungans apex och cupola [8]. Studier visar att de två måtten överlappar varandra dåligt och att båda metoderna är suboptimala i förhållande till aktuell volym av pneumotoraxen [9, 10].
European Respiratory Society (ERS) betonar att storleken av pneumotorax inte bör avgöra dränanläggning vid primär spontan pneumotorax, utan att beslutet bör baseras primärt på patientens symtom (till exempel dyspné), önskemål och risker vid dräninläggning (smärta, blödningar, sepsis, subkutant emfysem och lungödem kopplat till reexpansionen av lungan) [11]. Risken att utveckla en övertryckspneumotorax hos patienter med primär spontan pneumotorax är väldigt liten [11]. En studie från 2020 randomiserade patienter med mellanstor eller stor primär spontan pneumotorax till konservativ behandling eller anläggning av ett tunt drän (≤ 12 F) [12]. Vid 8 veckor hade lungan reexpanderat fullt hos 129 av 131 patienter (98 procent) som fick invasiv behandling, jämfört med 118 av 125 patienter (94 procent) som fick konservativ behandling. Frekvensen av allvarliga biverkningar och recidiv av spontan pneumotorax var lägre vid konservativ behandling.
Patienter med sekundär spontan pneumotorax besväras i regel mer av sin pneumotorax än lungfriska patienter [11], och då blir konservativ behandling mer sällan lämplig. Vid recidiv av primär spontan pneumotorax [11] och redan vid en sekundär spontan pneumotorax [13] rekommenderas ställningstagande till pleurodes och/eller lungkirurgi för att förebygga recidiv.
ATLS (advanced trauma life support) rekommenderar toraxdrän vid traumatisk pneumotorax, med undantag för täta observationer av subkliniska (ockulta) pneumotorax [14]. Ett flertal retrospektiva studier och observationsstudier rapporterar dock att > 90 procent av selekterade patienter med små traumatiska pneumotorax till följd av trubbigt eller penetrerande trauma framgångsrikt kan behandlas konservativt under noggrann observation [15-18]. Tyska riktlinjer från 2019 rekommenderar konservativ behandling av patienter med små iatrogena pneumotorax utan dyspné [19].
Nålaspiration
Luft kan manuellt aspireras utifrån pleurarummet genom en nål [20]. Har mer än 2,5–4 liter luft aspirerats och man inte fått ett hårt motstånd vid aspiration får man tolka det som att det finns ett pågående luftläckage och att metoden inte varit framgångsrik. Sannolikheten att misslyckas är högre vid bakomliggande lungsjukdom, och därför rekommenderas nålaspiration först och främst vid primär spontan pneumotorax och iatrogen pneumotorax [21]. Enligt European Respiratory Society misslyckas nålaspiration vid 25–50 procent av försök hos patienter med primär spontan pneumotorax [11]. En metaanalys som inkluderade 358 patienter med spontan pneumotorax rapporterar att nålaspiration är lika framgångsrik som dräninläggning (12–24 F) gällande omedelbar lungexpansion eller expansion inom en vecka [22]. Jämfört med grova drän är nålaspiration mindre smärtsam [21].
Tunt drän
Dränets ytterdiameter anges i French (F) där varje enhet motsvarar 1/3 mm. Ett flertal studier (till exempel [23-28]) och översikter [29, 30] visar att tunna drän (< 14 F) är minst lika effektiva som grova drän för att behandla olika typer av pneumotorax. En metaanalys som inkluderade 875 patienter med pneumotorax (63 procent spontan, 30 procent traumatisk, 5 procent iatrogen och 3 procent blandad genes) rapporterade att så kallat pigtaildrän (6,5–14 F) var lika effektivt som toraxdrän (≥ 16 F) för den initiala behandlingen av pneumotorax [31]. Studier visar även att pigtaildrän vid spontan pneumotorax är associerat med kortare dräntid, kortare inläggningstid och färre komplikationer jämfört med grovt drän [31, 32]. Tunna drän orsakar mindre smärta än grova drän [27, 33, 34]. Ett argument mot användningen av tunna drän vid traumatisk pneumotorax är att dränet kan obstrueras av koagulerat blod. Ett antal studier har dock rapporterat att drän i storleken 14 F kan vara lika effektiva som grova drän (28–40 F) för att dränera blod från traumatiskt uppkomna hemotorax och hemopneumotorax [26, 33, 35]. När ett drän behövs för att behandla iatrogen pneumotorax rekommenderas ett tunt drän [19].
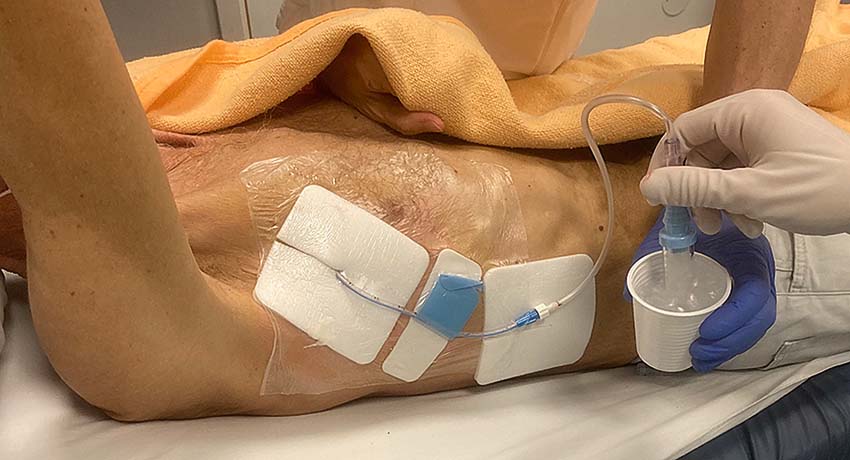
Minidränagesystem
Tru-close, Thoracic egg och Rocket pleural vent är minidränagesystem där ett drän och en Heimlichventil är ihopbyggda. Heimlichventil är en backventil speciellt konstruerad för toraxdränage [36]. Minidränagesystem har studerats mest vid spontan och iatrogen pneumotorax och knappt vid traumatisk pneumotorax [37-42]. En randomiserad kontrollerad studie med 236 patienter visade att poliklinisk behandling med Rocket pleural vent är lika effektiv som nålaspiration och/eller drän för primär spontan pneumotorax [41]. En annan studie visade däremot behandlingssvikt under första veckan hos 46 procent av patienter med sekundär spontan pneumotorax som fick Rocket pleural vent [42].
Passivt dränage alternativt aktiv sugbehandling
Traditionellt kopplas pleuradrän till en aktiv sug. En systematisk översikt som inkluderade 1 235 patienter (992 med spontan och 243 med iatrogen pneumotorax) rapporterar reexpansion av lungan hos 86 procent av patienter med passivt dränage genom koppling av dränet till en Heimlichventil, och med samma långtidsförlopp jämfört med aktivt dränage [43]. European Respiratory Society rapporterar reexpansion av lungan inom 3 dagar hos 70 procent av patienter behandlade med passivt dränage och rekommenderar inte rutinmässigt användande av aktiv sug [11]. Flera studier har visat att patienter kan behandlas framgångsrikt genom poliklinisering med passivt dränage (se nedan). En ovanlig men allvarlig komplikation till både nålaspiration och aktiv sugbehandling är reexpansionsödem [7, 44], en typ av icke-kardiogent lungödem som förekommer efter att en kollaberad lunga återexpanderas [45]. Riskerna för detta tycks vara som störst om lungan varit kollaberad i > 7 dagar, vid en stor pneumotorax och hos yngre patienter [46].
Bubbeltest
Erhåller patienten en Heimlichventil kan ett »bubbeltest« bekräfta dränfunktionen. Ventilen stoppas i en mugg med vatten och patienter uppmanas att hosta. Om det bubblar i muggen har man bekräftat korrekt läge och god funktion av dränet; samtidigt visar testet att luft kvarstår mellan pleurabladen. Detta test eller manuell luftaspiration genom dränet kan därmed ersätta kontrollröntgen [28, 47]. Det är dock viktigt att kontrollera att testet inte är falskt negativt på grund av att bladen i ventilen klibbat ihop.
Steg 3: Poliklinisering?
Fördelen med passivt dränage via en envägsventil är att det möjliggör poliklinisering av patienten. Flertalet studier (till exempel [24, 39, 40, 47-50]) visar framgångsrik behandling via poliklinisering av patienter med framför allt primär och sekundär spontan pneumotorax. Även poliklinisering av patienter med iatrogen pneumotorax som fått Heimlichventil anses som rimlig [19, 28, 51]. Som regel observeras patienter med traumatisk pneumotorax inneliggande.
Steg 4: Uppföljning
Patienter som behandlas via poliklinisering ska förses med skriftlig information om uppföljningsplan och (om aktuellt) skötsel/funktion av dränet. I studien som utvärderade konservativ behandling av mellanstor eller stor primär spontan pneumotorax arrangerades en klinisk uppföljning inom 72 timmar och lungröntgenundersökning 2 veckor efter inklusion [12]. I studierna om poliklinisk behandling med tunt drän kopplat till Heimlichventil genomfördes uppföljning inom 72 timmar, antingen med lungröntgen eller enbart bubbeltest [24, 47, 49, 50]. De flesta studier visar att en majoritet av dränbehandlingen varit framgångsrik efter 5 dagar [24, 47, 49, 50, 52, 53], och då kan dränet dras ut följt av kontrollröntgen av lungorna. Vid kvarstående luftläckage rekommenderas ställningstagande till pleurodes och/eller lungkirurgi [11, 13].
Patienter med spontan pneumotorax som inte har genomgått bilateral kirurgisk pleurektomi ska för all framtid avstå från att dyka med tuber/flaskor [19, 54]. Rökning är en riskfaktor för spontan pneumotorax, och rökstopp minskar förmodligen risken för recidiv [54]. Flygning rekommenderas inte inom två veckor efter avslutad behandling för pneumotorax [55]. Det finns inget bevis på att fysisk aktivitet ökar risken för spontan pneumotorax [19], varför motion kan återupptas gradvis efter två veckor från avslutad behandling [54].
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.






![För att utreda eventuell pneumotorax med ultraljud placeras patienten i ryggläge eller med huvudänden på britsen lätt upphöjd [42]. Luften vid en eventuell pneumotorax stiger då anteriort i patientens torax. Undersökningen genomförs med mikrokonvex, linjär eller konvex prob placerad i sagittalplan (det vill säga vinkelrätt mot revben) i andra till fjärde interkostalrummet i mittklavikulärlinjen.](https://lakartidningen.se/wp-content/uploads/2022/01/Figur2a_webb.jpg)




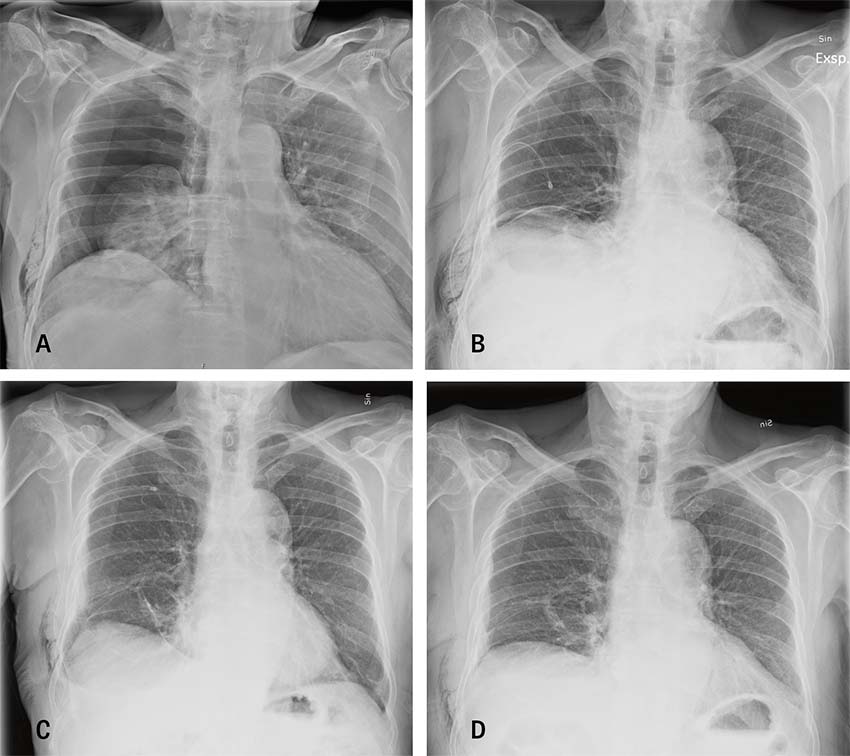
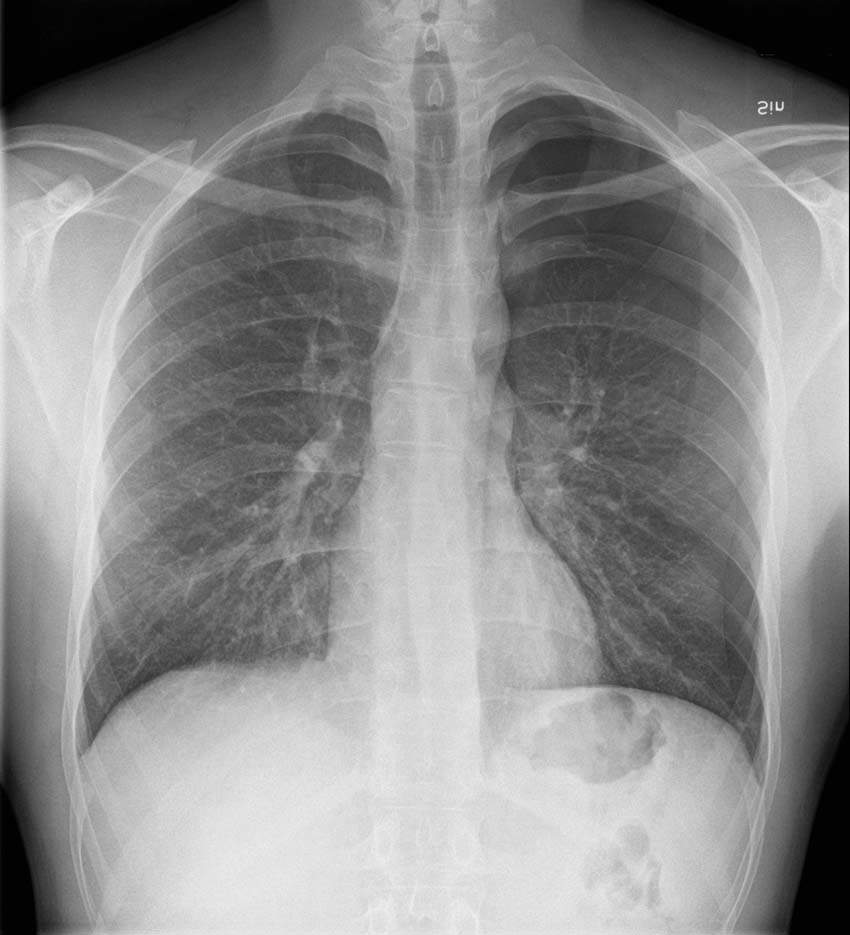
![En 71-årig kvinna ankom till akutmottagningen via ambulans på grund av dyspné och uttalad tungsvullnad, troligen utlöst av angioödem. Inom några minuter efter ankomsten drabbades hon av ett hypoxiutlöst hjärtstopp. Under pågående bröstkompressioner blev patienten koniotomerad och därefter övertrycksventilerad. Hon återfick bärande cirkulation, och en bedside-lungröntgen på akutrummet visade en liten apikal pneumotorax till höger (A, röd pil). Patienten överfördes till operationssalen för att genomgå en trakeostomi och drabbades där ånyo av hjärtstopp på grund av en högersidig övertryckspneumotorax. Denna behandlades med ett högersidigt grovt drän (B, blå pil till vänster på bilden). En vänstersidig övertryckspneumotorax utvecklades kort därefter, varför patienten behövde även vänstersidigt drän (B, blå pil till höger på bilden). Patienten överlevde utan neurologiska sequelae. Övertryckspneumotorax innebär att trycket i pleurarummet överstiger atmosfäriskt tryck under både in- och utandning. Övertryckspneumotorax uppstår som regel hos övertrycksventilerade patienter och är en extremt sällsynt händelse hos patienter med primär spontan pneumotorax [10].](https://lakartidningen.se/wp-content/uploads/2022/01/Figur9_webb.jpg)
















