De flesta är ense om att
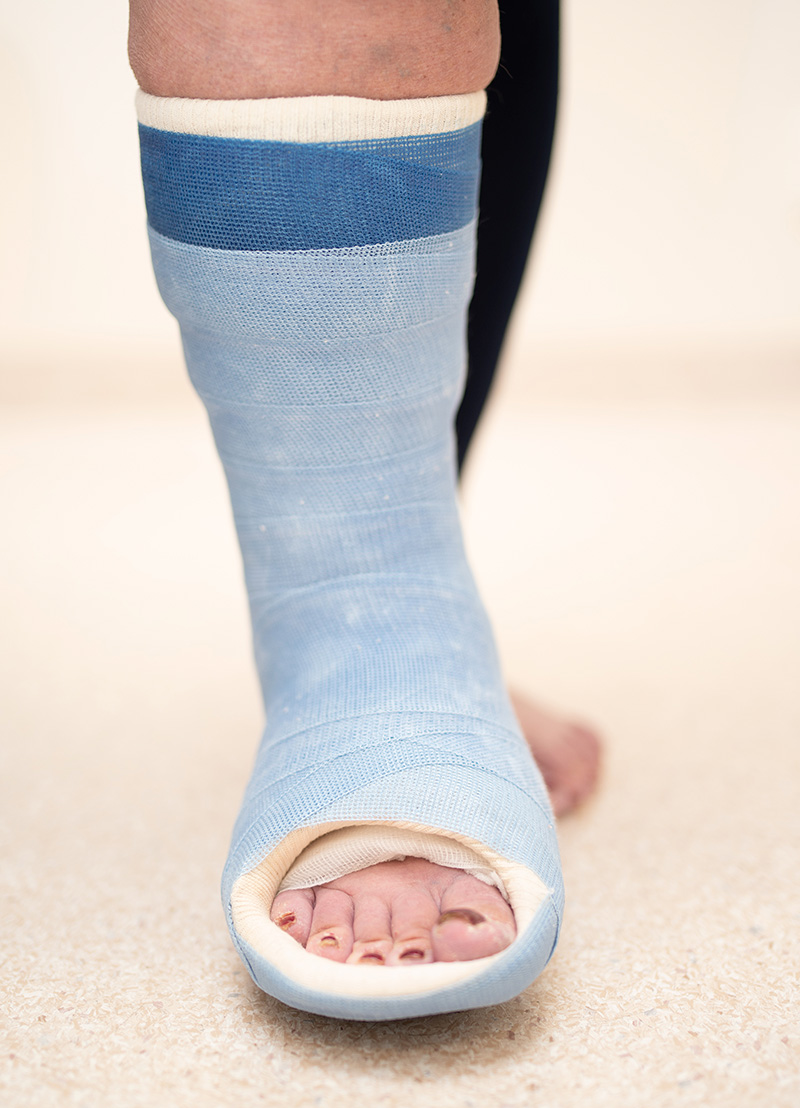
- optimal avlastning bör ske redan vid misstanke om akut Charcotfot, helst med en icke avtagbar gipsstövel
- MRT i nuläget är det mest tillgängliga och tillförlitliga diagnostiska hjälpmedlet för säkerställande av rätt diagnos och att en sådan ska genomföras innan misstanken om Charcotfot kan avskrivas eller bekräftas
- tidig diagnos och avlastning förebygger uppkomst av fotdeformiteter och synes kunna förkorta och bromsa sjukdomsförloppet
- det för närvarande saknas robust stöd för farmakologisk behandling i sjukdomens akuta fas.
Åsikterna går isär vad gäller
- hur MRT ska användas i uppföljningen efter inledd avlastning.
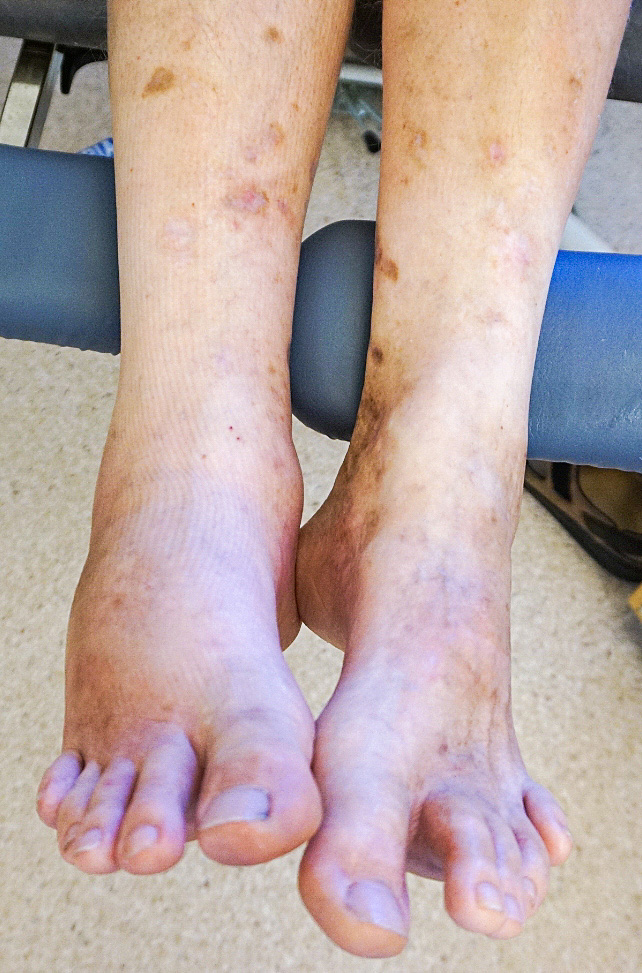
Charcotfot (efter Jean-Martin Charcot [1825–1893] som först beskrev sjukdomen) eller neuropatisk osteoartropati är ett sjukdomstillstånd som kan drabba individer med perifer neuropati. Tidigare var tillståndet vanligen förorsakat av alkoholism, neurosyfilis och lepra men är i västvärlden i dag huvudsakligen relaterat till diabetes mellitus (diabetesosteoartropati), även om alkohol, B12-brist och andra orsaker fortfarande förekommer. Sjukdomstillståndet drabbar foten, oftast mellanfoten, men kan även uppstå i andra leder såsom knäleden och handens leder. Sjukdomens uppkomstmekanism är inte helt klarlagd men innefattar i den akuta fasen en inflammatorisk reaktion i mjukdelar, benvävnad, leder och ligament med benresorption, frakturering, osteopeni och leddislokation som följd. Kliniskt drabbas hela eller delar av foten av en insättande svullnad, rodnad och värmeökning, och vid utebliven diagnos och behandling leder skelettfragmentering, led- och ligamentskador till allvarliga deformiteter såsom nedfallet fotvalv, klumpfot och destruerad fotled [1, 2].
Förekomst
Prevalensen av Charcotfot hos individer med diabetes varierar mellan olika studier och länder men har i västvärlden uppskattats till 0,1–1 procent [3]. Nyligen publicerade danska data uppskattade incidensen till 7,4 per 10 000 personer med diabetes [4]. Den låga incidensen innebär att en medelstor vårdcentral torde se mindre än ett fall per år och att enbart enstaka patienter uppsöker en akutmottagning, varför kännedom om Charcotfot krävs för att diagnosen ska misstänkas. Kunskap om sjukdomen är begränsad bland läkare som inte handlägger diabetesfotkomplikationer [5], något som möjligen förklarar varför Charcotfot ofta diagnostiseras sent [6]. Vidare visade en svensk enkätstudie att vården av konstaterad Charcotfot skiljer sig betydligt åt mellan olika orter i Sverige och att få centrum har vetenskapligt förankrade riktlinjer [7].
Riskfaktorer
Charcotfot kan drabba människor i alla åldrar, men insjuknande i 50–60-årsåldern är vanligast [8]. Då diabetesduration är en oberoende riskfaktor för att drabbas av Charcotfot, är patienter med typ 1-diabetes vid insjuknandet yngre än patienter med typ 2-diabetes [9]. Perifer neuropati föreligger alltid [10], medan perifer kärlsjukdom snarare tycks minska risken för Charcotfot [8]. Anamnes på tidigare fottrauma beskrevs i drygt en tredjedel av fallen i en observationsstudie [11]. I två studier var patienter med typ 2-diabetes som insjuknade i Charcotfot oftare män [12, 13]. Andra riskfaktorer inkluderar tidigare fotsår, nefropati, retinopati, högt HbA1c, ensamboende och långvariga promenader [8, 14], medan övervikt är en mer kontroversiell riskfaktor [8, 15].
Patofysiologi
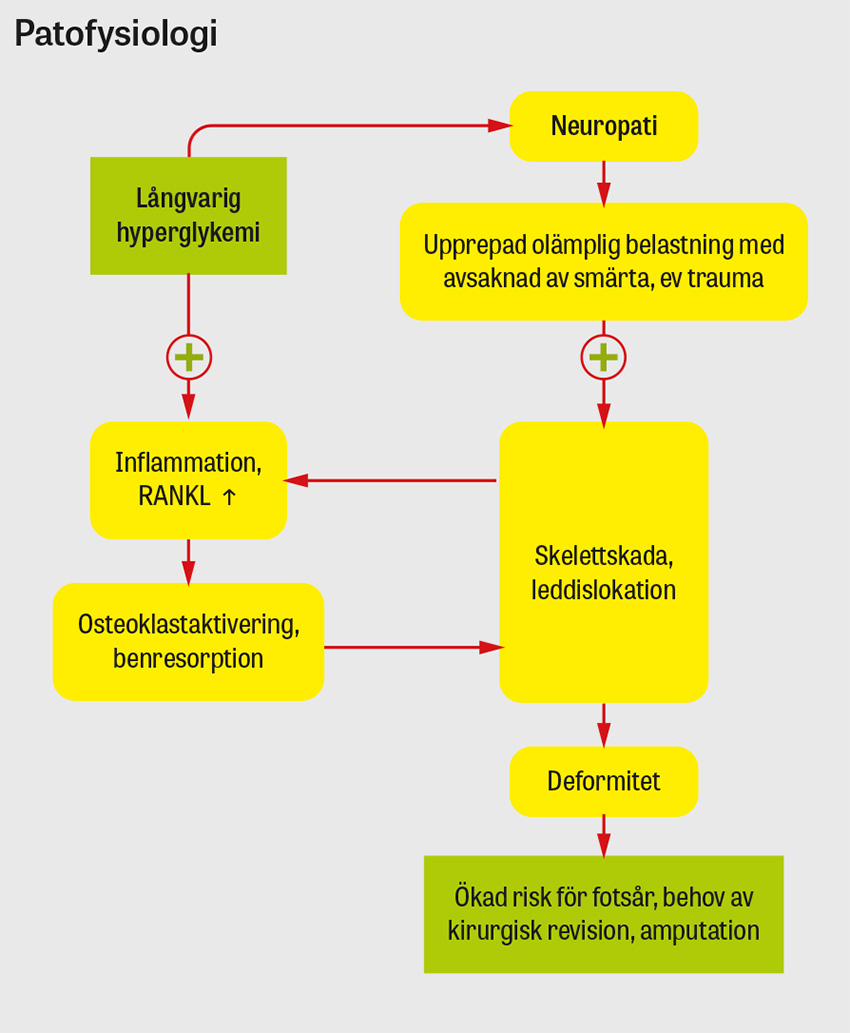
Patofysiologin är ofullständigt kartlagd. Inflammatoriska cytokiner som frisätts såväl vid skelettskada efter överbelastning eller trauma som vid långvarig hyperglykemi ökar frisättningen av cytokinet RANKL (receptor activator of nuclear factor κ-B ligand), som stimulerar differentiering av omogna makrofager till aktiverade benresorberande osteoklaster [1, 2, 16, 17]. Perifer neuropati tros leda till att sensoriska fibrers inverkan på benomsättningen, delvis via kalcitoningenrelaterad peptid (CGRP), blir störd, vilket även det leder till ökade nivåer av RANKL [18]. Benresorptionen sekundärt till lokalt ökad osteoklastaktivitet bidrar till frakturering när foten fortsätter att belastas [2], vilket leder till en självförstärkande ond cirkel. Det exakta sambandet mellan cytokinnivåer, belastning och avlastning är dock inte klarlagt; vissa studier visar till exempel högre nivåer av cytokiner, RANKL och skelettanabol aktivitet efter påbörjad avlastning [19-21].
Anamnes och status
I den akuta fasen är foten värmeökad, svullen och i varierande grad rodnad. Bakomliggande känselnedsättning föreligger alltid och patienterna är vanligen smärtfria, även om dov smärta förekommer [22, 23]. Ibland kan ett bakomliggande lindrigt fottrauma beskrivas, oftast inträffat flera dagar eller veckor tidigare [11]. Vid akut Charcotfot föreligger inte feber eller ökning av vanliga inflammationsmarkörer (CRP, LPK) [24]. I status noteras inflammationstecken inkluderande rodnad, svullnad och tydlig värmeökning jämfört med den kontralaterala foten. Om svullnad och värmeökning är utbredda är det i praktiken ofta svårt att avgöra vilken eller vilka skelettstrukturer som är drabbade. Tecken på perifer neuropati (känselnedsättning, vibrationssinnesnedsättning, klofotsdeformitet, hammartå, muskelatrofi, torr hud, avsaknad av behåring) stärker misstanken och bör noteras [2].
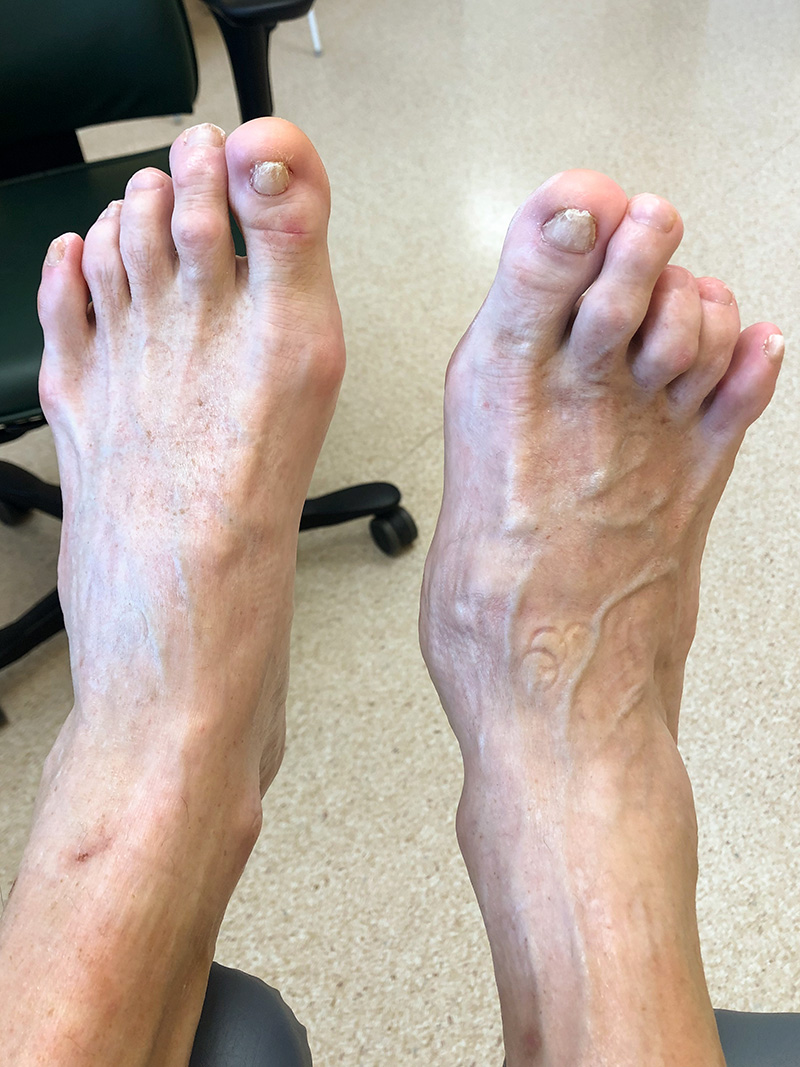
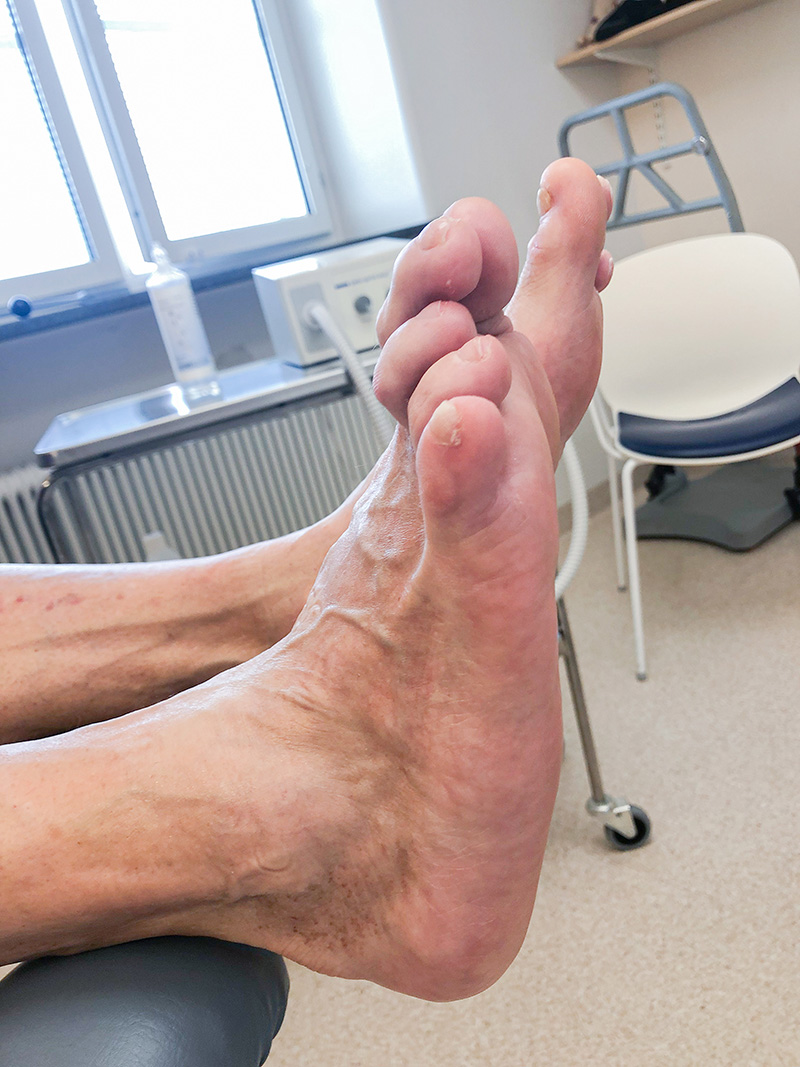
I regel är cirkulationen i foten god och tecken på arteriell insufficiens och ischemi är ovanliga. Om möjligt mäts hudtemperaturen med infraröd teknik; en temperaturökning på ≥ 2 °C gentemot den kontralaterala foten är förenlig med inflammatorisk aktivitet i Charcotfot [23]. Om tillståndet förelegat en längre tid (veckor) kan leddislokation och fotdeformitet ha tillkommit. När till exempel mellanfoten drabbas sjunker ofta den talonavikulara leden ned, os cuneiforme mediale devierar medialt och andra–femte tarsometatarsallederna devierar lateralt, så kallad »rocker bottom foot« eller gungstolsfot [25]. När den inflammatoriska fasen avklingat föreligger ingen temperaturökning, men varierande grad av fotdeformitet kan ses i många fall, i synnerhet om inte avlastning har skett i tidigt stadium [26]. I vissa fall kan kroniska Charcotdeformiteter redan finnas i den drabbade eller kontralaterala foten [11].
Bilddiagnostik
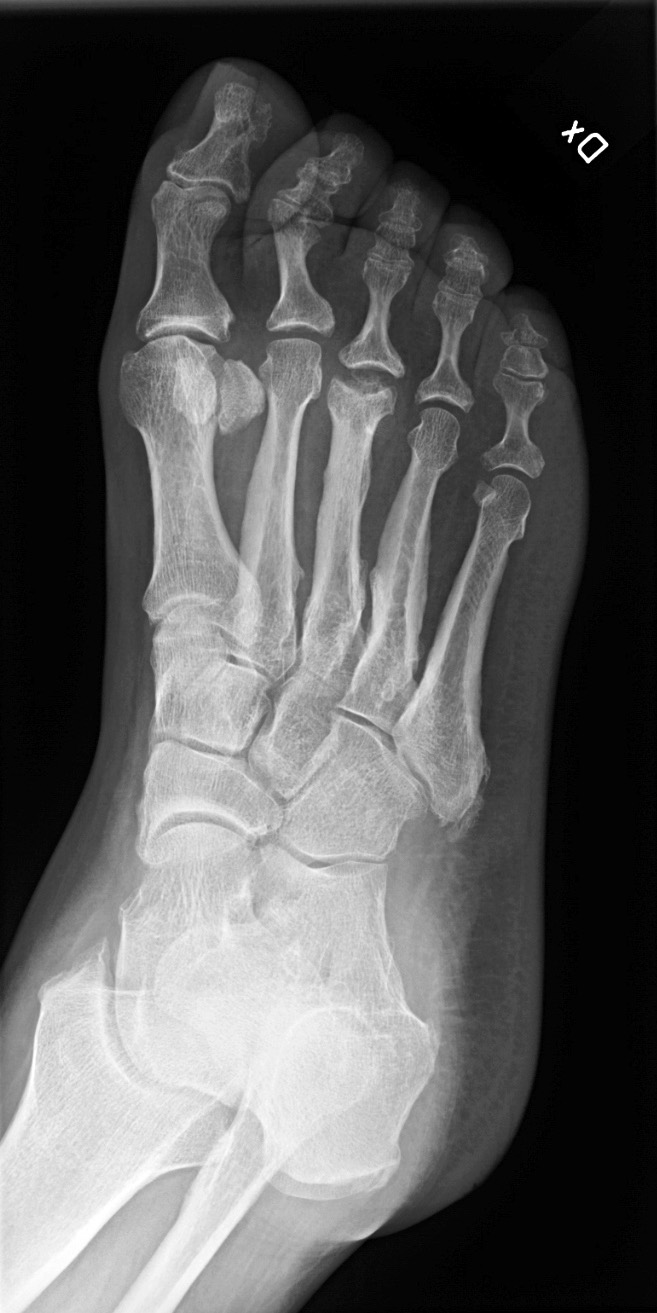
Slätröntgen utförd i den tidiga fasen av akut Charcotfot visar inga skelettförändringar (grad 0) men bör alltid genomföras för att utesluta fraktur och kartlägga om Charcotfot med skelettförändringar har hunnit uppstå (grad 1). Det kan däremot inte nog betonas att normalt fynd vid slätröntgen av foten inte på något sätt utesluter akut Charcotfot [27].
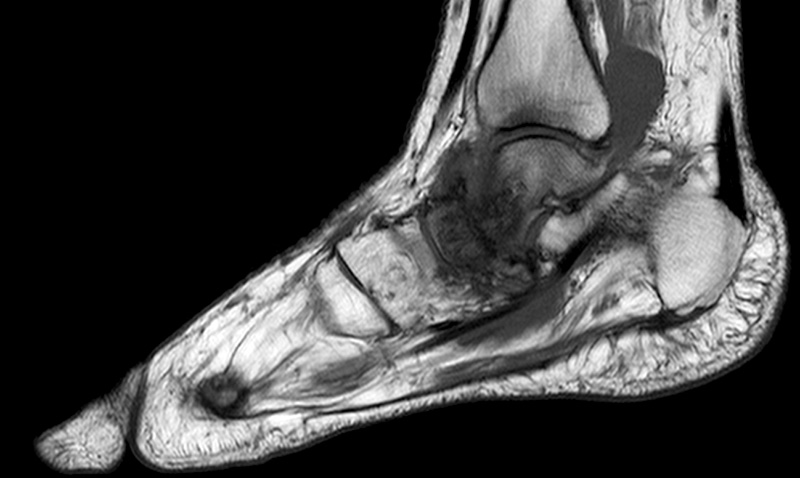
I motsats till slätröntgen har magnetresonanstomografi (MRT) hög sensitivitet och specificitet även i den tidiga fasen, och normalt fynd vid MRT talar starkt emot Charcotfot [25]. På MRT ses i den tidiga fasen benmärgsödem i de drabbade benen. MRT kan dessutom vanligen, men inte alltid, särskilja Charcotfot från osteomyelit, då förändringarna vid Charcotfot i regel har en periartikulär utbredning [28]. Då MRT i regel inte görs akut måste initiala beslut baseras enbart på klinisk misstanke.
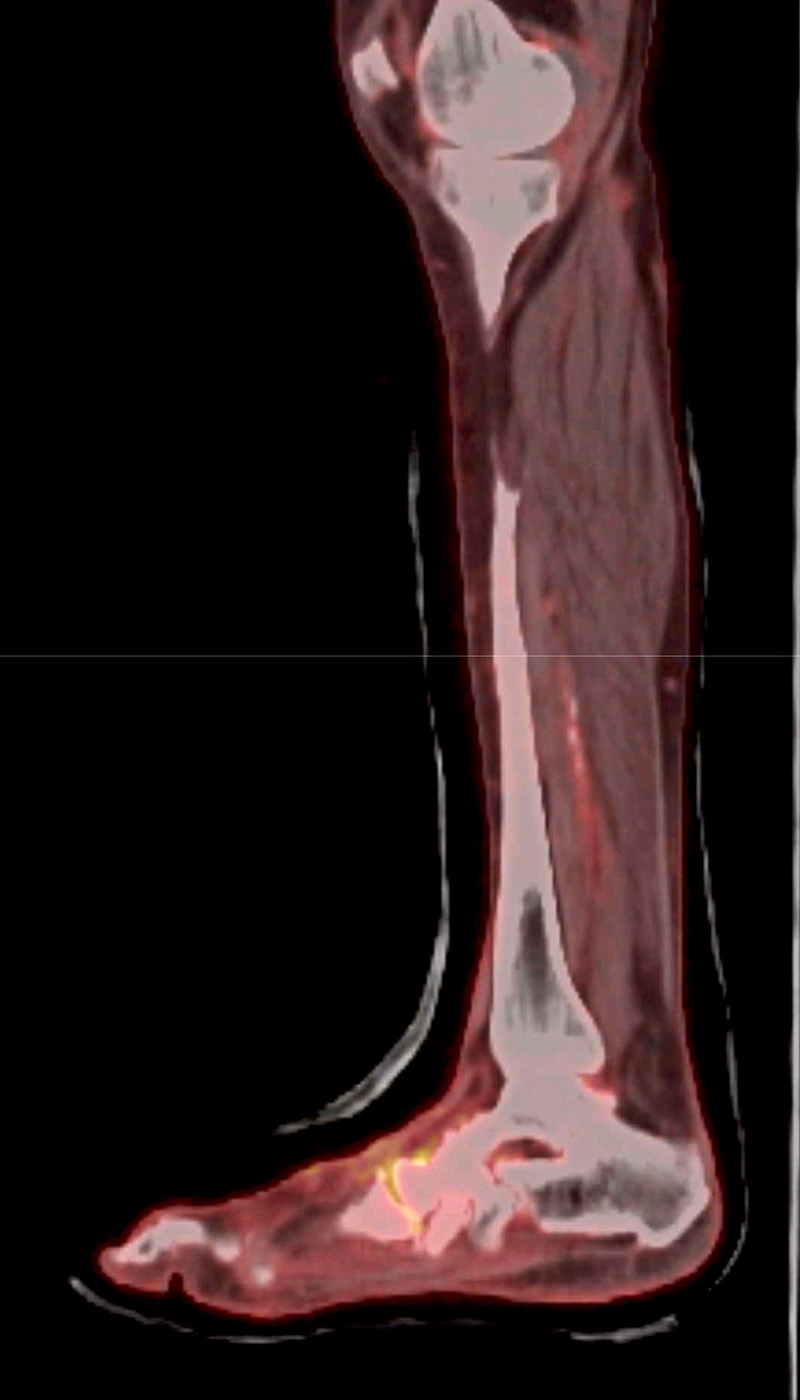
Positronsemissionstomografi med datortomografi (PET-DT) har visats kunna särskilja diagnoserna ännu bättre än MRT [29]. Vid kontraindikation för MRT (till exempel pacemaker) kan skelettskintigrafi användas med hög sensitivitet för Charcotfot, men denna modalitet kan inte alls särskilja Charcotfot från osteomyelit [23].
Differentialdiagnoser
Akut inflammation med rodnad och svullnad i foten kan orsakas av ytlig eller djup infektion såsom cellulit, erysipelas respektive osteomyelit. Vid dessa tillstånd är inflammationsmarkörer (CRP, LPK) i allmänhet förhöjda, och även feber kan i mer uttalade fall föreligga; vid Charcotfot är vanligen inflammationsmarkörer relativt opåverkade.
Vid osteomyelit är ett tidigare eller aktuellt sår en väsentlig förutsättning, men ett samtidigt neuropatiskt sår kan även föreligga vid Charcotfot, varför utredningen då måste kompletteras med MRT och vid behov PET-DT.
Giktartrit brukar typiskt drabba MTP-1-leden, vilken sällan drabbas vid Charcotinsjuknande. Giktartriter i fotleden eller mellanfotens leder kan dock vara svåra att särskilja från Charcotfot: ledpunktion kan vid oklara fall övervägas när anamnes, status, P-urat och bilddiagnostik inte vägleder [23].
Vid svullnad över fot och fotled utan egentlig smärta utgör djup ventrombos en diagnostisk möjlighet, varför somatisk undersökning även bör inkludera underbenet och vaden. Kontusion eller fraktur kan vid perifer neuropati ge liknande symtom utan uttalad smärta; anamnes och slätröntgen är vägledande.
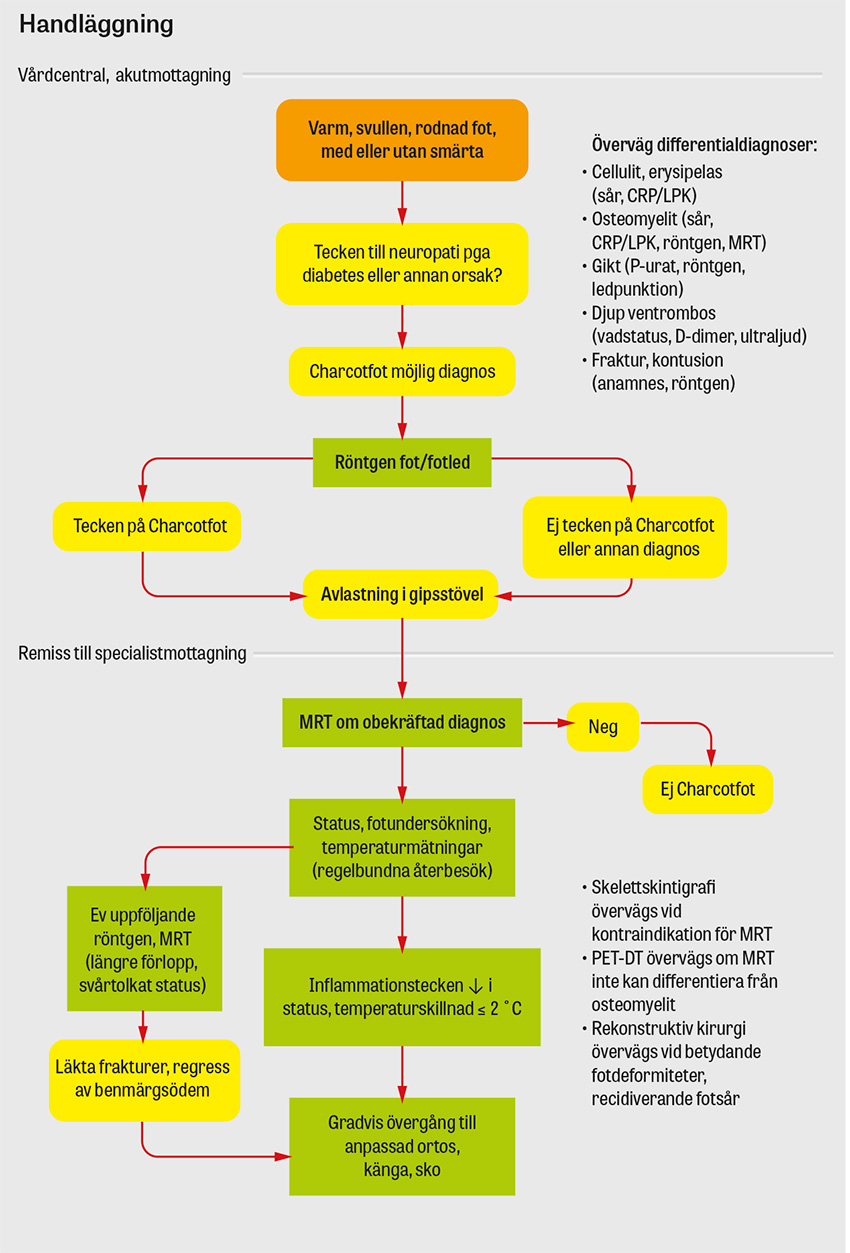
Handläggning
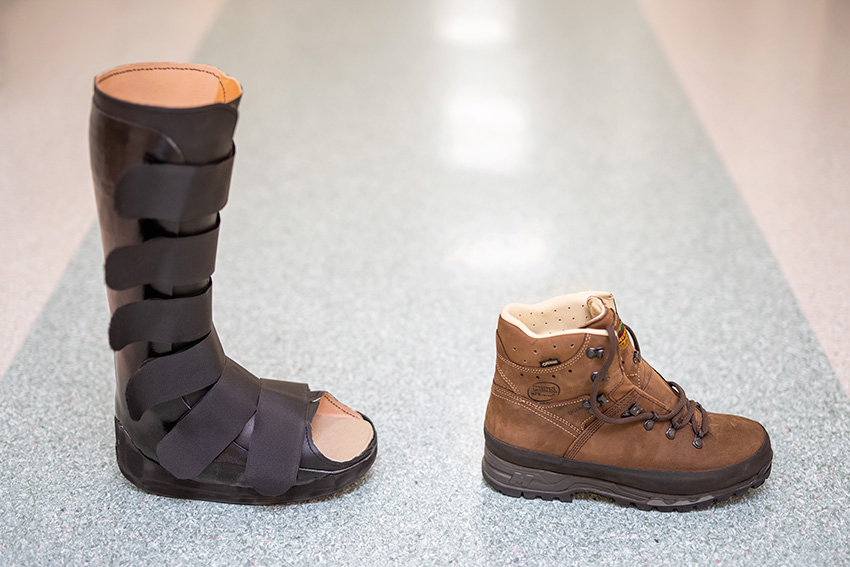
Vid kliniskt misstänkt eller slätröntgenverifierad Charcotfot bör foten omedelbart avlastas (före eventuell MRT), initialt med kryckor och snarast möjligt med en icke avtagbar gipsstövel, då avtagbara lösningar alltid har sämre ordinationsföljsamhet, vilket visats förlänga avlastningsperioden [11, 23]. I regel görs gipsstöveln belastningsbar, men beroende på det kliniska svaret kan total avlastning i gips krävas [1]. Kan gipsbehandling inte påbörjas samma dag bör avlastning med kryckor kombineras med en prefabricerad ortos.
Alla misstänkta fall ska efter optimerad avlastning halvakut remitteras till en specialistmottagning som handlägger Charcotfot (vilket i Sverige brukar vara antingen diabetesfotmottagning eller ortopedmottagning) där den fortsatta vården bedrivs. För att undvika skavsår under gipsbehandlingen är adekvat polstring viktig, och omgipsning bör initialt ske minst varje vecka eftersom foten sväller av när den inflammatoriska komponenten avtar under gipsbehandlingen [25]. Gipsbehandlingen bör fortsätta tills kliniska tecken på aktiv inflammation inte längre finns, vilket brukar kunna bekräftas genom uppmätt temperaturskillnad på ≤ 2 °C jämfört med den kontralaterala foten [30]. I de allra flesta studier har genomsnittlig eller median gipstid på 3–9 månader setts [31]. Vid långvariga eller tveksamma fall (eller om jämförelse med den andra foten inte låter sig göras) kan bland annat regress av benmärgsödem på uppföljande MRT bidra till bedömningen [32]. En pågående randomiserad studie väntas ge svar på vilket kliniskt värde rutinmässig uppföljning med MRT har [33].
När den akuta inflammatoriska fasen är över kan belastningen av foten gradvis ökas, initialt i ortopedtekniskt anpassad ortos, därefter med anpassade kängor och slutligen anpassade skor med inlägg, allt för att undvika deformitet och återfall och minska risken för fotsår [23].
Farmakologisk behandling
Huvudsakligen har behandling med intravenösa bisfosfonater undersökts i ett fåtal studier, varav tre randomiserade [34-36]. Olika utfallsmått har använts, såsom skelettmetabola markörer, smärta, fottemperatur och immobiliseringstid. I två studier (varav en randomiserad) påvisades en längre immobiliseringstid hos patienter som bisfosfonatbehandlats [11, 35]. I en randomiserad studie förelåg ingen signifikant skillnad mellan bisfosfonater och placebo, medan metylprednisolon orsakade förlängd immobiliseringstid [36]. Denosumab (monoklonal antikropp mot RANKL) i endosförfarande var förknippat med kortare immobiliseringstid i en liten studie med en historisk kontrollkohort [37]. Kalcitonin [38] och teriparatid [39] har studerats utan övertygande positivt utfall. Mot bakgrund av rådande kunskapsläge rekommenderas inte farmakologisk behandling i nuläget [40].
Korrigerande kirurgi
Om utvecklade fotdeformiteter ger upphov till svårläkta sår, trots optimala ortopedtekniska hjälpmedel, övervägs rekonstruktiv kirurgi. Korrigerande åtgärder inkluderar allt från borttagande av protruderande ben till mellanfotsartrodes [1]. Vid fotleds-Charcot föreligger ökad risk för varus-/valgusdeformitet, vilken kan indicera korrigerande kirurgi med intern eller extern fixation [41]. All korrigerande kirurgisk behandling ska undvikas så länge den inflammatoriska fasen föreligger [1].
Prognos
Recidivfrekvensen ipsilateralt har rapporterats till 7–23 procent medan risken för senare kontralateralt insjuknande varierar mellan 2 och 32 procent i olika studier [42]. Risken för åtföljande multipla neuropatiska trycksår och amputationer är förhöjd hos de som drabbas av Charcotfot: i en studie 65 respektive 25 procent [43]. I studier av livskvaliteten har framför allt den fysiska aspekten visat sig försämras [44-46]. Hos arbetsföra personer uppstår ofta en långvarig sjukskrivningsprocess; i en dansk studie förlorade 61 procent av anställda patienter sitt arbete på grund av sjukdomen [13]. Uppskattningen av framtida mortalitet hos drabbade individer har varierat betydligt, till exempel har 5-årsmortaliteten rapporterats till mellan 14 och 41 procent i olika studier [13, 43, 46-48]. Mortaliteten har visat sig vara högre än för patienter med diabetes överlag, men lägre än hos patienter med diabetiska fotsår [48].
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.