De flesta är ense om att
- kroniskt subduralhematom är ett av de vanligaste tillstånden som kräver neurokirurgi
- incidensen ökar i takt med den åldrande befolkningen
- avsaknad av skalltrauma i anamnesen inte utesluter kroniskt subduralhematom
- kliniskt signifikanta kroniska subduralhematom bör opereras.
Åsikterna går isär vad gäller
- hur ett kroniskt subduralhematom uppstår
- den optimala operationstekniken
- hur blodförtunning ska hanteras
- rollen av farmakologisk och endovaskulär behandling.
Ett kroniskt subduralhematom är en ansamling av äldre blod och vätska mellan den hårda hjärnhinnan (duran) och spindelvävshinnan (araknoidean). Det är ett av de vanligaste tillstånden som kräver neurokirurgi, med en incidens på upp till 60 per 100 000 invånare i Skandinavien [1]. Antalet patienter förväntas stiga ytterligare i takt med den åldrande befolkningen och den ökade förskrivningen av blodförtunnande läkemedel [2, 3]. I och med detta kommer behovet av kunskap kring diagnosen att öka hos samtliga sjukvårdsinstanser. I denna ABC-artikel går vi igenom patofysiologi, diagnostik och handläggning av kroniskt subduralhematom.
Patofysiologi
Etiologin till kroniskt subduralhematom är multifaktoriell, och trauma, inflammation, angiogenes och fibrinolys samspelar [4]. Den ledande teorin är att det uppstår när ett ytligt cellager i duran skadas, oftast i samband med en lindrig skallskada. Detta cellager är uppbyggt av fibroblaster utan så kallade »tight junctions« eller kollagen – det är således en lucker struktur utan större förankring mellan dura och araknoidea [5]. Duraskadan leder till extravasering av vätska som innehåller inflammatoriska mediatorer och blod, tillflöde av cerebrospinalvätska in i subduralrummet samt en rekrytering av inflammatoriska celler som initierar en cykel med inflammation, angiogenes och fibrinolys. I denna process skapas ett inkapslande hematommembran, i vilket ett inflöde av tillväxtfaktorer bildar högpermeabla och sköra kärl, vilket leder till ytterligare vätskeutträde och mikroblödningar. Denna cykel av inflammation, angiogenes, mikroblödning och vätskeutträde kan pågå under veckor till månader och skapar därmed den potentiellt expansiva vätskeansamling som vi benämner kroniskt subduralhematom [4]. Ovanstående cykel kan även initieras när ett akut subduralhematom med tiden bryts ned.
Riskfaktorer
Den vanligaste riskfaktorn bakom kroniskt subduralhematom är en traumatisk skallskada, oftast en lindrig sådan. En större prospektiv serie rapporterade ett föregående skalltrauma hos cirka 70 procent av dem som opererades för ett kroniskt subduralhematom [6]. En invändningsfri datortomografi (DT) vid skadetillfället utesluter dock inte att ett kroniskt subduralhematom senare kommer att bildas. Patienter som är lättblödande har också förhöjd risk, vilket framför allt inbegriper dem med blodförtunnande behandling, men även hematologisk malignitet, leversjukdom och medfödda blödningssjukdomar. Hög ålder ökar också risken att drabbas, dels på grund av ökad falltendens och högre användning av blodförtunnande läkemedel, men även då atrofiskt hjärnparenkym applicerar ett lägre tryck mot cellagret, vilket gör att det subdurala spatiet lättare uppstår [4]. Kroniskt alkoholberoende är en annan känd riskfaktor, sannolikt på grund av ökad fallbenägenhet, hjärnatrofi och koagulopati [7].
Symtom
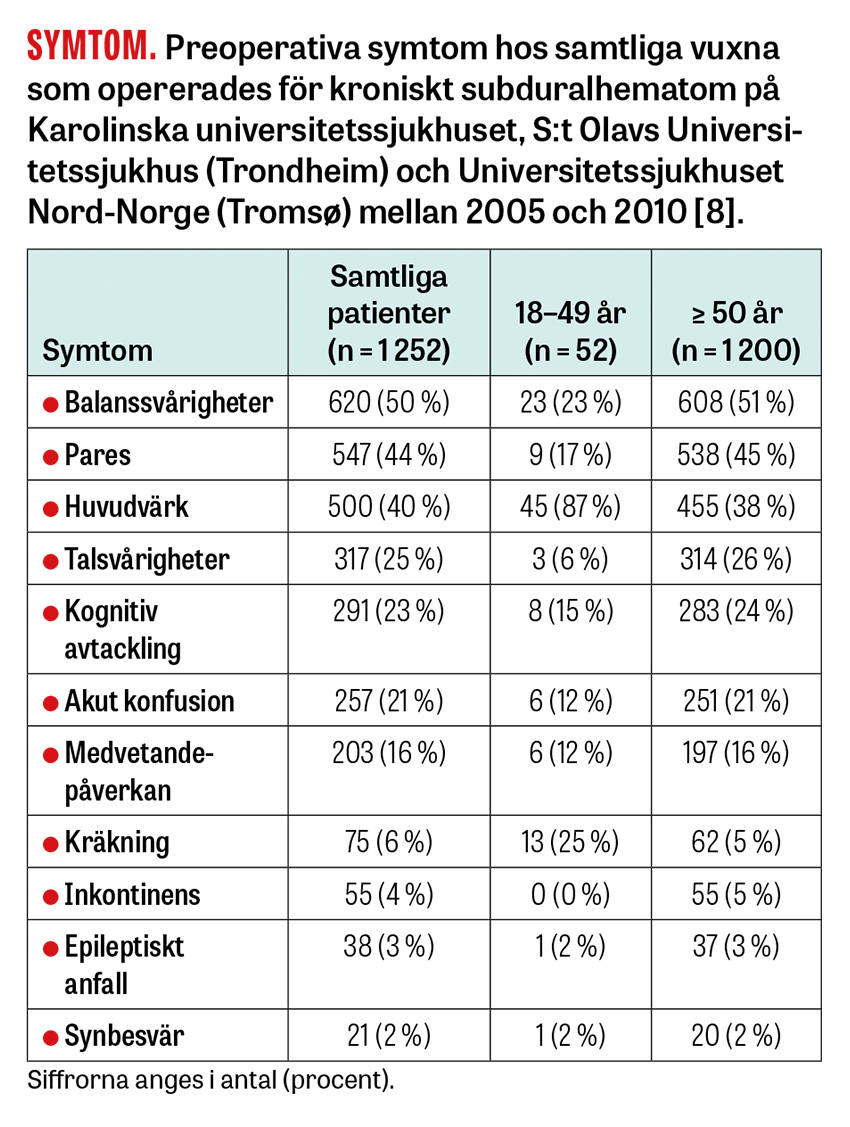
Symtom uppstår när trycket från blödningen överstiger hjärnans kompensationsmekanism. De kan vara både globala (t ex förvirring, huvudvärk och ostadighet) och fokala (t ex pareser och dysfasi/afasi) [5]. Symtomdebuten kan också vara akut eller smygande, vilket gör att patienterna kan söka sig såväl till akutmottagning som till primärvården. Som kliniker kan man misstänka kroniskt subduralhematom om en patient söker för något av symtomen i tabellen intill och har huvudskada i anamnesen, inte minst om de också är äldre och står på blodförtunnande behandling. Det varierande sjukdomsförloppet gör dock att diagnosen ofta påträffas som bifynd när andra cerebrala diagnoser misstänkts, till exempel stroke, demens eller hjärntumör.
Eftersom ett kroniskt subduralhematom expanderar med lågt tryck under längre tid (veckor till månader), kan det uppnå relativt stor volym innan symtom uppstår. Det är dock viktigt att veta att fall av snabb försämring relaterad till inklämning förekommer även då skadan är »gammal«, framför allt vid bilateralt kroniskt subduralhematom [5] samt hos yngre, som har större hjärnvolym och oftare söker med enbart huvudvärksbesvär [8].
Diagnostik
Kroniskt subduralhematom diagnostiseras med nativ DT av hjärna. Typisk bild är en låg- (< 30 Hounsfield-enheter [HU]) eller isoattenuerande (30–60 HU) vätskeansamling längs hjärnans konvexitet, där även högattenuerande (> 60 HU) inslag kan förekomma [5]. Äldre blödningar brukar vara mer lågattenuerande. Diagnosen kan även påvisas med magnetkameraundersökning, då ofta som bifynd när andra diagnoser misstänkts.
Handläggning
Konsensus är att större symtomgivande subduralhematom ska behandlas kirurgiskt. Några välgrundade riktlinjer för vilka som bör opereras finns tyvärr inte, men en tumregel är att hematom som är bredare än 1 cm och ger upphov till symtom ofta kräver kirurgi [7]. Avsaknaden av höggradig evidens gör att varje patientfall behöver diskuteras individuellt med neurokirurg. Faktorer som påverkar beslutet om kirurgi är bland annat blödningens storlek, attenueringsgrad, lokalisation och masseffekt samt patientens symtom och eventuella samsjuklighet. Till skillnad från många andra neurokirurgiska ingrepp så talar mycket för att operation vid kroniskt subduralhematom har ungefär samma komplikationsfrekvens hos äldre som hos yngre patienter, och det finns således ingen övre åldersgräns för ingreppet [1].
För små hematom med inga/lindriga symtom kan konservativ behandling ibland vara lämplig. Målet är då att blödningen ska gå i regress eller kvarstanna utan att bli expansiv. Dessa patienter brukar följas radiologiskt och/eller kliniskt tills risken för att hematomen kan bli utrymningskrävande är låg. Om blödningen i stället blir större och/eller patienten utvecklar symtom kan konvertering till kirurgi bli nödvändig.
Kirurgisk behandling
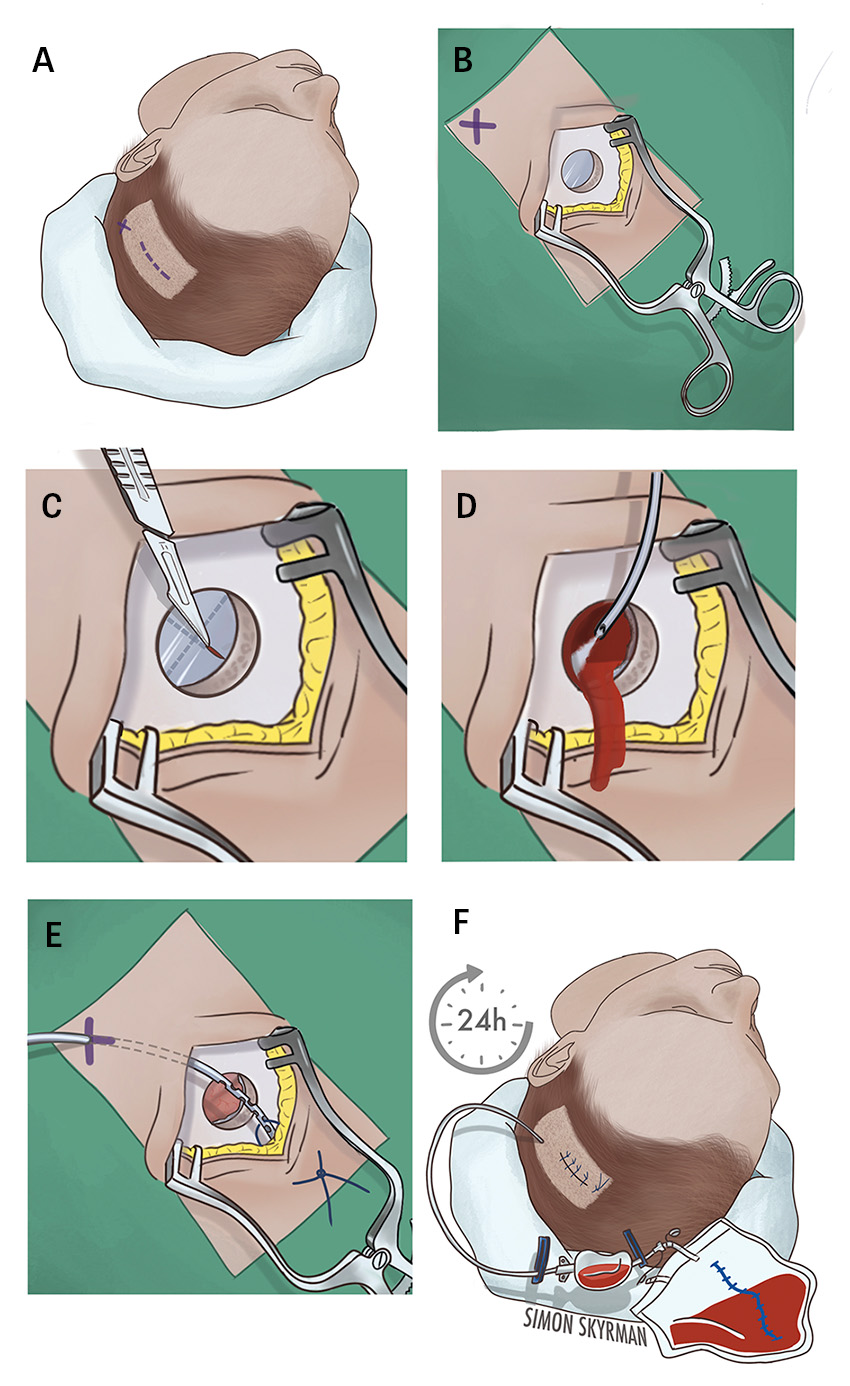
Metod. Operation av kroniskt subduralhematom går ut på att minska trycket mot hjärnan samt ersätta det utvidgade subduralrummet med en vätska som kan resorberas (t ex Ringer-acetat eller natriumklorid). Oftast används en kombination av ett eller flera borrhål i kraniet (alternativt en mindre kraniotomi) för att tömma blödningen, följt av renspolning av subduralrummet och anläggande av ett temporärt dränage som förhindrar att utrymmet där blodet var ansamlat fylls på nytt [9, 10]. Operationen kan göras i lokalanestesi och genomförs på samtliga neurokirurgiska kliniker i Sverige samt av allmänkirurger på vissa regionsjukhus.
Efter operationen kan patienterna ofta skrivas ut till hemmet eller rehabilitering inom ett par dagar. Risken för operationskrävande recidiv är dock tämligen hög, mellan 10 och 20 procent, varav de flesta sker inom 1–2 månader från första operationen [5]. Riskfaktorer för recidiv är bland annat blodförtunnande medicinering [11] samt bilaterala och stora blödningar [12].
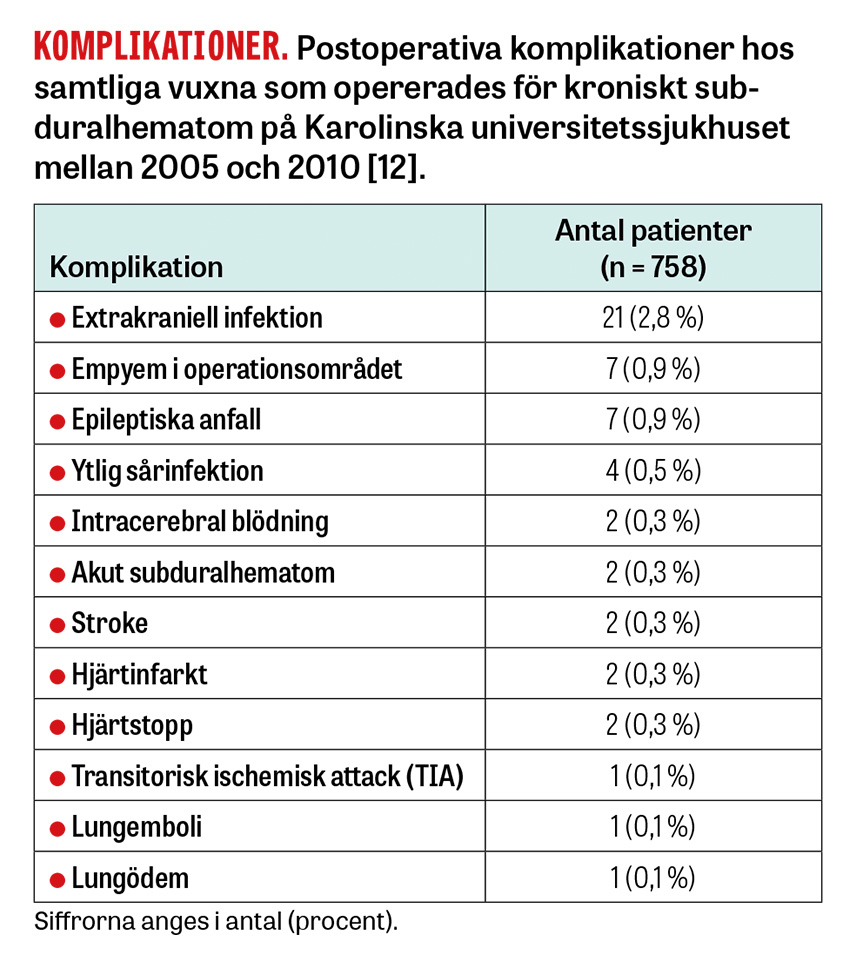
Komplikationer och prognos. I en genomgång av opererationerna som utförts i Stockholm var de vanligaste postoperativa komplikationerna extrakraniella infektioner (2,8 procent), intrakraniella empyem (0,9 procent) och epileptiska anfall (0,9 procent). Potentiellt livshotande komplikationer sågs hos cirka 3 procent, vilka bland annat innefattade ischemisk stroke och hjärnblödningar, men även extrakraniella händelser såsom hjärtinfarkt, sepsis och hjärtstopp [12].
Om patienter opereras innan symtomen blir för uttalade finns goda möjligheter till tillfrisknande. Däremot kan blödningar som inte behandlas i tid ge bestående skador eller leda till död. I ett stort prospektivt material, där 94 procent opererades, var 91 procent av patienterna i gott neurologiskt skick efter 6 månader (definierat som 0–3 poäng på den modifierade Rankin-skalan), varav 48 procent var symtomfria [6]. Vissa data tyder dock på att dessa patienter har en överdödlighet upp till ett år efter kirurgi [13], vilket kan tala för att ett kroniskt subduralhematom ibland bara är »toppen av ett isberg« hos svårt sjuka patienter.
Hantering av blodförtunnande läkemedel
Vedertagna riktlinjer för hantering av trombocythämmare och antikoagulantia vid kroniska subduralhematom saknas. Om patienten behandlas med trombocythämmare eller antikoagulantia brukar dessa sättas ut tills vidare vid nyupptäckt kroniskt subduralhematom. I vissa fall, om blödningen är liten och den tromboemboliska risken hög, kan man testa att behålla blodförtunningen med tät radiologisk uppföljning och noggrann instruktion till patienten att söka vård vid försämring. Högre grad av evidens som stödjer denna behandlingsstrategi saknas dock.
För patienter som ska opereras brukar ett preoperativt behandlingsuppehåll på 3–5 dagar behövas för att minska risken både för intraoperativ komplikation och för postoperativt recidiv. Vid mer brådskande kirurgi används farmakologisk optimering av hemostasen. Exempelvis ges Praxbind (idarucizumab) vid dabigatranbehandling eller K-vitamin och protrombinkomplexkoncentrat vid warfarinbehandling. Man kan även överväga protrombinkomplexkoncentrat vid behandling med apixaban, edoxaban eller rivaroxaban, samt trombocyttransfusion vid trombocythämmare. Detta kan med fördel föregås av diskussion med koagulationskonsult.
När patienten skrivs ut efter kirurgi uppkommer ofta frågan om när återinsättning av blodförtunning kan ske. Tyvärr begränsar bristen på evidens även möjligheterna att utforma välgrundade riktlinjer för detta. I Stockholm har det visat sig att återinsättning av trombocythämmare inom 30 dagar från kirurgi ledde till samma recidivfrekvens men färre tromboemboliska komplikationer jämfört med återinsättning efter 30 dagar [14], och en tumregel brukar vara att återinsättning av antikoagulantia eller trombocythämmare kan ske inom en till ett par veckor. Faktorer såsom indikationen för blodförtunning, patientens ålder och samsjuklighet samt framtida fallrisk måste dock tas i beaktande. DT inför återinsättning bör övervägas för att utesluta recidiv, i synnerhet om patienten har kvarstående neurologiska symtom. Vid betydande tromboembolisk risk kan tidigare återinsättning med en tät klinisk och radiologisk uppföljning ibland vara indicerad.
Alternativ farmakologisk behandling
Då kroniska subduralhematom involverar inflammatoriska processer har det spekulerats om huruvida kortikosteroider kan vara ett alternativ till kirurgi eller användas postoperativt för att minska risken för recidiv. Nyligen publicerades dock en randomiserad placebokontrollerad studie som visade att dexametason i tillägg till kirurgi visserligen minskade recidivfrekvensen men samtidigt ökade komplikationsfrekvensen och resulterade i ett sämre neurologiskt utfall [6]. En annan studie, där patienter randomiserades till antingen kirurgi eller dexametason, fick nyligen avslutas i förtid på grund av sämre utfall hos den steroidbehandlade gruppen [15]. Andra läkemedel är under utvärdering, bland annat tranexamsyra och statiner [16], men än så länge finns det ingen högre evidensgrad som stödjer farmakologisk behandling.
Endovaskulär behandling
Embolisering av arteria meningea media har presenterats som en möjlig behandling av kroniskt subduralhematom, antingen som monoterapi eller postoperativt hos dem med hög risk för recidiv. Tanken är att åtgärden devaskulariserar hematomkapseln och därmed minskar vätskeutträdet och mikroblödningarna som driver blödningens tillväxt. Evidensen är just nu begränsad till observationella data [17], men flera randomiserade studier pågår.
Framtidsperspektiv
Kroniskt subduralhematom är ett av de vanligaste neurokirurgiska tillstånden, och incidensen förväntas öka. Trots detta råder brist på höggradig evidens avseende dess behandling. För närvarande är kirurgisk utrymning förstahandsalternativet när symtom uppträtt. Studier av operationsmetod, uppföljning och farmakologisk och endovaskulär behandling pågår och kan komma att ändra handläggningen framgent.
Läs även författarintervjun med Alexander Fletcher-Sandersjöö
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
(uppdaterad 2023-02-15)