De flesta är ense om att
- patienter med medvetanderubbning gagnas av ett strukturerat omhändertagande
- att hypoglykemi ska upptäckas och åtgärdas i tidigt skede.
Åsikterna går isär vad gäller
- indikation för endotrakeal intubation vid vakenhetssänkning
- huruvida DT hjärna bör vara en rutinundersökning hos medvetandesänkta patienter.
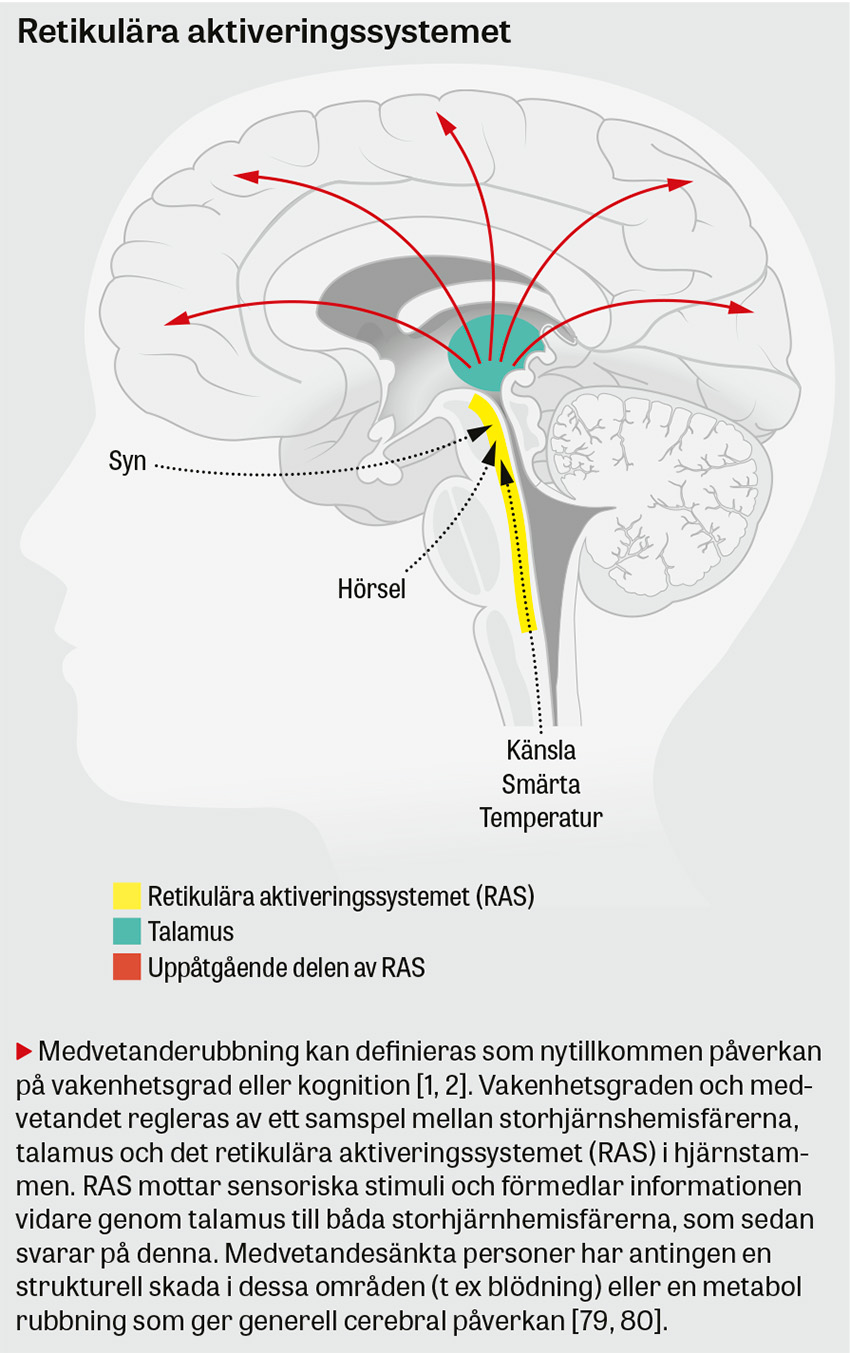
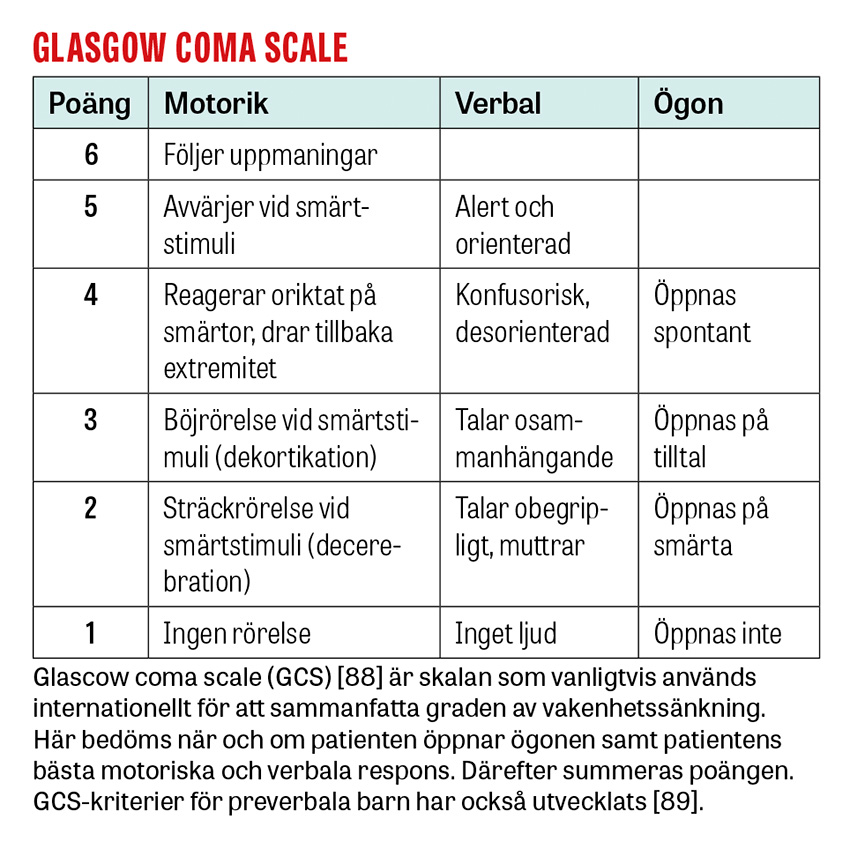
Medvetanderubbning kan definieras som nytillkommen påverkan på vakenhetsgrad eller kognition [1, 2]. Det förekommer hos 0,5–5 procent av patienter på akuten [1, 3-6] och 10–20 procent av patienter >70 år [7-9]. Konfusion missas hos 65–75 procent av drabbade patienter på akuten [10] och utgörs i 90 procent av fall av psykomotorisk förlångsamning [11]. Medvetanderubbning är associerad med 8–35 procents mortalitet [1, 3-6]. Majoriteten av fallen orsakas av intoxikation, strukturell hjärnskada eller systemisk infektion [1-3, 5, 12, 13]. Denna patientkategori fordrar ett systematiskt omhändertagande som identifierar tillstånd där tidig behandling är avgörande för prognos.
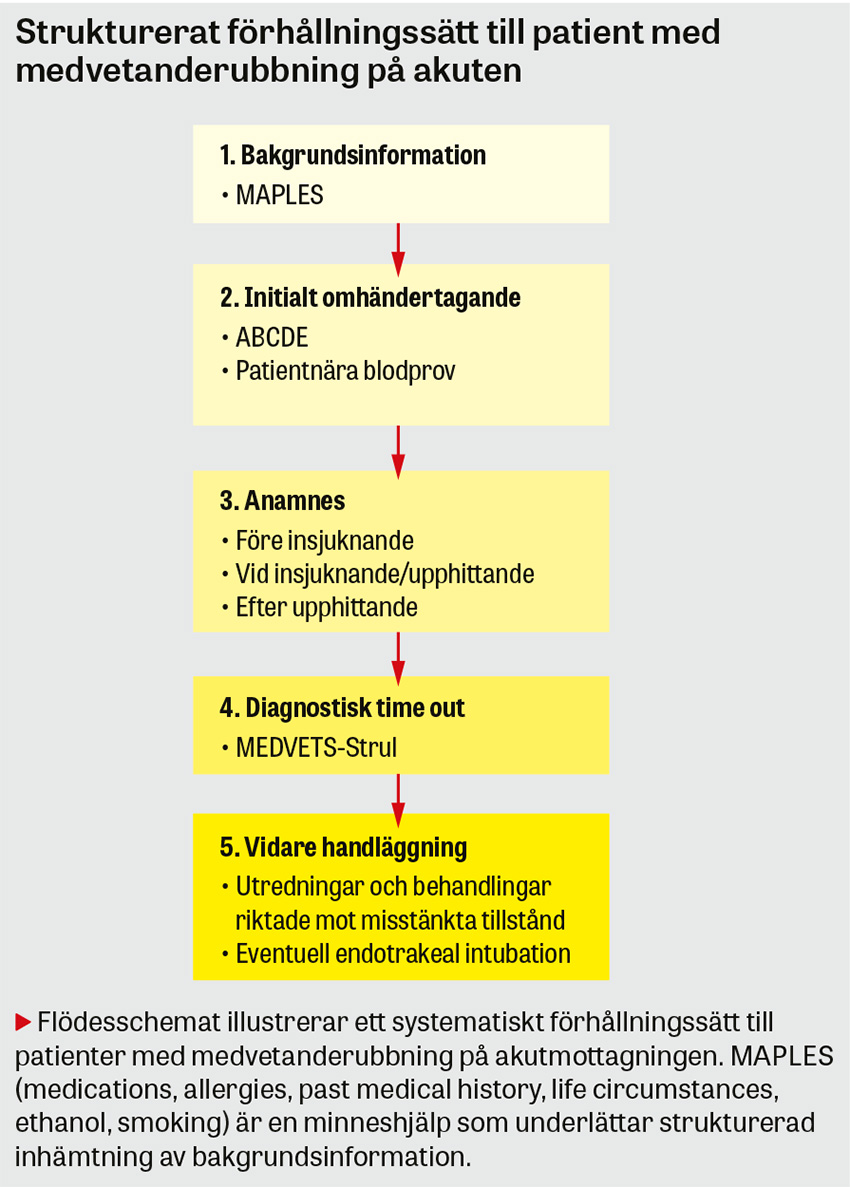
Steg 1. Patientbakgrund
Före patientmötet inhämtas sjukdomshistorien från journalen. Enligt en studie av 317 patienter bidrog sjukdomshistorien till diagnostiken i 43 procent av fallen [1].
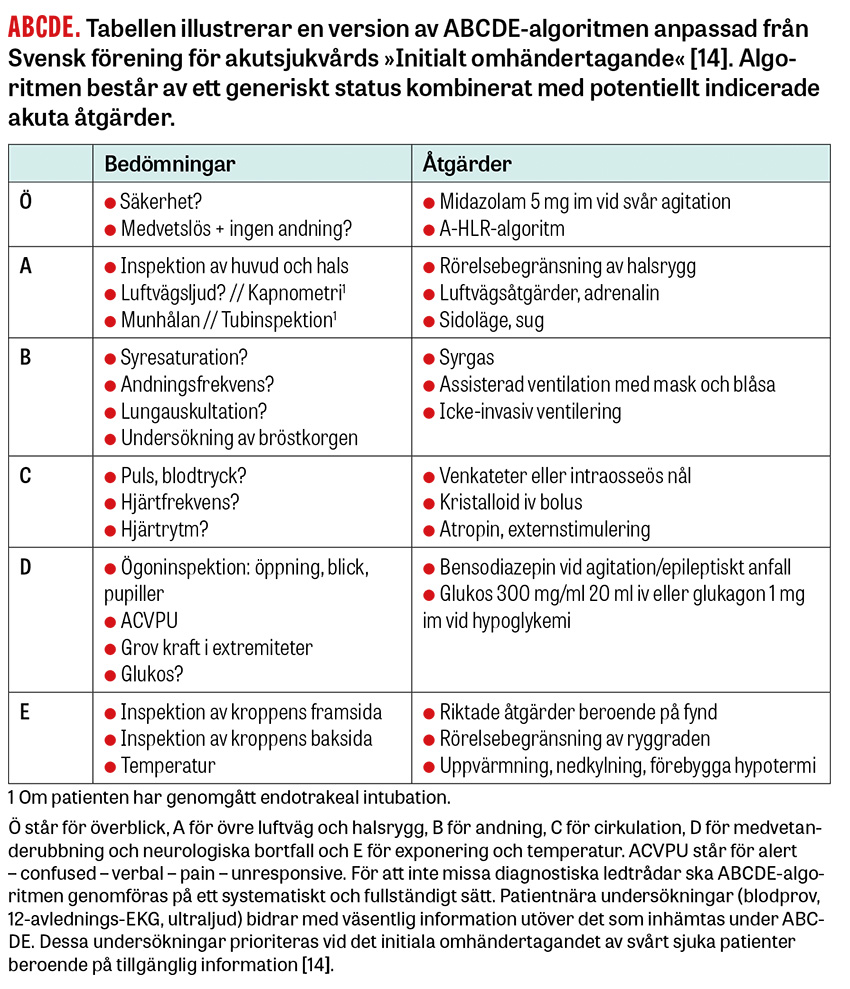
Steg 2. ABCDE och patientnära blodprov
Målen med handläggning enligt ABCDE-konceptet är att
- understödja hjärnans tillgång till syre och glukos
- utgöra ett generiskt status som möjliggör igenkännande av det tillstånd patienten lider av [14].
I en studie bidrog status till diagnostiken i 40 procent av fallen [1], och i en annan studie bidrog status i kombination med datortomografi av hjärnan i 23 procent av fallen [15].
A. Övre luftväg och stabilisering av halsryggen
Ofri luftväg löses med mekaniska handgrepp eller supraglottiska medel. Om patienten inte är djupt medvetandesänkt kan svalgtub utlösa kräkning [16], och då är näskantarell ett bättre alternativ. Så länge luftvägen är fri fattas beslutet om intubation efter genomgången ABCDE-undersökning. Det kan dock redan vid A vara indicerat att tillkalla personal med intubationskompetens.
Tecken på trauma mot huvudet ökar sannolikheten för intrakraniell blödning, särskilt om patienten tar antikoagulantia eller trombocythämmare. Hos äldre patienter med skalltrauma och medvetanderubbning bör tröskeln för att begränsa halsryggrörelser och undersöka halsryggen med DT vara låg [17].
Lateralt tungbett talar starkt för epileptiskt anfall [18, 19].
B. Andning
Hypoxemi leder till medvetanderubbning vid pO2 cirka 6 kPa [20], vilket grovt motsvarar SpO2 80 procent. Vid pO2 <4 kPa, vilket grovt motsvarar SpO2 60 procent, förekommer medvetandeförlust. Normalt SpO2 och pO2 utesluter inte kolmonoxidförgiftning [21].
Hyperkapni leder till medvetanderubbning vid pCO2 >10 kPa hos patienter utan kronisk hyperkapni, och 12 kPa hos patienter med kronisk hyperkapni [22].
C. Cirkulation
Medvetanderubbning förekommer när medelartärtrycket understiger ungefär 40 mm Hg, men tröskeln varierar mellan individer och är högre hos habituellt hypertensiva patienter [23].
Hypertensiv encefalopati förekommer oftast vid blodtryck >180/120 mm Hg [24].
D. Medvetandegrad och neurologiska bortfall
Agiterade patienter kan behöva lugnas för att kunna undersökas enligt ABCDE, i första hand verbalt och i andra hand farmakologiskt [25, 26].
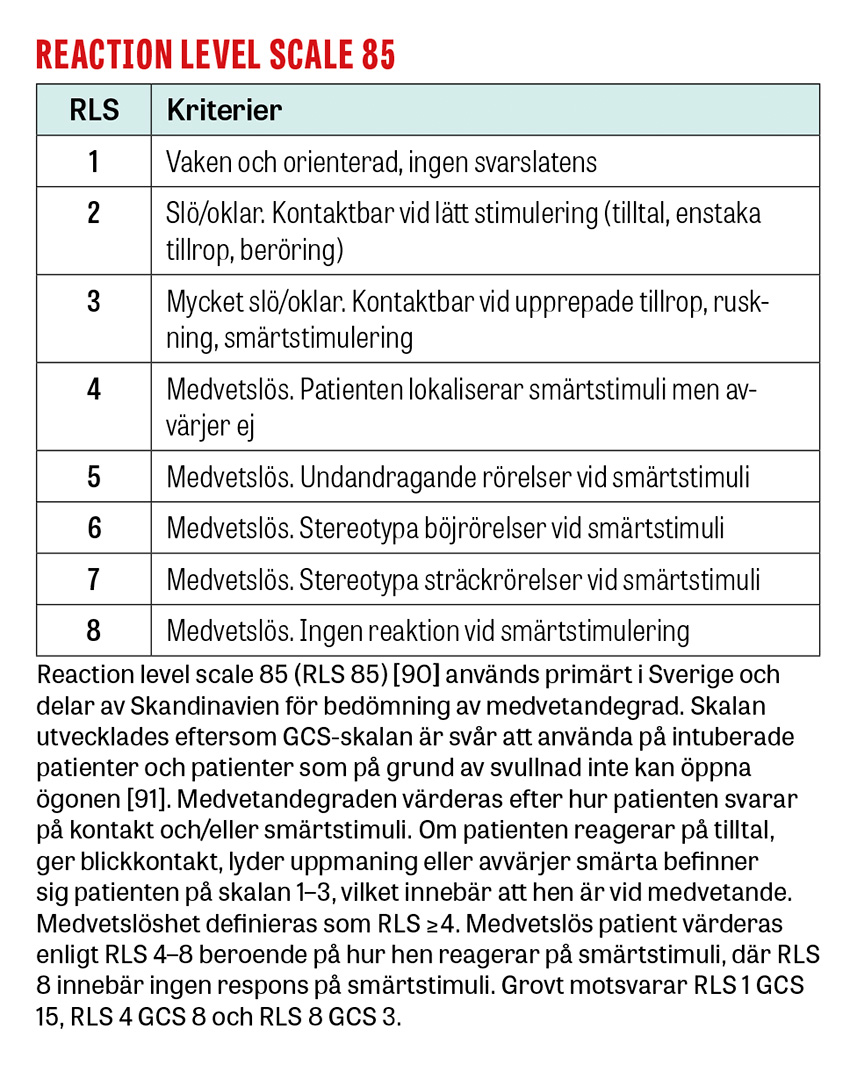
Om en medvetandesänkt patient inte rör extremiteterna eller öppnar ögonen på verbal uppmaning smärtstimulerar man patienten bakom käkvinkeln och vid en extremitet i taget. Pupiller och ögonrörelser undersöks vid behov genom att lyfta på ögonlocken. Aktivt motstånd mot ögonöppning talar för funktionell medvetanderubbning [27].
Bortfall som beror på skada i en specifik del av hjärnan – till exempel hemipares, dysfasi eller neglekt – benämns »fokala bortfall« [28]. I en studie av patienter med GCS (Glasgow coma scale)-värde <11 förekom fokala bortfall hos 80 procent av patienter med strukturell orsak (t ex intrakraniell blödning) och 25 procent med icke-strukturell orsak [12].
E. Exponering och temperatur
Inspektera kroppen för tecken på infektion eller trauma [29].
Vid temperatur >40,5 °C sviktar termoregleringen och det finns risk att medvetanderubbning med antingen konfusion eller sänkt vakenhetsgrad utvecklas [30]. Temperatur >40 °C är associerad med långvariga eller permanenta neurologiska skador [31].
Vid temperatur 32–35 °C finns risk för konfusion. Vid temperatur <32 °C förekommer vakenhetssänkning. Vid temperatur <28 °C förekommer koma [32].
Patientnära provtagning
Vid medvetanderubbning rekommenderas bred provtagning [29, 33, 34]. De flesta akutmottagningar kan inom minuter mäta värden som vägleder diagnostiken (pO2, pCO2, glukos, Na, Ca, anjongap). I en studie bidrog blodprov till diagnostiken i enbart 5 procent av fallen [1], medan en annan studie av patienter med akut medvetanderubbning utan klar genes rapporterade diagnostiskt värde i 25 procent av fallen [15].
Steg 3. Anamnes
Anamnes för den aktuella episoden inhämtas från anhöriga, ambulanspersonal och om möjligt patienten. Enligt en studie bidrog anamnesen för den aktuella händelsen till diagnostiken i 50 procent av fallen [1].
Steg 4. Diagnostisk »time out«
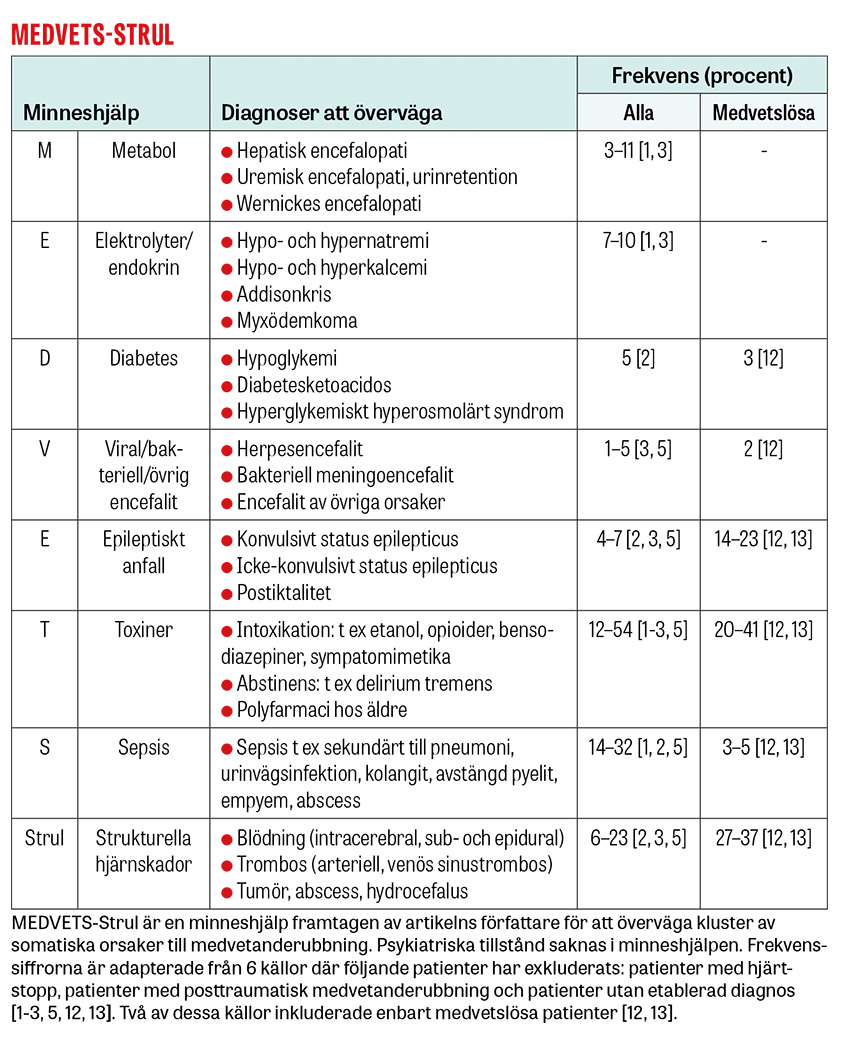
Minnesregeln MEDVETS-Strul används för att överväga somatiska orsaker till medvetanderubbning. Medvetandepåverkan kan vara multifaktoriell.
M. Metabol
Hepatisk encefalopati drabbar 20–40 procent av patienter med cirros under sjukdomsförloppet [35-37]. Konfusion eller vakenhetssänkning förekommer tillsammans med asterixis, ataxi och hyporeflexi vid lindriga former och tillsammans med hyperreflexi, klonus, nystagmus, Babinski, parkinsonism och fokala bortfall vid allvarliga former [38].
Ammoniumjon har låg sensitivitet (50–90 procent) och specificitet (75 procent) [39] för hepatisk encefalopati, varför diagnosen baseras på klinik samt uteslutning av andra orsaker till medvetanderubbningen [37, 40].
Uremisk encefalopati förekommer vid eGFR <15 ml/min/1,73 m2 och yttrar sig genom letargi, desorientering och hallucinationer. Koma och fokala bortfall förekommer sällan [41]. Symtom uppstår inom dagar följande svår, akut njurskada [42]. Tillståndet är en uteslutningsdiagnos som ställs retrospektivt vid kognitiv förbättring efter dialys.
Urinretention >1 liter hos män över 70 år kan orsaka medvetanderubbning som reverseras inom loppet av enstaka timmar efter blåskateterisering [43-49].
Wernickes encefalopati bör misstänkas vid medvetanderubbning hos patienter med näringsbrist (kronisk alkoholöverkonsumtion, anorexi, genomgången gastrisk bypass) [50]. Symtomtriaden konfusion, ögonmotorikstörningar (nystagmus, pares) och gångataxi saknas hos många. Caine-kriterierna (≥2 av näringsbrister, ögonrörelsestörningar, cerebellär dysfunktion och antingen medvetanderubbning eller lindrig minnesstörning) har högre sensitivitet [51]. Eftersom tiamin är biverkningsfritt är tröskeln för att behandla potentiell Wernickes encefalopati låg [50].
E. Elektrolyter, endokrin
Hyponatremisk encefalopati. Vid akut hyponatremi <115–120 mmol/l uppstår somnolens och krampanfall på grund av hjärnödem [52, 53]. Kronisk hyponatremi orsakar sällan medvetandepåverkan [53].
Hypernatremi. Akut hypernatremi >160 mmol/l ger svår kognitiv påverkan [53]. Medvetandepåverkan vid kronisk hypernatremi beror sannolikt på underliggande tillstånd, till exempel demens eller dehydrering, och inte på hypernatremin per se [53].
Hyperkalcemi. Symtomens svårighetsgrad beror inte på graden av hyperkalcemi utan på hastigheten med vilken den utvecklats [54]. Joniserat kalcium >1,75 mmol/l kan orsaka konfusion eller medvetslöshet; dock förekommer konfusion hos äldre personer vars joniserade kalcium snabbt stigit >1,55 mmol/l.
Myxödemkoma bör misstänkas hos patienter med känd eller okänd hypotyreos som erfar en utlösande händelse [55, 56]. Enligt en studie var de vanligaste utlösande händelserna levaxinutsättning (28 procent), sepsis (15 procent) och amiodaronrelaterad hypotyroidism (11 procent) [57]. Hälften av patienterna hade GCS ≤8 och hälften GCS 9–14. Hypotermi <35 °C (66 procent), bradypné (39 procent), ileus (17 procent), kramper (12 procent), hyponatremi (50 procent) och hypoglykemi (18 procent) kan förekomma [56, 57].
Addisonkris bör misstänkas hos patienter med långdragen kortikosteroidbehandling eller känd Addisons sjukdom som drabbats av infektion, trauma eller som minskat sin dos av kortikosteroid [58], samt hos patienter vars chock är alltför uttalad i förhållande till infektionen [59]. Addisonkris kan yttra sig som förvirring, letargi eller koma [59]. Hypotoni, feber, buksmärta/illamående, hyponatremi och hyperkalemi förekommer [60].
D. Diabetes
Hypoglykemi. Hos vuxna utan diabetes mellitus förekommer medvetanderubbning vid plasmaglukos <3 mmol/l [61]. Hos vuxna med diabetes påverkas tröskeln där neuroglykopena symtom uppstår av patientens vanliga plasmaglukosnivå [62].
Hyperglykemiskt hyperosmolärt syndrom kännetecknas av effektiv plasmaosmolaritet >320 mmol/l, medan diabetesketoacidos kännetecknas av förhöjt anjongap och ketoner i blod och urin [63]. Serumglukos mäter oftast >30 mmol/l vid hyperglykemiskt hyperosmolärt syndrom och >15 mmol/l vid diabetesketoacidos, men kan vara lägre vid svält eller bruk av SGLT2-hämmare. Medvetanderubbning förekommer oftare vid hyperglykemiskt hyperosmolärt syndrom än vid diabetesketoacidos.
V. Viral/bakteriell/övrig encefalit
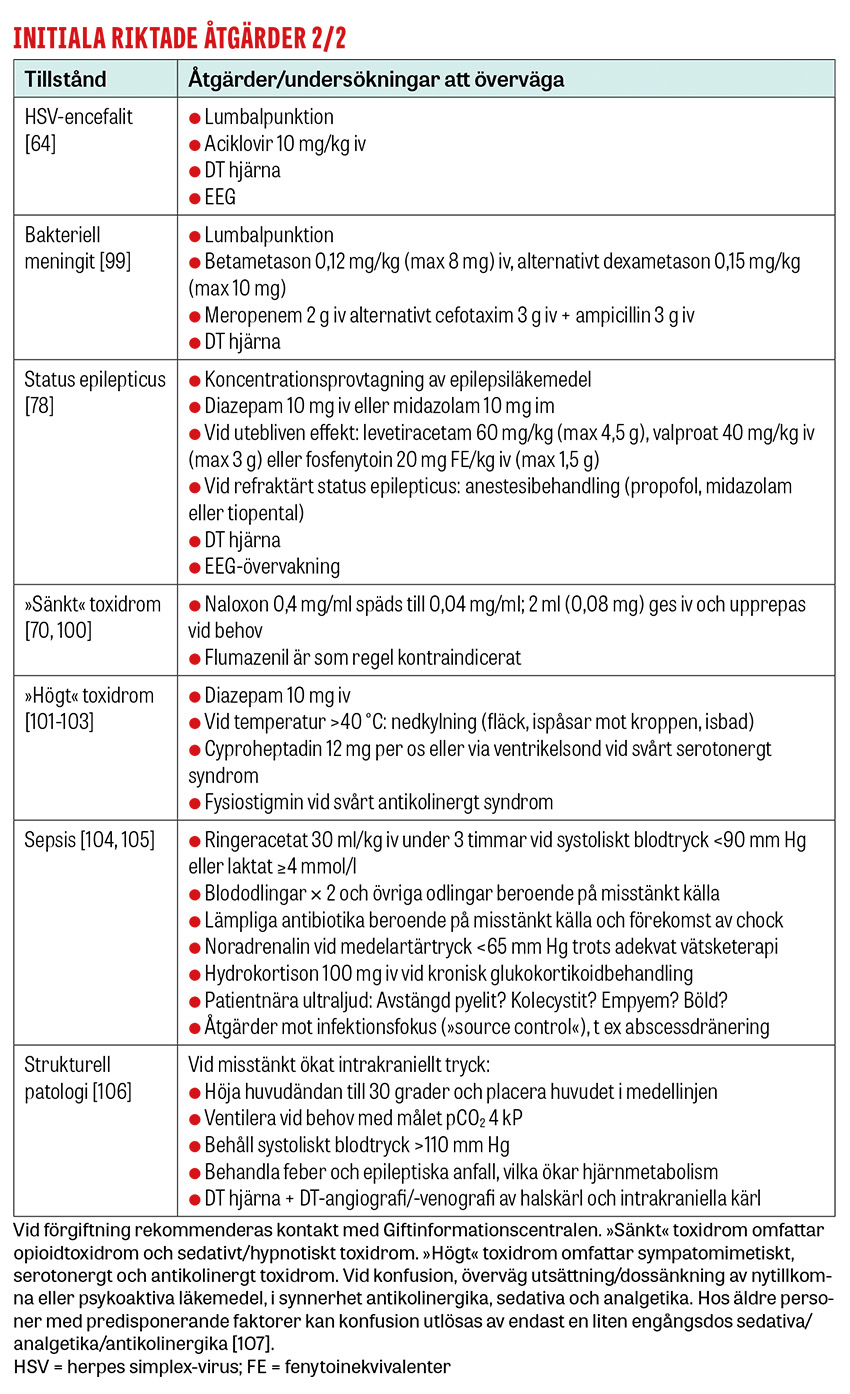
Encefalit bör misstänkas hos patienter med akut eller subakut debut av medvetanderubbning, somnolens och personlighetsförändring. Feber inom 72 timmar från symtomdebut, fokalneurologi och krampanfall stödjer diagnosen [64].
Bakteriell meningit bör misstänkas vid debut på timmar till 1–2 dagar av feber (88 procent), huvudvärk (58 procent), nackstyvhet (47 procent) och medvetanderubbning [65]. Hos 696 patienter med samhällsförvärvad bakteriell meningit hade 95 procent av patienter ≥ 2 av dessa symtom [66]. Krampanfall (9 procent) och extremitetspares (5 procent) förekommer [65].
E. Epileptiskt anfall
Vid icke-konvulsivt status epilepticus förekommer varierande grader av medvetandepåverkan och bortfall (t ex amnesi, dysfasi) [67, 68]. Motoriska fynd (t ex blickdeviation, ögon- och ansiktsryckningar eller upprepade blinkningar) kan saknas eller vara subtila. Todds pares, vilken oftast är ensidig, förekommer postiktalt vid cirka 13 procent av epileptiska anfall [69].
T. Toxiner
Opioidtoxidromet består av vakenhetssänkning, bradypné, nedsatta tidala volymer och oftast (men inte alltid) mios [70].
Delirium tremens bör misstänkas vid medvetanderubbning som uppstår 3–4 dagar efter avbrutet alkoholintag hos en patient med kronisk alkoholöverkonsumtion [71]. Det karakteriseras av förvirring, hallucinos och extrem autonom hyperaktivitet (svår takykardi, hypertoni, kraftiga svettningar, feber).
S. Sepsis
Sepsisassocierad encefalopati, diffus hjärnpåverkan sekundärt till systemisk inflammation, drabbar cirka 50 procent av patienter med sepsis [72]. Graden av medvetanderubbning sträcker sig från förvirring till koma. Sepsisassocierad encefalopati är associerad med långvarig kognitiv påverkan och ökad mortalitet [73].
Strul. Strukturella orsaker
Strukturella orsaker innefattar stroke, venös sinustrombos, subdural- och epiduralblödning, hjärntumör och hjärnabscess. Till skillnad från strukturella hjärnskador ger icke-strukturella orsaker ofta en fluktuerande medvetanderubbning [33, 74]. En studie av 875 patienter med icke-traumatiska koma (GCS <11) vid två av Stockholmssjukhusens akutmottagningar [12] visade att patienter ≤50 år med systoliskt blodtryck under 150 mm Hg och inga fokala neurologiska bortfall hade 96 procents sannolikhet för icke-strukturell orsak till vakenhetssänkningen (t ex förgiftning, epileptiskt anfall eller elektrolytrubbning).
Författarna drog slutsatsen att man vid handläggning av dessa patienter bör avvakta eller avstå från DT hjärna.
Steg 5. Vidare handläggning
Riktade utredningar och behandlingar genomförs för de tillstånd som bedöms kunna föreligga. Endotrakeal intubation övervägs hos djupt medvetandesänkta patienter för att säkra luftvägen och skydda mot aspiration. Den traditionella intubationsgränsen är GCS ≤8, men intubation kan avstås vid snabbt reversibla tillstånd eller vara indicerad vid GCS >8, till exempel vid tillstånd med förväntad försämring i medvetandegrad [34]. Förutom patientnära prov tas prov på leukocyter och trombocyter, koagulationsstatus, CRP, leverenzymer [34] och totalt CK/myoglobin om rabdomyolys kan föreligga. Urintoxikologiskt prov ger ofta falskt positiva och negativa svar som vilseleder den diagnostiska processen och rekommenderas därför inte [75-77]. Urinretention upptäcks med ultraljud. Vid misstänkt strukturell orsak beställs DT hjärna. Vid misstänkt dissektion, basilarisocklusion eller venös sinustrombos beställs även DT-angiografi/-venografi av halskärl och intrakraniella kärl. Vid misstänkt status epilepticus beställs akut-EEG för att utesluta fortsatt subklinisk anfallsaktivitet [78].
Eric Dryver har bidragit till artikeln med bland annat minneshjälpen MEDVETS-Strul.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Rättad 2024-06-13 avseende stycket V. Viral/bakteriell/övrig encefalit samt referenserna 64 och 65.
Anamnes. Patienter med medvetanderubbning kan inte själva ge en utförlig anamnes. Nedan listas nyckelfrågor som kan ställas till anhöriga och/eller ambulanspersonal innan dessa lämnar akutmottagningen.
Före insjuknande
- Har patienten nyligen haft feber eller övriga infektionssymtom?
- Har patienten nyligen klagat på huvudvärk eller kräkts?
Vid insjuknande/upphittande
- När hittades patienten? Hur snabbt utvecklades medvetanderubbningen?
- Var hittades patienten? Fynd talande för intoxikation (t ex tomma tablettburkar, sprutor) eller trauma?
Efter upphittande
- Har patientens vakenhetsgrad ändrats under ambulansfärden?
 Fall 1
Fall 1
En 34-årig kvinna sökte till akuten på grund av huvudvärk. Hon var frisk sedan tidigare och tog varken läkemedel eller p-piller. Huvudvärken hade börjat en vecka före akutbesöket och plötsligt accentuerats. Patienten genomgick DT hjärna utan kontrast och lumbalpunktion för att utesluta subaraknoidalblödning. Bägge undersökningarna utföll normala. Patienten lades in på sjukhuset, blev smärtfri och skrevs hem 2 dagar senare.
Efter hemkomst blev patienten förvirrad, och hennes man körde henne tillbaka till sjukhuset följande dag. Hon kunde inte uppge vad hon hade gjort under dagen. Hon trodde att det var morgon när det var kväll och hade svårt att följa uppmaningar. Hon var inte nackstel. Nervstatus visade dilaterade pupiller med trög reaktion för ljus, i övrigt inget patologiskt. Vitalparametrar och patientnära prov var normala.
 En ny DT hjärna utan kontrast visade tillkomst av en högattenuerande förändring motsvarande vena magna cerebri och vidgning av sidoventriklarna. DT-angiografi av hjärnans kärl i venös fas visade hållpunkter för trombotisering i vena magna cerebri och hela sinus rectus (A: venös sinustrombos). Patienten behandlades med tinzaparin och sedan warfarin i sammanlagt 6 månader. DT-angiografi 4 månader senare visade en nästan total revaskularisering av venerna (B: venös sinustrombos-förlopp). Koagulationsutredning avslöjade inget patologiskt.
En ny DT hjärna utan kontrast visade tillkomst av en högattenuerande förändring motsvarande vena magna cerebri och vidgning av sidoventriklarna. DT-angiografi av hjärnans kärl i venös fas visade hållpunkter för trombotisering i vena magna cerebri och hela sinus rectus (A: venös sinustrombos). Patienten behandlades med tinzaparin och sedan warfarin i sammanlagt 6 månader. DT-angiografi 4 månader senare visade en nästan total revaskularisering av venerna (B: venös sinustrombos-förlopp). Koagulationsutredning avslöjade inget patologiskt.
Fall 2
En 45-årig kvinna hittades liggande på golvet hemma av sin mor. På akuten var patienten apatisk och svarade sparsamt och med svarslatens på frågor. Hon var orienterad till plats men inte till tid och kunde inte redovisa vad hon tidigare gjort under veckan. Hon förnekade huvudvärk. Vid undersökning enligt ABCDE upptäcktes horisontell nystagmus och ostadighet vid gång. Vitalparametrarna och patientnära blodprov var normala.
Patienten hade opererats med gastrisk bypass 8 år tidigare och stod på vitamin B12-behandling. Hon hade dock inte hämtat ut sitt recept på 8 månader. Hon bodde ensam och hade blivit alltmer socialt isolerad. Det fanns inget tidigare känt alkohol- eller tablettmissbruk.
Wernickes encefalopati misstänktes och behandling med tiamin inleddes. Plasmaetanol kunde inte påvisas. PEth (fosfatidyletanol)-nivån var förenlig med låg till måttlig alkoholkonsumtion. Under inläggning på sjukhuset genomfördes DT hjärna, DT-angiografi av huvud- och halskärl samt MRT hjärna. Samtliga undersökningar var utan anmärkning. EEG visade fynd förenliga med lindrig encefalopati. Patientens kognition och balans förbättrades under inläggning och slutdiagnosen blev Wernickes encefalopati till följd av malnutrition och misstänkt intermittent etylöverkonsumtion.
(uppdaterad 2024-06-13)





![Ögonfynd vid medvetanderubbning. Fynd vid ögonundersökning kan ge ledtrådar om diagnosen. Miotiska pupiller (8 mm) talar för intoxikation med sympatomimetika eller antikolinergika. Stor ljusstel pupill talar för kompression av n oculomotorius, vilken kan förekomma vid inklämning [82] eller kompression från ett aneurysm [83]. Förekomst av konjugerad blickdeviation talar för antingen ipsilateral skada i storhjärnan, kontralateralt epileptiskt anfall eller kontralateral ponspatologi [84, 85]. Ögonrörelser som vandrar från sida till sida (»roving eye movements«) talar för kortikal dysfunktion (oftast metabolt eller toxiskt orsakad) utan hjärnstamspatologi [86, 87]. Nystagmus i samband med vakenhetssänkning talar för strukturell patologi; dock kan överdos med epilepsiläkemedel utlösa horisontell nystagmus [34].](https://lakartidningen.se/wp-content/uploads/2024/03/Ogonfynd_webb.jpg)