De flesta är ense om att
- aortagraftinfektioner är en sällsynt komplikation som kan uppkomma långt efter genomgången aortakirurgi och som har hög morbiditet och mortalitet
- det är viktigt för läkarkåren i allmänhet att ha med aortagraftinfektion som differentialdiagnos vid oklara infektionssymtom, nytillkommen gastrointestinal blödning eller hemoptys hos patienter med tidigare genomgången aortakirurgi
- hörnpelarna i behandlingen är kirurgisk makroskopisk debridering, så kallad »source control«, samt långvarig riktad antimikrobiell behandling
- denna patientkohort bör handläggas multidisciplinärt på högspecialiserade centrum på grund av komplexiteten i såväl utredning som behandling och uppföljning.
Åsikterna går isär vad gäller
- vilken typ av radikal kirurgisk rekonstruktion som ger bästa utfall
- vilka patienter som kan behandlas med en graftbevarande eller konservativ strategi
- optimal längd på den antimikrobiella behandlingen.
Aortagraftinfektioner är ett samlingsbegrepp för kärlprotesinfektioner i aorta, oavsett kirurgisk metod (endovaskulär eller öppen) och anatomisk lokal (torax eller buk). Livstidsincidensen av aortagraftinfektion efter genomgången aortakirurgi brukar anges till 0,3–3 procent och är generellt jämförbar efter öppen och endovaskulär kirurgi [1, 2]. I Sverige uppskattas cirka 10–15 patienter årligen behandlas kirurgiskt för en graftinfektion i bukaorta, men mörkertalet inklusive den kohort som enbart behandlas konservativt är desto större [3]. Det är viktigt att skilja mellan begreppen aortagraftinfektion och mykotiskt (primärinfekterat) aortaaneurysm då de skiljer sig avseende såväl mikrobiologi som prognos och behandling.
Fallbeskrivning
En 77-årig man med diabetes mellitus typ 2 och hypertoni sökte för nedsatt allmäntillstånd och intermittent feber de senaste 2 månaderna. Patienten hade för cirka 13 år sedan genomgått endovaskulär aneurysmreparation (EVAR) på grund av ett infrarenalt bukaortaaneurysm.
Under aktuellt vårdtillfälle visade utredningen en viktnedgång på drygt 5 kg de senaste 2 månaderna, återkommande feberepisoder >38,5 °C, anemi med Hb 99 g/l, marginellt stegrat CRP kring 40 mg/l och upprepat positivt feces-Hb. Patienten hade inga makroskopiska gastrointestinala blödningssymtom.
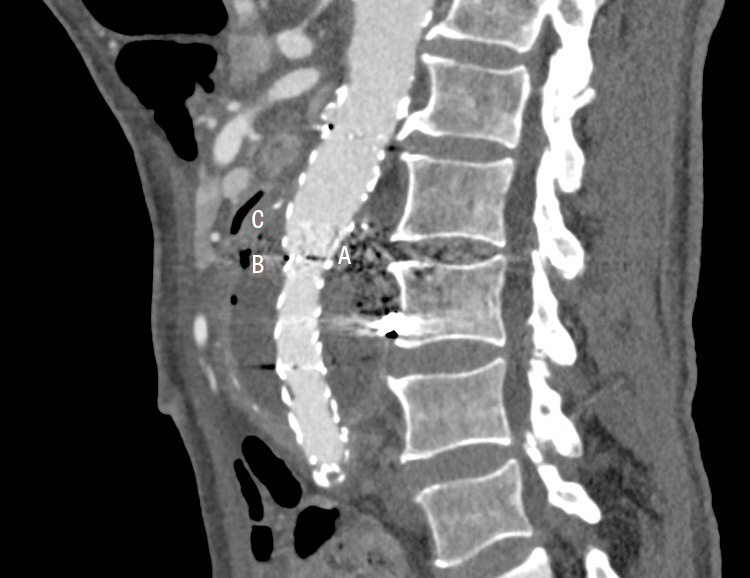
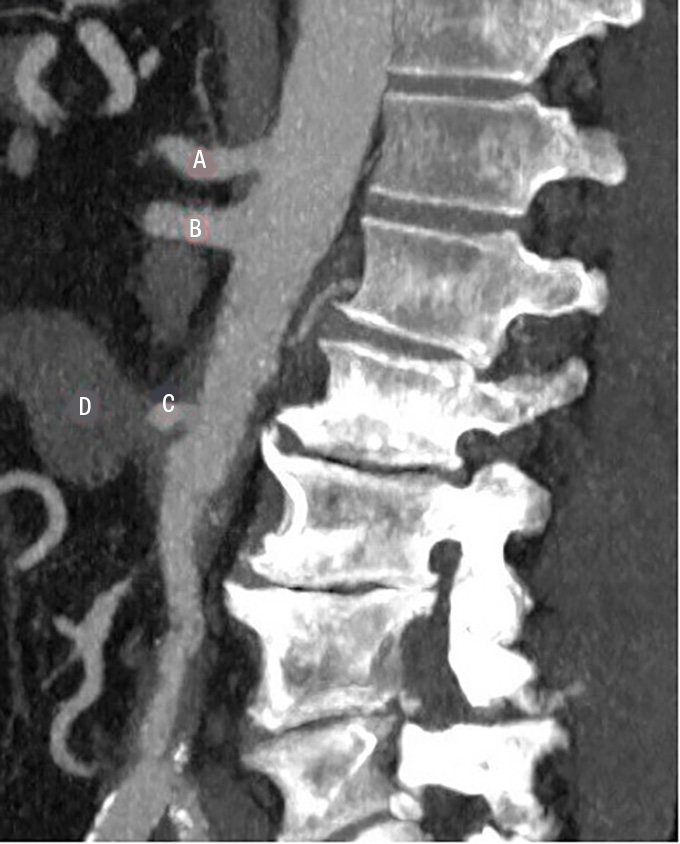
Datortomografi (DT) av buk och torax visade nytillkommen gas i aneurysmsäcken utanför EVAR-stentgraftet med periaortal retning. Pars horizontalis duodeni löpte dikt an mot aneurysmsäcken med en gasbubbla i tarmväggen. Den sammanlagda symtombilden ingav en stark misstanke om sekundär aortoduodenal fistel och stentgraftinfektion. Svar på aktuella blododlingar visade växt av alfastreptokocker och E coli. Man initierade bred antimikrobiell behandling med piperacillin–tazobaktam, vankomycin och kaspofungin.
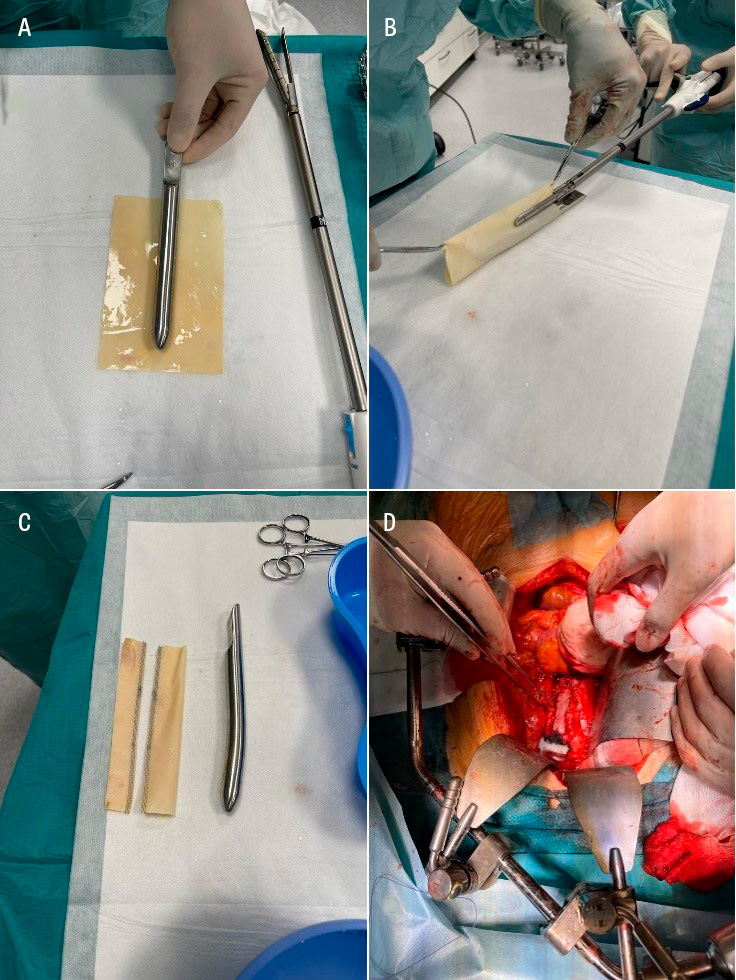
Efter en multidisciplinär rond fattades beslut om radikal resektion av det infekterade stentgraftet och in situ-rekonstruktion av aorta med biologiskt material i form av kalvperikard.
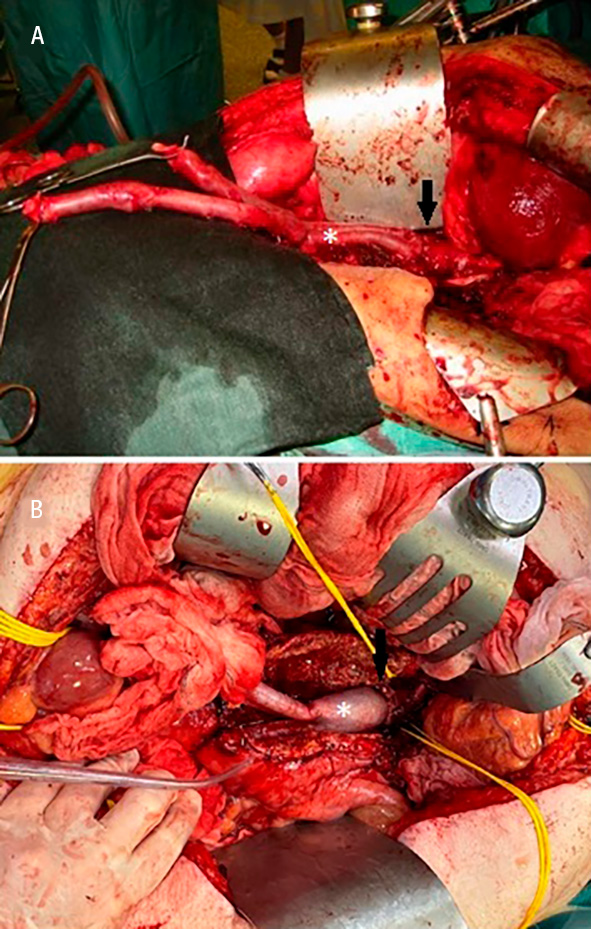
Det operativa förloppet var stormigt. Via en medellinjelaparotomi fripreparerades aorta med proximal kontroll suprarenalt samt distal kontroll av arteria iliaca communis bilateralt utan någon blödningsproblematik. Vid incision av aortasäcken vällde rikliga mängder pus fram och patienten utvecklade omgående svår cirkulatorisk chock med ett medelartärtryck kring 40 mm Hg under längre perioder trots omfattande vasopressorbehandling. Cirkulationen normaliserades så småningom, och man lyckade fortsätta med operationen. Det gamla stentgraftet exstirperades, en lever– och pankreaskirurg fripreparerade duodenum och duodenaldefekten kunde sys över. En 15 × 10 cm kalvperikardplatta klipptes till och konstruerades till ett rakt tubgraft som syddes in och ersatte det drabbade området av infrarenala aorta.
Det postoperativa förloppet utföll förvånansvärt väl. Redan dag 1 postoperativt var patienten extuberad och vaken på intensivvårdsavdelningen. De perioperativa odlingarna visade växt av Klebsiella oxytoca, E coli och Candida tropicalis. Patienten kunde skrivas ut till sitt eget boende efter totalt 21 dagars postoperativ sjukhusvård med fortsatt peroral behandling (klindamycin 300 mg × 3 och ciprofloxacin 500 mg × 2) och kaspofungin intravenöst i hemmet (50 mg × 1) i 3 månader samt uppföljning med flukonazol 400 mg 1 × 1 i ytterligare 3 månader.
Under den fortsatta täta uppföljningen normaliserades de inflammatoriska värdena, och efter 6 månader var patienten kliniskt och radiologiskt infektionsfri.
Epidemiologi och patofysiologi
Infektioner i aortaproteser kan uppstå tidigt eller många år efter primäroperationen. Cirka 30 procent av aortagraftinfektioner uppkommer inom 3 månader från det primära aortaingreppet och över 20 procent efter 5 år [3, 4]. Fallen med sena infektioner är ofta diagnostiska utmaningar, då tillståndet inte sällan hamnar långt ned på differentialdiagnoslistan.
Flera tänkbara patofysiologiska mekanismer bakom aortagraftinfektion har föreslagits [5, 6]:
- Vaskulärt disseminerade infektioner från andra organ
- Iatrogen inokulation i samband med endovaskulära ingrepp
- Periaortala infektioner med lokal translokation (till exempel spondylodiskit)
- Mekaniskt låggradigt trauma mellan aorta och närliggande vävnad som orsakar sekundär fistelbildning (vanligtvis mellan aorta och gastrointestinalkanal, uretär eller bronkträd).
Riskfaktorer för en aortagraftinfektion inkluderar öppen kirurgi med anastomoser i ljumskhöjd, postoperativ sårinfektion, ruptur vid det primära aortaingreppet, lokal kontamination (tarmskada), anamnes på genomgången infektion/sepsis efter det primära aortaingreppet och immunsuppression [4, 7, 8].
Sekundära fistlar förekommer i 30–40 procent av alla fall av graftinfektioner i bukaorta [3, 9, 10]. Uppskattningsvis en tredjedel av dessa utgör »äkta« fistlar mot blodförande lumen där risken för omfattande blödning är stor, medan resterande utgörs av »erosioner« mot aortaprotesen [11].
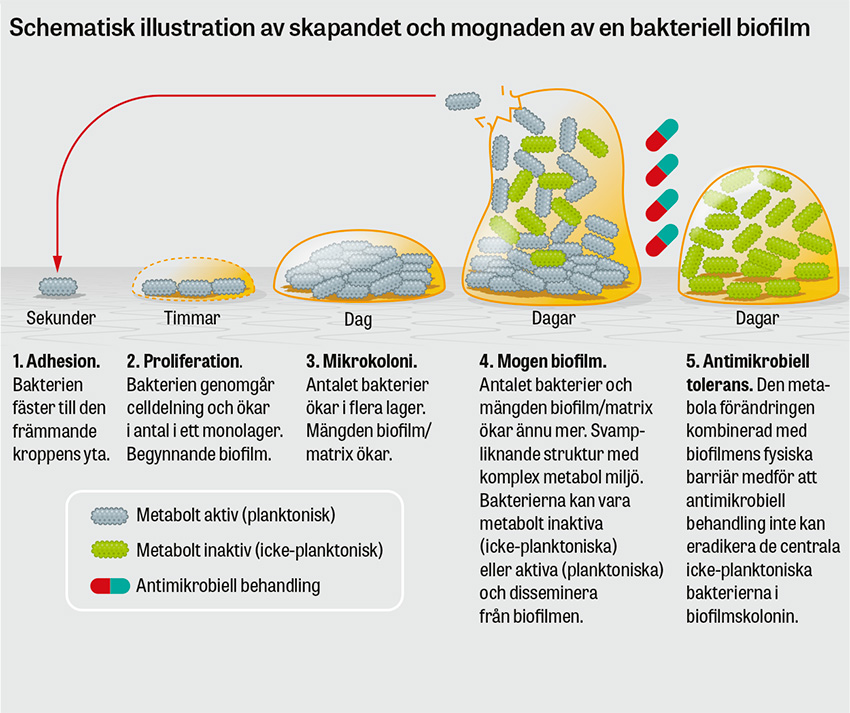
Som vid andra främmandekroppsinfektioner är en viktig komponent i patofysiologin vid aortagraftinfektion utvecklingen av biofilm [12]. Biofilmen består av ett patogenproducerat aggregat av glykoproteiner, där mikroorganismen fäster till aortaprotesens yta [12]. Detta genererar en biologisk barriär, men också en metabolt komplex miljö där patogenen kan växla mellan att vara metabolt aktiv (planktonisk) och inaktiv (icke-planktonisk). Kombinationen av fysisk barriär och nedväxling i metabolt krav gör att den minimala inhibitoriska koncentrationen (MIC) av antimikrobiell behandling ökar [13].
Symtom vid presentation
Diagnostiken av aortagraftinfektioner försvåras av att symtomspektrumet över lag är mycket heterogent och ospecifikt, delvis beroende på virulensen hos patogenen. Man kan generellt dela upp symtomen i systemiska och lokala.
Systemiska symtom uppstår på grund av den systeminflammatoriska responsen och inkluderar feber, trötthet, viktnedgång och sepsis med organdysfunktion. Lokala symtom uppstår på grund av vävnadsskada i nära anslutning till den infekterade kärlprotesen eller sekundärt till en disseminerad infektion till övrigt organ. Dessa symtom varierar med kärlprotesens anatomiska lokal, men inkluderar buk-, rygg-, eller bröstsmärta, djupa sårinfektioner som mediastinit eller ljumskinfektioner samt gastroinstestinal blödning eller hemoptys.
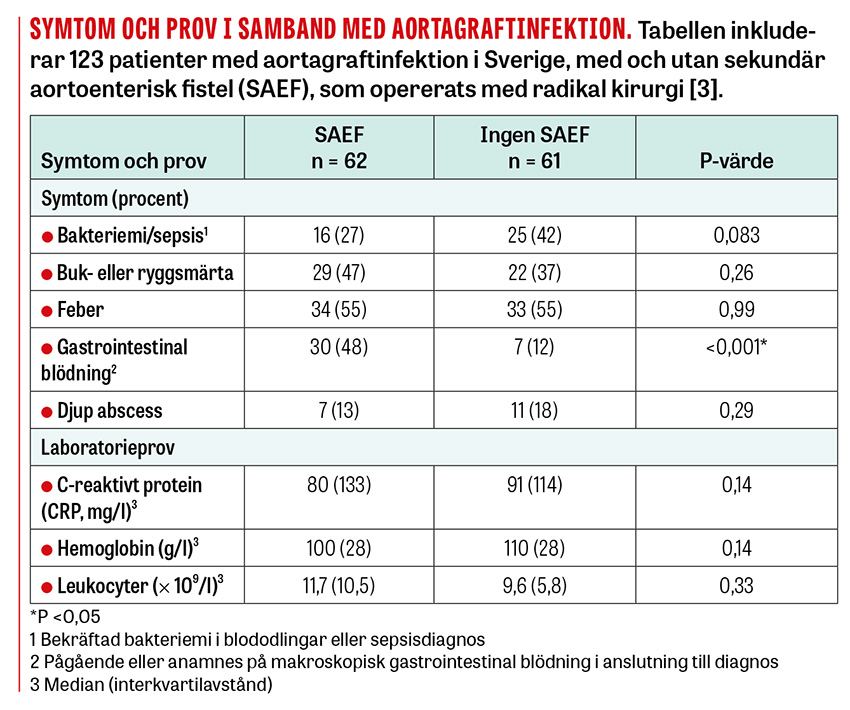
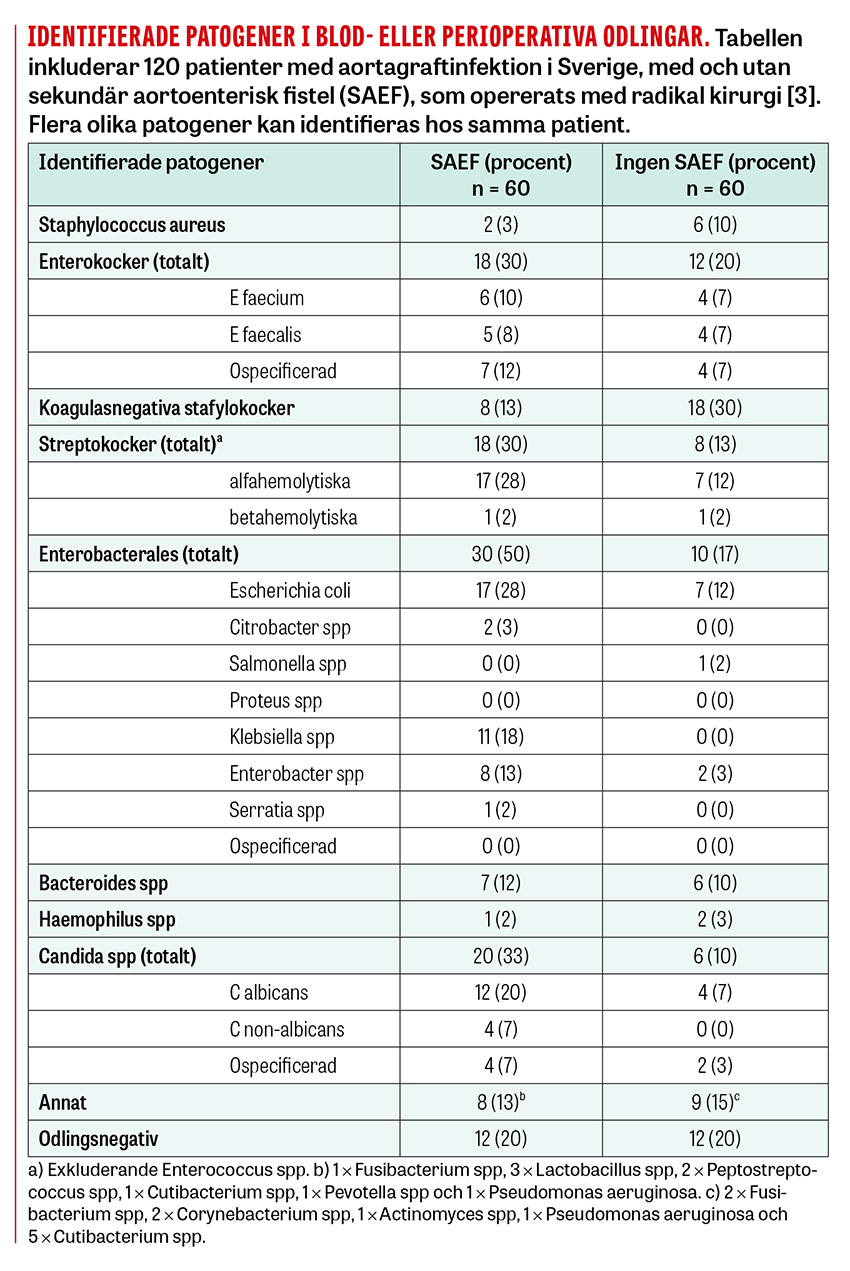
Gastroinstestinala blödningssymtom och hemoptys hos patienter som tidigare genomgått aortakirurgi är ett särskilt alarmerande symtom som inte ska förbises. Hos patienter med en fistel med förbindelse till kärllumen är det inte ovanligt att en mindre »varningsblödning« föregår en massiv livshotande blödning. Se Tabell för en sammanfattning av symtomen och symtomfrekvensen hos patienter med abdominella aortagraftinfektioner i en större svensk retrospektiv kohort [3].
Initial handläggning och diagnostik
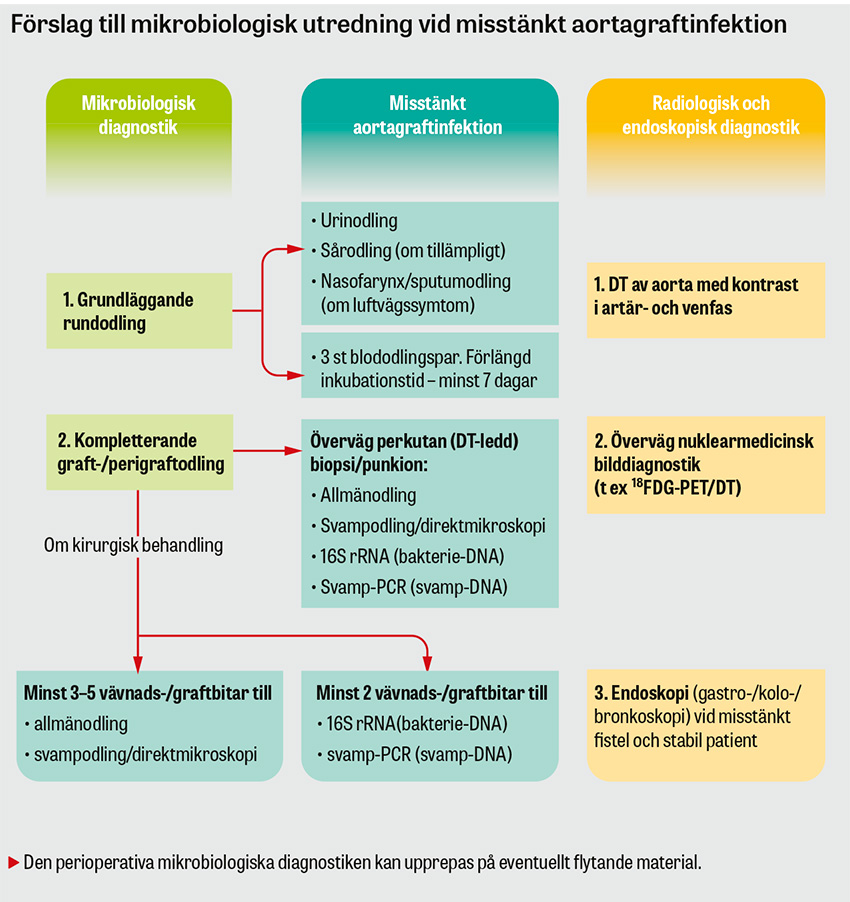
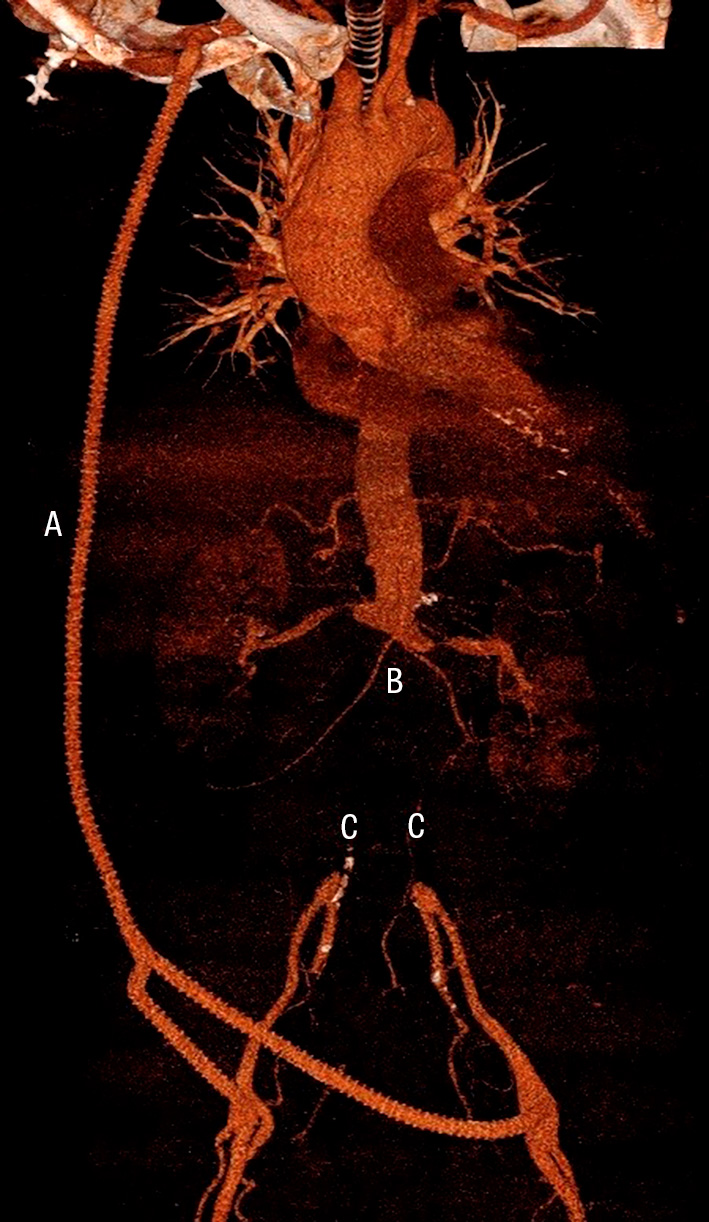
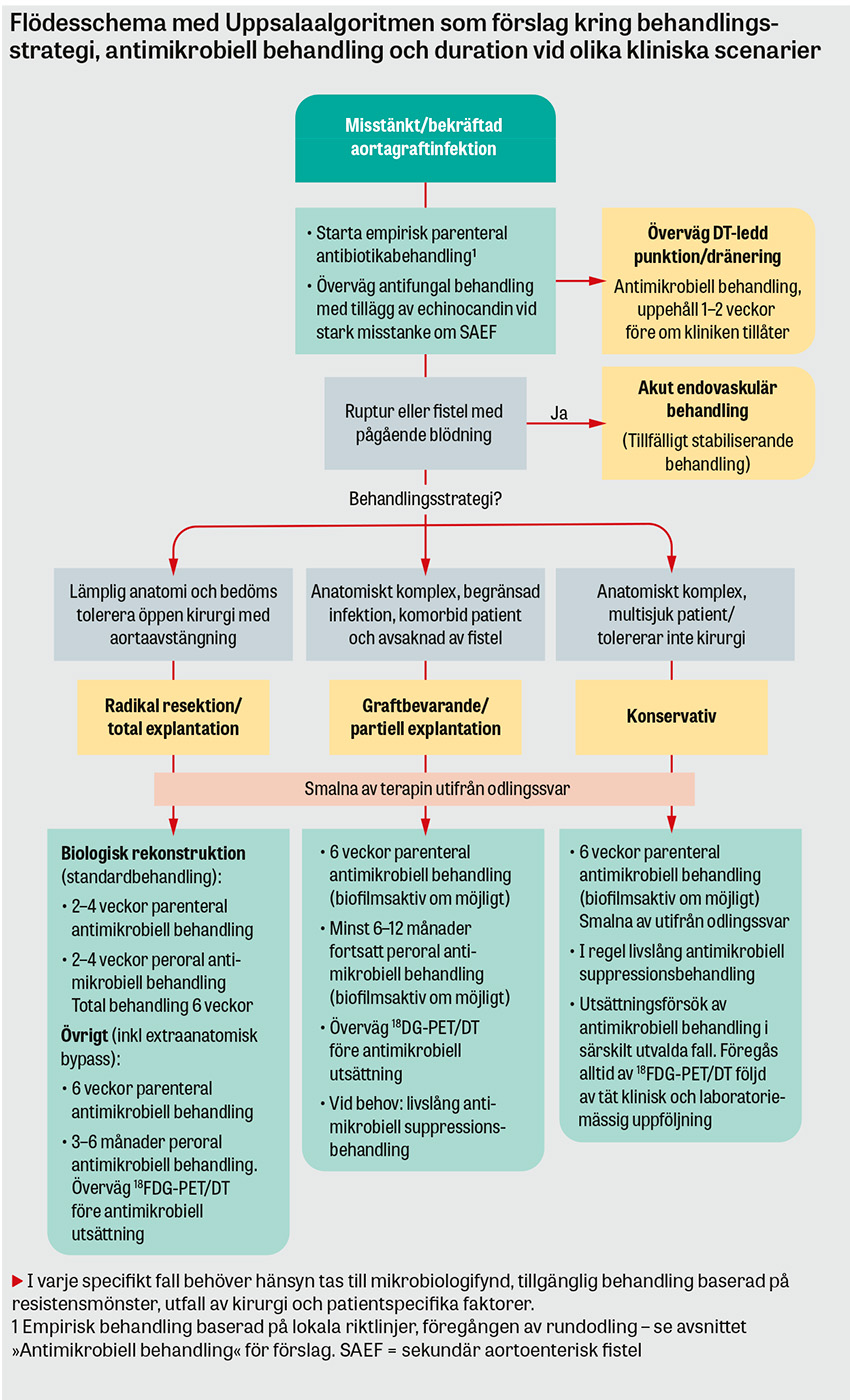
Diagnostiken av en aortagraftinfektion baseras på kirurgiska fynd, mikrobiologiska odlingsresultat och radiologiska tecken såsom nytillkommen periaortal gas på DT [14-17]. Då majoriteten av nydebuterade aortagraftinfektioner uppstår långt efter den primära aortakirurgin, och på grund av de ospecifika symtomen ovan, är det vanligt att patientgruppens första sjukvårdskontakt sker via akutmottagningar eller primärvården. Det är därför viktigt för gemene läkare att ha tillståndet i åtanke för patienter med anamnes på tidigare aortakirurgi och infektionssymtom utan tydligt fokus med långdraget förlopp, särskilt i kombination med smärta i buk/rygg/bröst eller nytillkommen gastrointestinal blödning alternativt hemoptys. Se Figur för ett praktiskt tillämpligt utredningsförslag vid misstänkt aortagraftinfektion. Rundodling, DT-angiografi av hela aorta och skyndsam kontakt med kärl- eller toraxkirurg är generellt en adekvat initial handläggning.
I oklara fall är funktionell bilddiagnostik som leukocytskintigrafi och/eller 18FDG-(fluor-18-deoxiglukos)-PET/DT av stort kliniskt värde; sensitiviteten för dessa undersökningar är hög (85–95 procent) [14]. Specificiteten är dock lägre (70–80 procent), särskilt tidigt (<6 månader) efter genomgången aortakirurgi, med risk för falskt positiva resultat om den kliniska sannolikheten inte är tillräckligt hög [14].
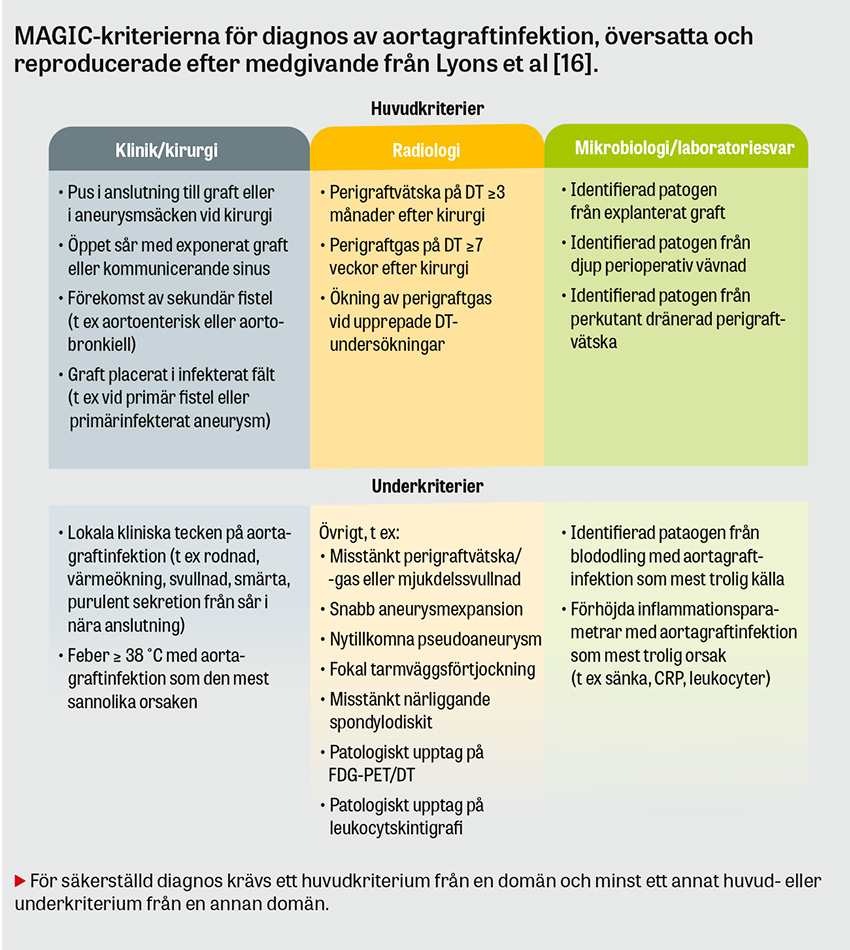
Historiskt har det funnits stor heterogenitet i den diagnostiska definitionen av aortagraftinfektion i litteraturen. Lyons et al introducerade MAGIC-kriterierna (Management of aortic graft infection collaboration), som numer används i allt större omfattning internationellt [16].
Diagnostiken av sekundära fistlar är svår. Växt av Candidaarter, polymikrobiell växt i blododlingar eller tillkomst av större mängder gas i aneurysmsäcken är fynd talande för fistel [16]. Alla patienter med anamnes på genomgången aortakirurgi och nytillkommen makroskopisk hemoptys eller gastrointestinal blödning bör skyndsamt undersökas med DT-angiografi. Nytillkomna pseudoaneurysm eller kontrastutlöpare mot närliggande bronk/tarm talar starkt för fistel.
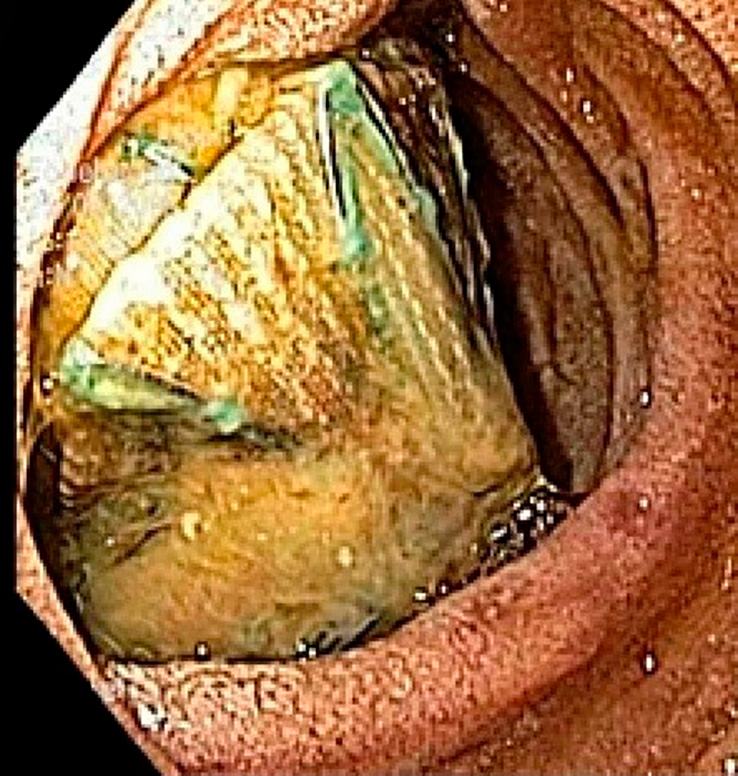
Endoskopisk utredning med bronko-, gastro- eller koloskopi är lämplig hos stabila patienter med misstänkt fistel. Erfarenhetsmässigt är det dock vanligt att man inte kan visualisera en slemhinnedefekt trots förekomst av fistel. Att endoskopiskt se en större slemhinnelesion med exponerad aortaprotes endoluminalt är ovanligt.
Mikrobiologi
Klarlagd mikrobiologisk etiologi vid aortagraftinfektion är viktig för att undvika onödigt bred långtidsbehandling, men också för att kunna implementera riktade biofilmsaktiva antimikrobiella strategier.
I drygt 70 procent av fallen kan man identifiera en patogen i blod- eller perioperativa odlingar [3, 9, 18, 19]. Denna siffra ökar sannolikt vid mer extensiv perioperativ provtagning, längre inkubationstid på odlingarna, eventuell sonikering av preparaten (högfrekvent ultraljud för att dislokera patogener från eventuell biofilm) i samband med inkubationen samt komplettering med PCR-baserad mikrobiologisk diagnostik [20, 21].
I historiskt material har grampositiva kocker, framför allt Staphylococcus aureus, utgjort 30–50 procent av de identifierade primärpatogenerna. I mer nutida material med fler endovaskulära stentgraftinfektioner är den mikrobiologiska heterogeniteten generellt större, och gramnegativa infektioner med exempelvis Enterobacterales är i princip lika vanliga [3, 9, 18]. Tabellen intill illustrerar frekvensen av olika identifierade patogener i blod- eller perioperativa odlingar i en svensk kohort med radikalt opererad abdominell aortagraftinfektion [3].
Hos patienter med sekundär aortoenterisk fistel är gramnegativa infektioner med tarmpatogener betydligt vanligare. Drygt 30–40 procent av dessa patienter har en påvisad polymikrobiell infektion med ≥2 identifierade patogener, och ungefär lika stor andel har en påvisad svampinfektion, vanligen orsakad av Candida [3, 9, 18].
Behandling
Valet av optimal behandlingsstrategi påverkas av ett komplext samspel mellan patientens grundtillstånd, mikrobiologiska fynd, infektionens anatomiska lokal och förekomst av lokala komplikationer. Därför bör alla patienter handläggas på centrum med extensiv erfarenhet av att behandla aortagraftinfektion, såväl kirurgiskt som mikrobiologiskt och med tillgång till multidisciplinära team [14]. På Akademiska sjukhuset hålls veckovisa kärlinfektionsronder med erfarna kärlkirurger, radiologer och infektionsmedicinska specialister med riktad expertis inom främmandekroppsinfektioner.
Behandlingsmålen är patientberoende och kan sträcka sig från palliation till infektionssuppression eller total kirurgisk eradikering av infektionen.
Kirurgi
Etablerad standard för infektionseradikering inkluderar radikal kirurgisk resektion av den infekterade aortaprotesen och eventuella fistlar samt infekterad periaortal vävnad och återställande av den distala cirkulationen [14]. Det sistnämnda kan uppnås antingen genom att rekonstruera aorta på plats (in situ-rekonstruktion) med olika graftmaterial eller genom att skapa en extraanatomisk bypass där kärlrekonstruktionen inte löper genom det infekterade fältet [22].
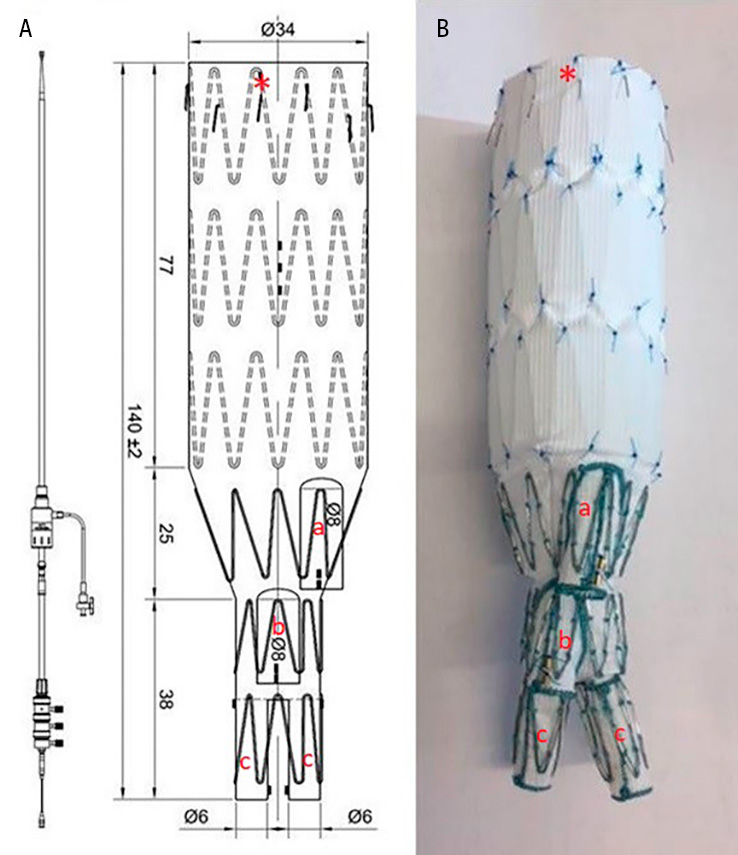
Generellt är in situ-metoderna med biologiskt graftmaterial att betrakta som mer infektionsresistenta och används i allt större utsträckning, medan användningen av extraanatomisk bypass har minskat över tid [3, 14]. De vanligaste biologiska in situ-graftmaterialen sammanfattas i figuren intill. Extraanatomisk bypass har dock kvar sin plats hos sköra patienter som inte tål en aortaavstängning samt i vissa anatomiskt komplexa fall vid hybridrekonstruktioner i kombination med grenade aortapluggar (BEVAP) – något som introducerades och applicerades första gången hos människa i Sverige vid Akademiska sjukhuset [23].
Endovaskulära behandlingsstrategier kan användas i akuta situationer för att täcka pseudoaneurysm eller fistlar i samband med en hotande eller pågående blödning. Detta anses oftast som en temporär åtgärd för att stabilisera patienten. I vissa fall kan den dock användas som slutgiltig palliativ behandling, och man får då acceptera och hantera en kronisk infektion i aortaprotesen.
Graftbevarande och konservativ behandling
Graftbevarande behandling inkluderar en begränsad kirurgisk eller interventionell behandling där delar av eller hela den infekterade aortaprotesen lämnas kvar [22]. Strategin kombinerar kirurgisk eller perkutan dränering av aortasäcken och övrig periaortal infektionsansamling för att få makroskopisk kontroll av infektionen. Detta kombineras om möjligt med antimikrobiell behandling med god effekt vid biofilm (se nedan). Strikt konservativ behandling inkluderar enbart det sistnämnda och är att betrakta som en palliativ behandling som traditionellt inneburit livslång antimikrobiell suppression.
Dessa behandlingsstrategier har historiskt applicerats på multisjuka patienter som inte klarar radikal kirurgi. Det finns dock en del data som tyder på att stentgraftinfektioner utan lokala komplikationer såsom fistlar kan behandlas graftbevarande/konservativt med tillfredsställande livslång suppressionsbehandling och i vissa fall även infektionseradikering med framgångsrik utsättning av antimikrobiell behandling utan infektionsrecidiv [19, 21].
Antimikrobiell behandling
Ett praktiskt exempel på initial empirisk behandling vid misstänkt aortagraftinfektion inkluderar piperacillin–tazobaktam 4 g × 4 (kan ersättas med karbapenem vid kolonisation med multiresistenta bakterier eller epidemiologi som motiverar detta) + vankomycin 25–30 mg/kg i laddningsdos följt av 1 g × 2–3. Vid misstänkt fistel mellan graft och tarm ges även antimykotisk behandling med exempelvis kaspofungin 70 mg × 1 (från dag två 50–70 mg × 1 beroende på vikt).
När odlingssvar har anlänt riktas behandlingen mot påvisat agens. Om möjligt väljs preparat med god effekt i biofilm, exempelvis daptomycin, rifampicin och/eller ciprofloxacin [24-26].
All antimikrobiell behandling bör diskuteras av ansvarig kirurg och infektionsläkare. För behandlingstidernas längd, se föreslagen Uppsalaalgoritm.
Profylax och råd till patienten
Kunskapen om primärprofylaktiska åtgärder för att minska risken för graftinfektion är begränsad. Perioperativ antibiotikabehandling i samband med kärlkirurgi har åtminstone visat sig minska risken för perifera kärlgraftinfektioner och postoperativa sårinfektioner; där det sistnämnda är en riskfaktor även för aortagraftinfektion [27].
Olika typer av biologiska och antibiotikaimpregnerade graft har visat infektionsresistens in vitro, men deras kliniska nytta är ännu inte bekräftad [29]. De rekommenderas inte i primärpreventivt syfte, men kan vara ett andrahandsalternativ om biologiska alternativ inte är tillgängliga eller lämpliga vid in situ-rekonstruktion i samband med radikal kirurgisk behandling av aortagraftinfektion.
Patienter med en aortaprotes bör informeras om att man numera rekommenderar antibiotikaprofylax i samband med mer extensiva odontologiska och orala ingrepp som skadar tandköttet/munslemhinnan. Detta inkluderar exempelvis tandextraktion och mer omfattande subgingival tandstenssanering [14, 28].
Det finns ännu inget stöd för någon bred rekommendation om särskild antibiotikastrategi för patienter med graft/stentgraft i aorta i samband med övriga infektionssjukdomar för att minska risken för aortagraftinfektion, men då bakteriemi/sepsis är en riskfaktor är det pragmatiskt och rimligt att anamma en mer liberal inställning till initierad antibiotikabehandling vid misstänkt bakteriell infektion, särskilt i det tidiga postoperativa förloppet [7].
För att inte försena en eventuell diagnos är patientinformation alltjämt viktig. Patienter med en aortaprotes bör informeras om vikten av att söka vård tidigt vid feber, nytillkommen buk-, rygg- eller bröstsmärta, episoder med sänkt allmäntillstånd och viktnedgång eller vid gastroinstestinala blödningar.
Utfall
Den rapporterade tidiga (30–90 dagar) postoperativa mortaliteten vid radikal kirurgisk behandling av aortagraftinfektion är 10–40 procent; där den stora spridningen sannolikt beror på patienturval samt frekvens av fistel och kliniskt status vid operation [30-33]. Femårsmortaliteten brukar anges till över 50 procent; där majoriteten av de sena dödsfallen dock inte är infektions- eller aortarelaterade [31].
Risken för reinfektion/persisterande infektion över tid hos patienterna som åtgärdats med radikal kirurgi är cirka 5–20 procent, och de biologiska rekonstruktionerna tenderar att ligga i det lägre intervallet [30, 31, 33]. Hos patienter som opererats graftbevarande/konservativt är risken för reinfektion/persisterande infektion upp mot 50 procent [9]. Erfarenhetsmässigt uppkommer eller diagnostiseras reinfektioner tidigt efter den primära interventionen, och oftast inom 1 år efter utsatt antimikrobiell behandling [34].
Läs även författarintervjun med Hamid Gavali.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.