De flesta är ense om att
- tidiga bröstkompressioner samt defibrillering är kritiskt för överlevnad
- simultant genomförande av utredningar och åtgärder krävs för att skyndsamt kunna identifiera och behandla reversibla orsaker till hjärtstopp
- god teamorganisation och kommunikation är av största vikt för att uppnå detta
- beredskap och kompetens för genomförande av perimortem-sectio bör finnas på varje akutmottagning.
Åsikterna går isär om värdet av
- användning av ultraljud under pågående HLR för att hitta reversibla orsaker och för prognostisering.
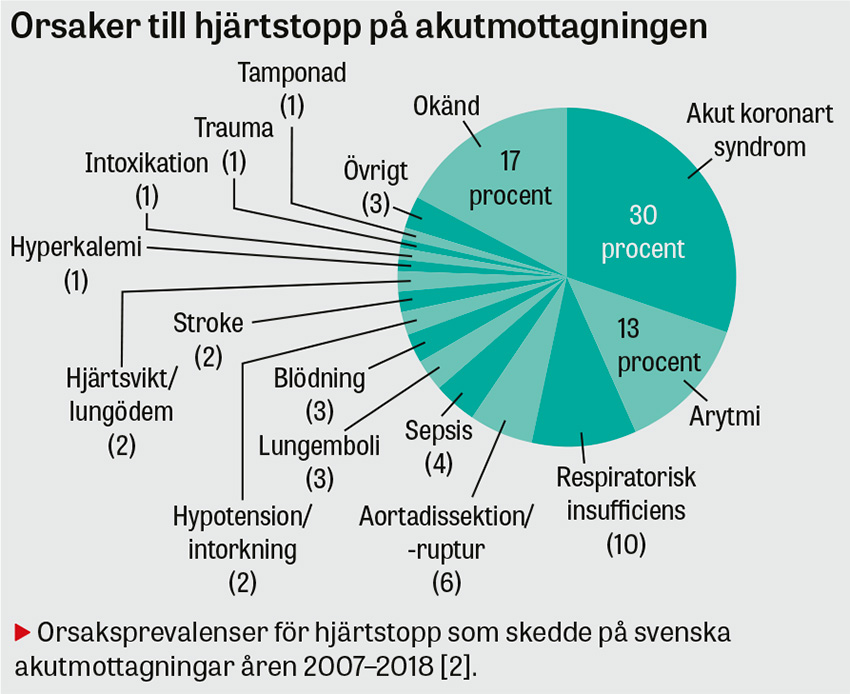
Hjärtstopp är ett tillstånd där uttalad cirkulationssvikt leder till medvetslöshet och frånvaro av effektiv egenandning. På svenska akutmottagningar omhändertas årligen cirka 1 100 patienter med prehospitalt hjärtstopp [1]; därtill inträffar 1,6 hjärtstopp per 10 000 akutbesök [2]. Hjärtstopp är det mest tidskritiska tillstånd vi möter i vården. Utan omedelbara åtgärder inträffar irreversibla hjärnskador. Fokus vid handläggningen blir att parallellt med avancerad hjärt–lungräddning (A-HLR) optimalt använda tillgängliga resurser för att identifiera potentiellt behandlingsbara orsaker och påbörja riktade behandlingar.
Denna artikel presenterar ett förhållningssätt till handläggningen av hjärtstopp på akuten baserat på de senaste internationella riktlinjerna. Råd om teamarbete baseras på expertutlåtanden.
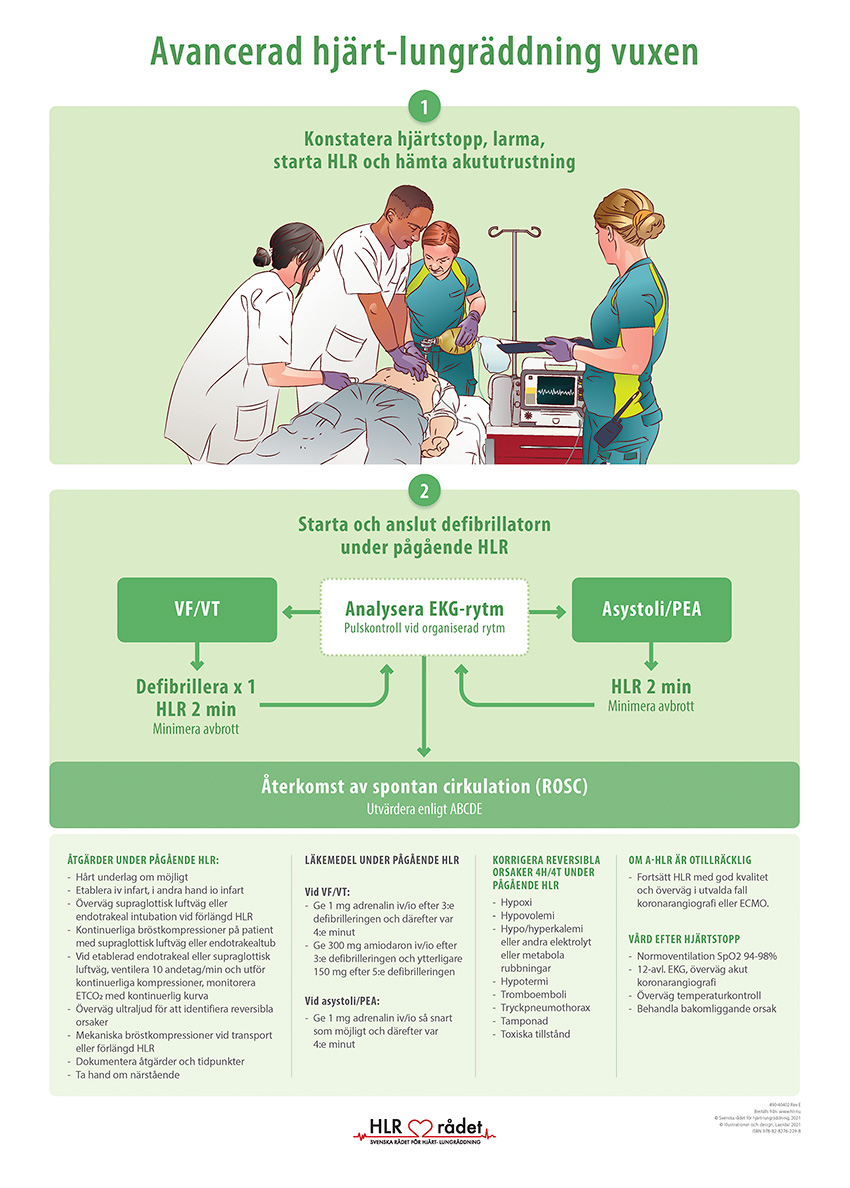
Steg 1. Standardiserad initial handläggning
Kliniskt är hjärtstopp ett syndrom som kännetecknas av medvetslöshet (ingen reaktion på röst eller skakning) samt ingen eller onormalt långsam andning [3]. Vid konstaterat hjärtstopp tillkallas vårdpersonal och bröstkompressioner inleds omedelbart. Vid hospitalt hjärtstopp ökar mortaliteten med 2 procent om fördröjning till kompressioner överstiger 2 minuter [4]. Kompressioner genomförs på nedre hälften av sternum med frekvens 100–120/minuter, djup 5–6 cm och fullt uppsläpp mellan kompressionerna [3]. För att säkerställa hög kvalitet rekommenderas att man byter ut den person som utför kompressioner vid varje rytmanalys [5]. Mekaniska kompressioner är likvärdiga med manuella kompressioner gällande överlevnad till utskrivning från sjukhuset med god neurologisk funktion [5-7], men förenade med högre incidens av revbensfrakturer samt hjärt-, lung- och leverskador [8].
Efter att man har startat kompressioner är nästa prioritet att identifiera och defibrillera ventrikelflimmer och pulslös ventrikeltakykardi. Mortaliteten stiger med 2 procent för varje minuts fördröjning till defibrillering under de första 8 minuterna [4]. För att inte orsaka uppehåll i kompressionerna rekommenderas anterolateral elektrodplacering som förstahandsval [5]. Snarast efter att defibrillatorn är startad och elektroderna är påklistrade avbryts kompressionerna under så kort tid som möjligt (max 10 sekunder) för rytmanalys.
Vid pulslös ventrikeltakykardi eller ventrikelflimmer återupptas kompressionerna medan defibrillatorn laddas enligt tillverkarens anvisningar (150–200 J; 4 J/kg hos barn). Kompressioner återupptas direkt efter en defibrillering utan rytmanalys. Rytmanalys görs därefter varannan minut. Defibrillatorn kan förladdas när det är 10 sekunder kvar till analys för att snabbt kunna defibrillera eventuell ventrikelflimmer och pulslös ventrikeltakykardi [5, 9]. Defibrillering genomförs efter att man bekräftat att ingen personal har fysisk kontakt med patienten och kan genomföras under pågående mekaniska kompressioner [5].
Vid asystoli ges snarast adrenalin 1,0 mg (10 μg/kg till barn [10]) intravenöst eller intraosseöst, och rytmanalys görs därefter varannan minut. Vid potentiell pulsgenererande rytm palperas arteria femoralis och/eller arteria carotis under maximalt 10 sekunder. Ultraljudsundersökning av arteria carotis eller arteria femoralis har föreslagits som ett alternativ eller supplement till manuell palpation för att upptäcka återkomst av spontan cirkulation (return of spontaneous circulation, ROSC) [11, 12]. Det finns begränsad evidens som talar för att ultraljudsundersökning är snabbare [13, 14] och mer träffsäker [15] än manuell pulskontroll. Vid elektrisk hjärtaktivitet utan perifera pulsationer föreligger definitionsmässigt pulslös elektrisk aktivitet (PEA), och patienten handläggs som vid asystoli.
Ventilation genomförs initialt med mask och blåsa (två inblåsningar per 30 kompressioner hos vuxna) och 100 procent syre [5]. Endotrakeal intubation ska genomföras av personal med stor erfarenhet av tekniken och utan avbrott i bröstkompressioner som överstiger 5 sekunder [5]. Korrekt tubläge verifieras kapnografiskt [16]. Efter endotrakeal intubation ventileras patienten (10/minut för vuxna; 10–25/minut för barn) utan avbrott i bröstkompressioner [5, 10]. Larynxmask är ett godtagbart alternativ till endotrakealtub [5, 10] och kan användas om det inte går att ventilera samt om personalen inte är van att intubera.
Steg 2. Rollfördelning
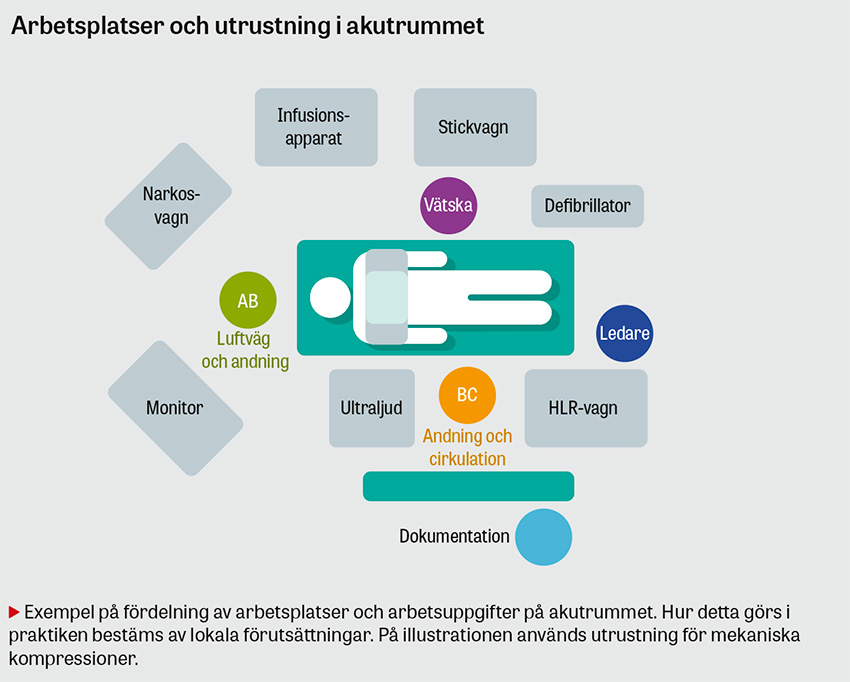
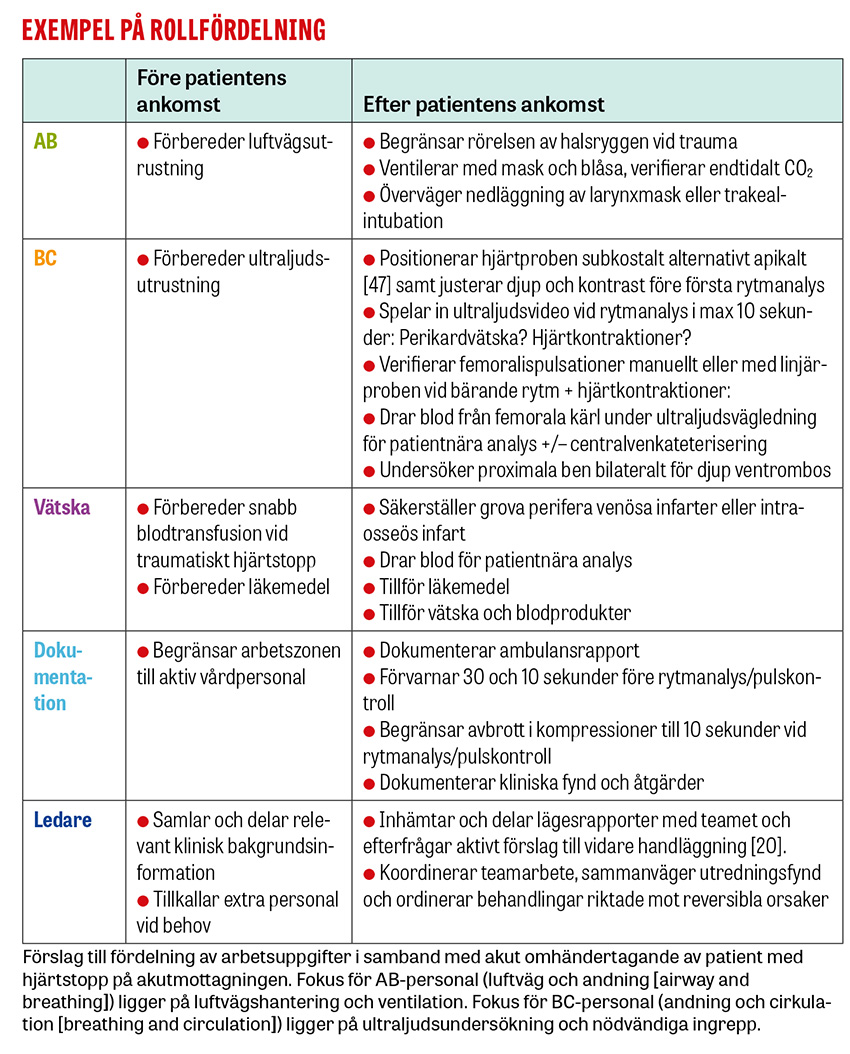
Teamet och arbetsmiljön bör organiseras för att kunna utföra olika uppgifter simultant och därmed så snabbt som möjligt utesluta eller åtgärda reversibla orsaker. Rollfördelning och placering avgörs av antalet teammedlemmar och deras kompetens. Ett förslag till rollfördelning och positioner framkommer i bild och tabell härintill. Experter rekommenderar att den personal som dokumenterar uppgifter och åtgärder även påminner om rytmanalys och adrenalintillförsel [17-20]. Därmed kan ledaren, som ofta har högst färdighetskompetens, avlastas kognitivt och kan bättre bidra med undersökningar och åtgärder.
Värdet för anhöriga av att bevittna omhändertagandet varierar mellan individer [21, 22]. Anhöriga kan bidra med viktig information om omständigheterna kring hjärtstoppet [23]. Om anhöriga närvarar ska en anhörigmottagare avsättas ur personalen [22].
Steg 3. Möjliga reversibla åtgärder
I dagsläget finns få evidensbaserade metoder för att identifiera möjliga reversibla orsaker till hjärtstopp. Därför används en sammanvägning av anamnes om patientens bakgrund och omständigheterna för hjärtstoppet, kliniska fynd, blodgasanalys och ultraljudsundersökning.
Diagnostiskt värde av ultraljudsundersökning
Ultraljud kan identifiera vissa reversibla orsaker till hjärtstopp (myokardinfarkt, lungembolisering, perikardtamponad), men evidensen för det diagnostiska värdet av ultraljud vid hjärtstopp är väldigt svag [24]. Vid hjärtstopp dilateras höger kammare [25] och hjärtat får en kontraktilitetsnedsättning, en så kallad »stunning«, vilken gör att både kontraktilitet och storlek blir svåra att bedöma [5], medan hjärttamponad kan upptäckas. Djup ventrombos i benen kan stärka misstanken om lungembolisering som orsak till hjärtstopp [5].
European Resuscitation Council rekommenderar ultraljud vid traumatiskt hjärtstopp för att identifiera hjärttamponad eller blödning i torax eller buk [23], men det finns ingen tydlig rekommendation för eller emot användning av ultraljud vid icke-traumatiskt hjärtstopp. Ultraljud under pågående hjärtstopp får inte förlänga uppehåll i kompressioner [26, 27]. Därför rekommenderas kortvarig bildinspelning vid rytmanalys med bildtolkning först efter att kompressioner återupptagits.
Hypotermi
Vid hypotermi minskar kroppsaktiviteten så att patienten kan verka död, men i många fall finns chans till god prognos även om den initiala rytmen är asystoli. Kompressioner och ventilation görs enligt standardalgoritm [23]. Vid kärntemperatur <30 °C ges inga läkemedel, och vid ventrikelflimmer defibrilleras patienten upp till 3 gånger. Vid fortsatt ventrikelflimmer/pulslös ventrikeltakykardi avstås från ytterligare defibrilleringar tills temperaturen är >30 °C. Mellan 30 och 35 °C ges läkemedel med dubbelt tidsintervall. Vid temperatur >35 °C ges adrenalin och amiodaron med standardintervall [23]. Adrenalin och amiodaron ges i standarddos.
Vid hjärtstopp utlöst av hypotermi är förstahandsval för uppvärmning Ecmo (extrakorporeal membranoxygenering) och andrahandsval hjärt–lungmaskin [23, 28, 29]. Om ingen av dessa är tillgängliga kan natriumklorid 20 ml/kg uppvärmd till 42 °C infunderas i peritoneum och dräneras efter 20 minuter, varefter proceduren upprepas [29]. Även sköljning med varm natriumkloridlösning intratorakalt via pleuradrän (250 ml åt gången) kan övervägas [29]. Varm intravenös vätska och sköljning av ventrikel eller urinblåsa rekommenderas inte därför att detta kan orsaka elektrolytrubbningar eller aspiration och urinblåsan har för liten ytareal för att sköljning av den ska ge någon betydande uppvärmningseffekt [29]. Målet med uppvärmningen är ROSC. Aktiv uppvärmning kan avbrytas vid stabil ROSC [30].
Speciella sammanhang
Trauma
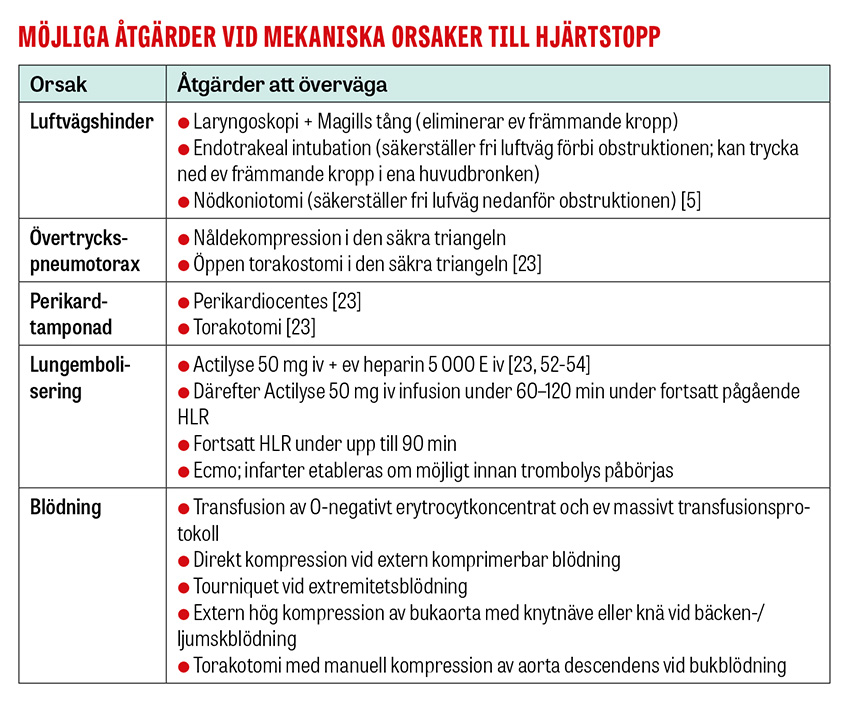
Hjärtstopp till följd av svårt trauma beror oftast på blödning, och ibland på övertryckspneumotorax, perikardtamponad eller hypoxi sekundärt till andningsproblematik [31].
Prioriteten är att simultant utesluta eller åtgärda dessa tillstånd [23] genom att
- säkerställa fri övre luftväg och adekvat ventilation
- genomföra bilaterala torakostomier
- stoppa katastrofal blödning med kompression/tourniquet
- överväga massiv blodtransfusion.
Extern manuell kompression av övre bukaorta rekommenderas vid livshotande nedre buk- eller bäckenblödning [32], till exempel i samband med förlossning [33], och kompression med knytnäve eller knä kan övervägas vid traumatiskt hjärtstopp [23, 34].
Nödtorakotomi är indicerad vid trauma mot bålen när tiden sedan förlust av livstecken understiger 15 minuter, men överlevnad har rapporterats även efter längre traumatiska hjärtstopp [23, 31]. Ingreppet genomförs för att åtgärda perikardtamponad genom att evakuera blod och koagler (perikardiocentes är andrahandsval) [23], stoppa subdiafragmal blödning genom att klämma av aorta descendens och stoppa större intratorakal blödning. Nödtorakotomi är kontraindicerad när det saknas kirurgisk kompetens/förutsättningar för vidare handläggning och när de traumatiska skadorna inte är förenliga med liv.
Graviditet över 20 veckor
De vanligaste orsakerna till hjärtstopp hos gravida i västvärlden är lungembolisering (29 procent), blödning (17 procent), sepsis (13 procent) och kardiomyopati (8 procent) [35]. Obstetrisk och neonatal kompetens tillkallas snarast. När livmodern sträcker sig kranialt till naveln komprimerar den vena cava inferior och hämmar venöst återflöde till hjärtat. Vid HLR ska därför livmodern dras manuellt åt vänster [23, 36, 37]. Mekaniska kompressioner rekommenderas inte [23].
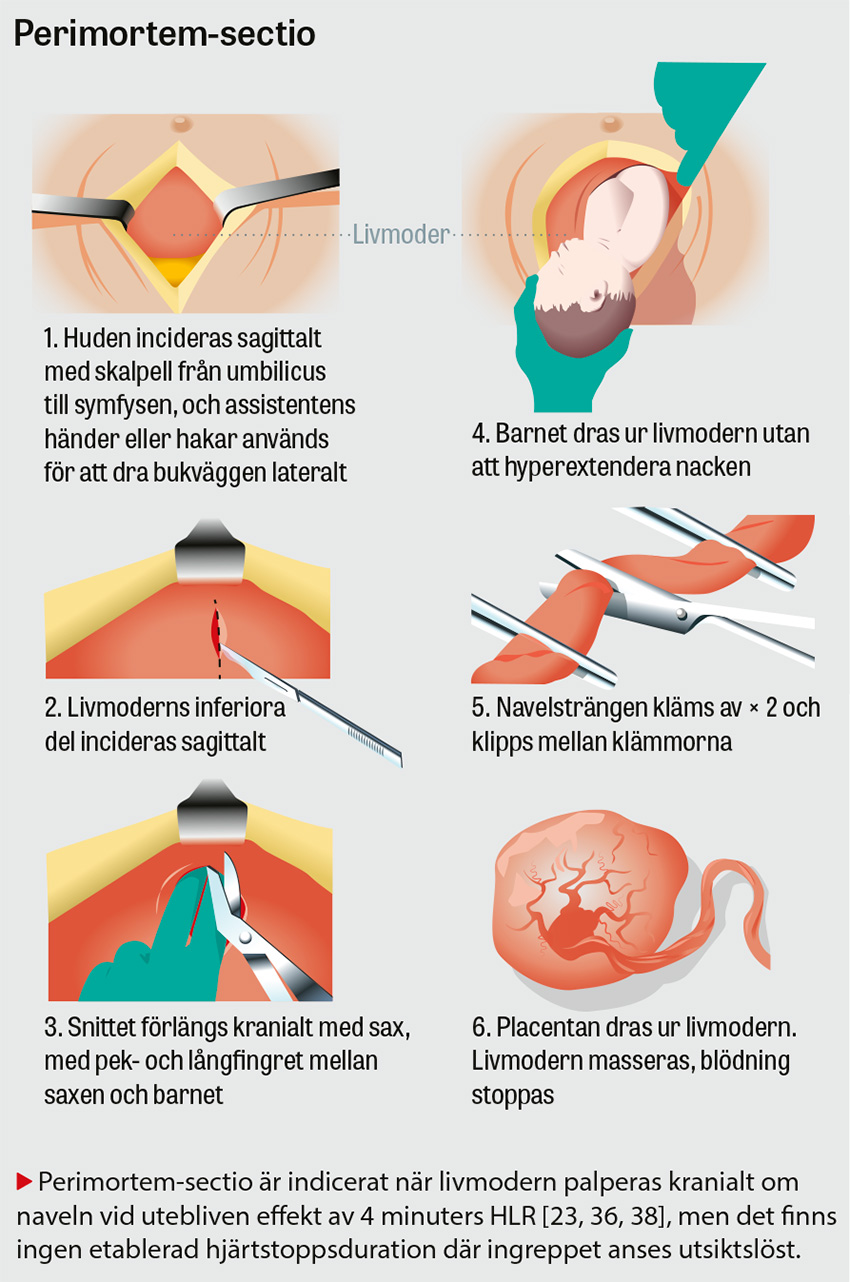
Beredskap och kompetens för genomförande av perimortem-sectio bör finnas på varje akutmottagning [36]. Eftersom perimortem-sectio ökar överlevnaden för både modern och barnet [36, 38], och bör genomföras inom 4 minuter efter bevittnat kvarstående hjärtstopp, bör i praktiken förberedelse för detta påbörjas omedelbart vid bevittnat hjärtstopp hos gravida >20 veckor och inledas omedelbart vid ankomst till akutmottagning hos gravida >20 veckor med prehospitalt hjärtstopp [23, 36, 37, 39]. Adrenalin, amiodaron och andra relevanta läkemedel doseras som till icke-gravida [23, 36].
Steg 4. Vidare handläggning
Framgångsrik återupplivning
Kan pulsationer palperas vid rytmanalys föreligger ROSC, och då avbryts A-HLR. Med fungerande artärkateter kan även förekomst av pulsatilt blodflöde användas för att identifiera ROSC, liksom ultraljud av kärl och ökning av endtidalt CO2, även om exakta kriterier för diagnostik ännu saknas. Många patienter förblir medvetslösa under flera dygn efter ett hjärtstopp. Vid ROSC titreras syretillförseln till målsaturation 94–98 procent [40], och ett medelartärtryck på 65 eftersträvas med infusion av kristalloid och/eller vasoaktiva läkemedel [41].
Akut koronarangiografi med beredskap för perkutan koronarintervention är indicerat vid misstänkt kranskärlsocklusion. Faktorer som talar för ischemiutlöst hjärtstopp är ventrikelflimmer/pulslös ventrikeltakykardi som initial rytm, regional hypokinesi på ultraljud och ST-höjningar på EKG efter ROSC [41, 42]. EKG direkt efter ROSC kan dock vara svårvärderad: i en studie bedömdes att 18 procent av patienter med ST-höjningar på EKG inom 8 minuter av ROSC inte behövde perkutan koronarintervention [43]. Därför rekommenderas seriell EKG. Datortomografi genomförs beroende på misstänkt tillstånd (till exempel lungemboli/blödning), men bör undvikas om patienten är instabil och det fördröjer nödvändig intensivvård. Spontan subaraknoidalblödning kan orsaka hjärtstopp, med cirka 20 procents överlevnad [44].
Icke framgångsrik återupplivning
Vid icke framgångsrik återupplivning utfärdas dödsbevis och transportsedel. Rättsmedicinsk obduktion ombesörjs av polisen och är indicerad vid misstänkt mord, självmord, olyckor, missbruk av droger eller läkemedel, fel inom sjukvården eller vid helt oväntade dödsfall. Någon minut bör ägnas åt en »hot debriefing« där teamet kommenterar omhändertagandet och samarbetet och personal kan tackas för insatserna [20]. I ett senare skede kan även en djupare »cold debriefing« göras i syfte att underlätta individuell bearbetning och förbättra verksamheten.
Potentiella bindningar eller jävsförhållanden: Therese Djärv är ordförande för svenska HLR-rådet, medförfattare av European Resuscitation Councils riktlinjer för avancerad hjärt–lungräddning 2021 samt medverkar i styrgruppen för 2025 års riktlinjer. Vidare är hon ledamot av International Liaison Committee on Resuscitation Scientific Advisory Committee och ordförande för deras »first aid task force«.
Checklista för ambulansrapport
- Symtom/omständigheter före hjärtstopp
- Klockslag vid konstaterat hjärtstopp/larm till SOS
- Bevittnat hjärtstopp (ja/nej)
- Bystander-HLR (ja/nej)
- Klockslag vid ambulanspersonalens/räddningstjänstens ankomst
- Initial rytm
- Antal defibrilleringar
- Antal doser amiodaron och adrenalin
- Uppgifter om anhöriga
Användning av en checklista rekommenderas för att inhämta information av diagnostiskt och prognostiskt värde i samband med ambulansrapport [20, 48].
Möjliga åtgärder vid refraktärt ventrikelflimmer/pulslös ventrikeltakykardi.
Rekommenderade åtgärder vid handläggning av patienter med refraktär pulslös ventrikeltakykardi (pVT), definierad som kvarstående ventrikelflimmer/pVT efter minst tre defibrilleringar [5]. Barndoser anges inom parentes.
Defibrillering
- Kontrollera elektrodplacering [5]
- Kontrollera elektrodkontakt och byt elektroder vid osäkerhet
- Använd maximalt rekommenderad energinivå för vuxna [5]
- Byt strömriktning genom hjärtat (från anterolateral [AL] till anteroposterior [AP] eller tvärtom) [5, 49]
- Överväg dubbel sekventiell defibrillering, det vill säga defibrillering med AL-elektroder följt 0,5 sekund senare av defibrillering med AP-elektroder [49], om personalen är tränad och godkänd utrustning finns
Läkemedel
- Adrenalin 1 mg iv (10 μg/kg) efter 3 defibrilleringar och därefter var fjärde minut [5, 50]
- Amiodaron 300 mg iv (5 mg/kg, max 300 mg) efter 3 defibrilleringar [5, 10])
- Amiodaron 150 mg iv (5 mg/kg, max 150 mg) efter 5 defibrilleringar [5, 10])
Övrigt
- Överväg Ecmo som brygga till koronarangiografi eller hjärtkirurgi [5, 36, 51]
- Koronarangiografi under pågående HLR kan göras i selekterade fall, framför allt om hjärtstoppet föregåtts av bröstsmärta och ST-höjningar på EKG
Beslut att avbryta återupplivningsförsök
- Faktorer associerade med sämre prognos vid hjärtstopp
- HLR > 40 minuter vid initialt defibrillerbar rytm
- HLR > 20 minuter vid asystoli/PEA
- Initial rytm asystoli/PEA (i stället för VF/pVT)
- Obevittnat hjärtstopp
- Frånvaro av bystander-HLR
- Avsaknad av hjärtaktivitet vid upprepad ultraljudsundersökning
- Lågt och sjunkande endtidalt CO2
PEA = Pulslös elektrisk aktivitet
VF/pVT = ventrikelflimmer/pulslös ventrikeltakykardi
Det finns inga etablerade kriterier för när HLR bedöms utsiktslös och ska avbrytas. Det finns heller ingen enskild parameter, såsom pupillreaktion, ålder, laktatvärde eller myokardkontraktilitet, att luta sig mot. Teamet får sammanväga patientens hälsotillstånd och livskvalitet före hjärtstoppet samt patientens svar på A-HLR.
Observationella studier visar att 99 procent av överlevarna fångas inom 25–45 minuters HLR [2, 61-64]. Enligt en studie var stillastående hjärta vid ultraljudsundersökning associerat med 0,6 procents överlevnad till utskrivning från sjukhuset [65]. Det finns dock ingen samsyn om hur ett stillastående hjärta ser ut vid ultraljudsundersökning [66]. Slutsatsen från en översiktsartikel är att det inte finns något ultraljudsfynd med etablerad prognostisk valör [67, 68]. Trender i endtidalt CO2 kan upplysa om hjärt–lungräddningens kvalitet, hjälpa till att upptäcka ROSC och bidra med prognostisk information [5].
När återupplivningen ter sig utsiktslös genomför ledaren en kort sammanfattning av patientens tillstånd och genomförda insatser samt meddelar att HLR avbryts om ingen har ytterligare åtgärdsförslag vid nästa rytmanalys. Den som har förslag får räcka upp en hand, och teamet får då diskutera ytterligare åtgärder innan HLR avbryts.
(uppdaterad 2025-01-17)





![Fall 1. En 66-årig man med diabetes ringde 112 på grund av bröstsmärta. EKG tolkades som ST-höjningsinfarkt och patienten kördes till sjukhuset för direkt angiografi. Vid ankomst till ambulanshallen fick patienten hjärtstopp. Den initiala rytmen var asystoli. Patientnära blodprov visade glukos 66 mmol/l och kalium 7,1 mmol/l. Patienten behandlades med adrenalin 1 mg iv bolus vid två tillfällen, kalciumglubionat 100 mg/ml 20 ml iv bolus, insulin 10 E iv bolus och fick tillbaka spontan cirkulation. Förnyat EKG visade ingen kvarstående ST-höjning. Den tidigare ST-höjningen var troligen ett hyperkalemiutlöst pseudoinfarktmönster [60]. Patienten avled 6 dagar senare till följd av hypoxiska hjärnskador.](https://lakartidningen.se/wp-content/uploads/2024/12/Illustration-12-Fall-1-EKG-och-BG.jpg)