Det har tidigare framkommit på Läkartidningens debattsidor att Sverige är det enda land i EU där man inte tillåter läkemedelsprövning på svårt sjuka patienter [1]. Här redogör vi för ännu en klinisk forskningsstudie som underkänts i såväl regionala som centrala etikprövningsnämnden. Ansökan gällde en internationell multicenterstudie i syfte att finna bästa behandlingsmetod för patienter med rupturerat bukaortaaneurysm. Vi undrar om inte den etiska prövningen innefattar en feltolkning av landets lagar och ett brott mot Helsingforsdeklarationen som får konsekvenser som direkt motverkar angelägen klinisk forskning. Eftersom etikprövningsnämndens beslut inte kan överklagas återstår offentlig debatt och opinionsbildning för en fortsatt process som på sikt kan generera en praxis som medger angelägen klinisk forskning på de svårast sjuka patienterna.
Brustet bukaortaaneurysm dödar 700–1 000 svenskar varje år. Om patienten hinner till sjukhus, och rätt diagnos ställs snabbt, kan en akut operation vara livräddande. Situationen är ofta dramatisk. Patienten är smärtpåverkad och i chock med lågt blodtryck och sviktande medvetande. För medföljande anhöriga kan situationen av naturliga skäl vara mycket uppskakande.
Konventionell öppen kirurgisk behandling av rupturerat bukaortaaneurysm utvecklades redan på 1950-talet och sker genom att snabbt öppna buken, stänga av cirkulationen och ersätta det brustna blodkärlet med ett konstgjort kärlgraft. Kärlkirurgen Volodos’ från Ukraina beskrev 1986 en ny metod att laga kärlet endovaskulärt med ett stentgraft (en kombination av nylon- och metallstent) som trycker fast det konstgjorda kärlet från insidan, med tillträde via ljumskarna [2].
Metoden, endovaskulär behandling av aortaaneurysm, brukar benämnas EVAR och används i dag vid cirka hälften av alla planerade ingrepp för bukaortaaneurysm i Sverige. Vid en akut ruptur är metoden mer problematisk att använda. EVAR kräver preoperativ kartläggning av anatomin med DT, vilket kan fördröja behandlingen. Tidigare studier har visat att patienter med rupturerat bukaortaaneurysm som behandlats med EVAR har bättre överlevnad än de som opererats öppet. Resultaten är dock osäkra och bygger i stor utsträckning på retrospektiva, icke randomiserade studier.
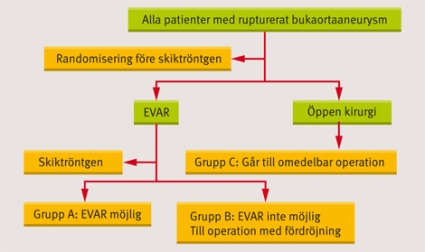
Eftersom mortaliteten bland patienter som opererats för ett brustet buk-aortaaneurysm sedan årtionden varit hög kan introduktionen av ny teknik som EVAR vara ett angeläget framsteg men motiverar först vetenskaplig utvärdering i en randomiserad studie. En sådan studie har nyligen initierats av kollegor i Storbritannien: IMPROVE (Immediate management of patient with ruptured aneurysm: open versus endovascular repair). Glädjande nog blev fyra av Sveriges största sjukhus inbjudna att medverka. Studiedesignen framgår av Figur 1.
I England har man till skillnad från i Sverige ett system med »patient advocates«. Det är för uppdraget särskilt utbildad hälsopersonal som i förväg kan informeras om en studie av detta slag och ta ställning till om det är etiskt försvarbart att inkludera patienten utan informerat samtycke. En offentlig utredning föreslog redan år 2004 införandet av ett liknande system i Sverige [3]. Men ännu har inget skett. Vem som är ansvarig för denna passivitet är oklart.
En lovvärd motion i riksdagen om läkemedelsprövningar på icke beslutskapabla patienter avslogs 2008 [4], men denna frågeställning är som alla förstår relevant för all klinisk forskning på icke beslutskapabla patienter såsom svårt somatiskt sjuka, psykiatriska patienter, barn, med flera.
Etisk prövning för vår medverkan i
studien skedde vid regionala etikprövningsnämnden i Uppsala. Vi ansökte om att få inkludera patienter utan att ett omedelbart medgivande gavs av icke beslutskapabla patienter eller av deras upprörda anhöriga, och att samtycket skulle kunna efterfrågas i efterhand. Vi har tidigare beviljats tre olika tillstånd för att bedriva forskning på exakt samma patientkategori och tillstånd att informera patienterna i efterhand [5-7], dock med den viktiga skillnaden att dessa tre studier inte innefattade något randomiseringsförfarande.
Nämnden biföll ansökan men ställde följande villkor: »De patienter som är oförmögna att ge ett samtycke till studien och där anhöriga inte kan tillfrågas ska inte inkluderas i studien.« I ansökan till regionala etikprövningsnämnden angavs tydligt att studien inte var genomförbar med ett sådant villkor. Det skulle innebära att man inför ett systematiskt fel i studien. De sjukaste patienterna, och de med sannolikt störst vinst av en bättre behandling, exkluderas. Framtida patienter i denna kategori utsätts därför för en extra risk eftersom vi aldrig kommer att veta hur de bäst borde behandlas. Enligt vår uppfattning resulterar detta i en diskriminering av den mest utsatta gruppen, något som strider mot andan i Helsingforsdeklarationen [8], där man bland annat i paragraf 8 skriver: »Ekonomiskt och medicinskt missgynnade personer har särskilda behov som måste beaktas.«
Nämndens beslut överklagades till centrala etikprövningsnämnden efter konsultation av Mats G Hansson, professor i medicinsk etik i Uppsala, och genomgång av lagtexten. I lagen (2003:460) om etikprövning av forskning som avser människor, paragraferna 20 och 21, står att läsa (våra kursiveringar):
Forskning får utföras utan samtycke, om sjukdom, psykisk störning, försvagat hälsotillstånd eller något annat liknande förhållande hos forskningspersonen hindrar att hans eller hennes mening inhämtas. Forskningen får dock utföras bara under de förutsättningar som anges i 21 och 22 §§.
Dessa förutsättningar är bland annat: 21 § Forskning avseende en forskningsperson som sägs i 20 § får utföras om
1. forskningen kan förväntas ge en kunskap som inte är möjlig att få genom forskning med samtycke, och
2. forskningen kan förväntas leda till direkt nytta för forskningspersonen.
Även om villkoret i första stycket 2 inte är uppfyllt får forskningen utföras om
1. syftet är att bidra till ett resultat som kan vara till nytta för forskningspersonen eller någon annan som lider av samma eller liknande sjukdom eller störning, och
2. forskningen innebär en obetydlig risk för skada och ett obetydligt obehag för forskningspersonen.
Vår tolkning är att detta resonemang måste vara tillämpligt på den grupp patienter vi önskar studera. De kommer ofta in svårt smärtpåverkade, medtagna av blödningschock, ibland i sällskap med en av naturliga skäl uppskakad anhörig och i en situation med stor tidsnöd för livräddande insats. Att i denna situation inhämta ett informerat samtycke av patienten, eller av anhöriga, upplevs av oss läkare som både olämpligt och olustigt. Det går också att ifrågasätta hur meningsfullt ett informerat samtycke är i denna situation och om det inte strider mot Helsingforsdeklarationens paragrafer 23–26 [8]. Om lagtexten inte är tillämplig på denna patientkategori, varför skrevs då lagen på detta sätt? Kan lagstiftaren ha syftat på någon grupp av patienter som är mer tillämplig?
I lagen står också (våra kursiveringar):
22 § En forskningsperson som sägs i 20 § skall så långt möjligt informeras personligen om forskningen. Samråd skall ske med forskningspersonens närmaste anhöriga. Samråd skall ske också med god man eller förvaltare enligt 11 kap. föräldrabalken, om frågan ingår i dennes uppdrag. Forskningen får inte utföras om forskningspersonen i någon form ger uttryck för att inte vilja delta eller om någon av dem som samråd har skett med motsätter sig utförandet.
I ansökan beskrevs hur patient och/eller anhöriga på bästa sätt skulle informeras och tillfrågas om medverkan i studien, men detta är som vi har beskrivit inte alltid möjligt. I överklagan av regionala etikprövningsnämndens beslut till centrala etikprövningsnämnden skrev vi: »Vi kan inte medverka till att hela studien belastas av ett systematiskt bortfall. Om denna överklagan ej bifalles kommer således studien ej att genomföras i Sverige, utan bara i Storbritannien. Ingen av de ansvariga läkarna på de fyra svenska sjukhusen – som hade planerat att delta – anser att det är etiskt möjligt att genomföra studien utan att kunna informera svårt medtagna patienter i efterhand.«
I sitt beslut gav centrala etikprövningsnämnden oss visserligen stöd för detta resonemang men kom trots detta fram till samma slutsats som regionala etikprövningsnämnden och avslog överklagan med hänvisning till gällande lagstiftning.
Anmärkningsvärt är att ingen av de medicinskt sakkunniga i den etiska granskningsprocessen reserverat sig mot besluten, vilket gör oss benägna att misstänka en konsensuskultur i dessa nämnder. De jurister som är ordförande i nämnderna har tolkningsföreträde, och medverkande läkare förefaller inte ifrågasätta tolkningen av lagen, inte ens när tolkningen enligt vårt resonemang strider mot Helsingforsdeklarationen.
Vad säger Läkarförbundets etiska kommitté om att tolkningen av vårt lands lagar förefaller att strida mot andan i Helsingforsdeklarationen? Vad säger Vetenskapsrådets ledning om att Sverige sannolikt är det enda land i EU som inte tillåter denna typ av forskning? Vi skickar denna debattartikel till bägge dessa instanser som en första åtgärd, i hopp om att någon gör något för att återupprätta förtroendet för Sverige som ett land där man kan bedriva medicinsk forskning i syfte att förbättra sjukvården för svårt sjuka patienter.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.