John Paoli och Magdalena Claeson (JP & MC) skriver i en förtjänstfull medicinsk kommentar i Läkartidningen [1] att uppföljningen av melanompatienter i landet är ojämlik och att det krävs tydliga riktlinjer i ett nationellt vårdprogram. Det är utmärkt att författarna lyfter fram denna aktuella och viktiga fråga. Vi instämmer helt i deras slutsats men menar att problemställningen måste fördjupas betydligt och diskuteras med hänsyn till den snabba och spännande medicinska utvecklingen inom melanomområdet.
I princip följs melanompatienter upp med två skilda målsättningar [2]:
1. Prevention. Alla patienter bör bedömas och vid behov erbjudas klinisk uppföljning av dermatolog i sekundär- och tertiärpreventivt syfte, dvs för att identifiera och avlägsna förstadier till hudmelanom samt att tidigt upptäcka och behandla de melanom som ändå hinner utvecklas. Här ingår även primärpreventiva insatser i form av information och instruktioner för att undvika skadlig exponering för ultraviolett strålning. Som en detaljanmärkning kan nämnas att JP & MC missuppfattat texten i det regionala vårdprogrammet i Stockholm– Gotlands sjukvårdsregion: alla patienter erbjuds givetvis hudundersökning av dermatolog, inte endast de som har T1-melanom med tjocklek upp till 1 mm!
2. Recidiv. Dessutom bör patienter med risk för recidiv av melanom erbjudas regelbunden uppföljning av onkolog. Traditionellt har en huvudmålsättning med denna uppföljning varit att tidigt diagnostisera och behandla regionala lymfkörtelmetastaser, dvs melanom stadium III, genom regelbundna kliniska undersökningar och vid behov kompletterande finnålsbiopsier av patologiskt förstorade lymfkörtlar. Detta har motiverats av att man vid tidigt upptäckt stadium III-sjukdom kan erbjuda kurativt syftande behandling. Däremot har huvudavsikten inte varit att tidigt diagnostisera subkliniska fjärrmetastaser, dvs stadium IV, då någon effektiv behandling oftast inte kunnat erbjudas dessa patienter.
Denna situation har nu totalt förändrats genom två viktiga utvecklingssteg inom melanomsjukvården, som helt ändrar målsättningen med onkologisk uppföljning.
Nu genomförs som ett led i stadieindelningen i samband med diagnos så kallad sentinel node-biopsi hos patienter med melanom med förhöjd risk för lymfkörtelmetastaser, dvs patienter med primärtumörer överstigande 1 mm tjocklek och/eller andra ogynnsamma histopatologiska parametrar, T1b–T4 [3]. Eftersom patienter med regionala lymfkörtelmetastaser därigenom diagnostiseras och behandlas redan vid diagnos, bortfaller i huvudsak problemet med tidigupptäckt av regionala metastaser under uppföljning.
Dessutom, och än mer betydelsefullt, har nya behandlingar visat avsevärt förbättrade effekter när det gäller melanom med generella fjärrmetastaser, stadium IV. Det mest tydliga genombrottet har skett genom användning av så kallade målsökandee behandlingar (»targeted therapies«) hos patienter med V600-mutationer i protoonkgenen BRAF [4], vilka förekommer hos drygt 50 procent av alla hudmelanom [5, 6]. Dessutom har en ny typ av immunterapi med CTLA4-antikroppar visat förlängd överlevnad hos patienter med spridd melanomsjukdom som progredierat på tidigare behandling [7].
Denna utveckling går oväntat snabbt – dessa viktiga framsteg har publicerats under det senaste året. Många studier finns därför rapporterade endast i preliminär form eller via pressreleaser. Ytterligare resultat kommer att presenteras vid det årliga mötet med American Society for Clinical Oncology i juni 2011.
Detta innebär att vi från och med nu måste genomföra molekylära analyser av möjliga terapeutiska mål (»targets«) tidigt vid högriskmelanom, det vill säga i stadium III, och dessutom hos patienter med T4-tumörer med tjocklek överstigande 4 mm. Införande av mutationstestning i större skala har påbörjats. Vi bör även följa dessa patienter mer aktivt med avseende på fjärrmetastaser och tidigt sätta in behandling vid stadium IV-sjukdom.
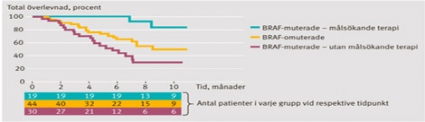
Denna approach är nödvändig framför allt hos patienter med BRAF V600-muterade tumörer, eftersom färska resultat talar för att man verkligen kan förbättra prognosen. I en ny undersökning från The Melanoma Institute Australia i Sydney visas att patienter i stadium III och BRAF-muterade tumörer generellt har en sämre prognos än de vars tumörer saknar BRAF-mutation [8]. Anmärkningsvärt nog kan man genom att använda moderna läkemedel, såsom BRAF- och MEK-hämmare, förändra situationen så att BRAF-mutation, från att ha varit en dålig prognostisk markör, omvandlas till att vara associerad med förbättrad överlevnad (Figur 1)!
Detta nya genombrott innebär att vi nu har möjlighet att erbjuda effektiv behandling till en stor, väldefinierad grupp patienter med spridd (stadium IV) melanomsjukdom med BRAF-muterade tumörer. Det är ett första, och lysande, exempel på att individualiserad behandling (»personalized medicine«) framgångsrikt kan tillämpas inom melanomområdet.
Ytterligare nya behandlingsmöjligheter öppnar sig genom den ökade förståelsen för biologin hos maligna tumörer, avseende till exempel intracellulära signalvägar och metabola processer, genomisk instabilitet, tumörcellers interaktion med stroma, kärlnybildning och påverkan av immunsystemet [9]. För att validera potentialen av detta paradigmskifte är det även nödvändigt att implementera moderna system för resultatuppföljning inom melanomvården. Även detta håller på att införas.
Det pågår för närvarande ett intensivt arbete inom Svenska melanomstudiegruppen för att färdigställa ett nytt nationellt vårdprogram för melanom, som ska gälla från 2012. I detta bör de nya terapeutiska vinsterna beskrivas, och riktlinjer för att tillämpa individualiserad behandling inom melanomområdet fastläggas. Det kommer att kräva en moderniserad uppföljningsstrategi, som beskrivits ovan. Denna moderna handläggning av melanom kommer att nödvändiggöra ett välfungerande multidisciplinärt teamarbete med gemensam bedömning av melanompatienter redan vid diagnos under medverkan av dermatolog, kirurg, onkolog, röntgendiagnostiker samt patolog/molekylärpatolog.
Glädjande nog har det just meddelats att en intresseorganisation för patienter med malignt melanom bildats i Europa [10]. Aktiviteter för att tillvarata patientintressen pågår även här i Sverige (se Melanomföreningen, gemenskap på Facebook). Vi behöver nu gå hand i hand med våra patienter för att framgångsrikt genomföra introduktion av individualiserad behandling för malignt melanom i hela Sverige!
* Potentiella bindningar eller jävsförhållanden: Johan Hansson ingår i advisory board för Merck och Bristol-Myers Squibb, innehar forskningsanslag från Merck Sharp and Dohme (MSD Sweden, tidigare Schering-Plough) och är anlitad som föreläsare av Merck, Bristol-Myers Squibb och Roche.
Denna webbplats vänder sig till läkare
LT debatt
0 Kommentarer
Melanombehandlingen individualiseras
Paradigmskifte inom onkologi:
Melanomsjukvården står inför ett paradigmskifte. Patienter med regionala lymfkörtelmetastaser kan nu behandlas redan vid diagnos, och nya behandlingar har visat avsevärt förbättrade effekter av individualiserad behandling av melanom med generella fjärrmetastaser.
Publicerad:
Läkartidningen 20/2011
Lakartidningen.se
Från startsidan