Sammanfattat
Androgener spelar en viktig roll för mannens reproduktionssystem, kroppssammansättning, hårväxt, muskelfunktion och kardiovaskulära funktion.
Mutationer i androgenreceptorgenen ger en dramatisk effekt på fenotypen.
Två polymorfa regioner i androgenreceptorn verkar bidra till att finjustera receptorns funktion. Därmed kan dessa variationer bidra till utveckling av olika androgenberoende sjukdomar och eventuellt även modifiera livsstils- och miljöfaktorers effekter på vår hälsa.
Framtida forskning kommer att visa om analys av dessa receptorvarianter kan leda till identifiering av individer med ökad risk för dålig spermakvalitet, hypogonadism eller metabola störningar. Ett annat möjligt kliniskt applikationsområde är inom farmakogenetik, för att uppnå en mer individualiserad styrning av androgensubstitutionsterapin.
Manliga könshormoner, androgener, är en grupp steroidhormoner som hos mannen främst bildas i testikeln, men också binjurarna syntetiserar androgener.
Testosteron
Det kvantitativt viktigaste androgenet är testosteron. Testosteron bildas först och främst i testikelns Leydigceller. Hos en vuxen man produceras genomsnittligt 6–8 mg testosteron per dag. Den totala plasmakoncentrationen av testosteron ligger normalt på 10–30 nmol/l. Mer än 95 procent av det totala testosteronet i plasma är bundet till sexualhormonbindande globulin (SHBG) eller till albumin. Endast den fria fraktionen anses vara biologiskt aktiv. I testikeln är testosteronkoncentrationen 100–200 gånger högre än i plasma, och man tror att dessa höga androgennivåer behövs för normal spermiebildning. Androstendion, dihydroepiandrostendion och dihydroepiandrostendionsulfat är exempel på andra androgener, men kvantitativt och kvalitativt verkar de spela en mindre roll för den samlade androgena effekten.
Androgeneffekten
Androgener utövar huvudsakligen sin fysiologiska effekt via sin specifika receptor, androgenreceptorn, även om alternativa s k icke-genomiska, direkta effekter av androgener också har påvisats [1]. En optimal androgen effekt är fullständigt beroende av en fungerande androgenreceptor. Mutationer i androgenreceptorgenen är sällsynta men kan på ett avgörande sätt ändra fenotypen [2]. De senaste årens forskning har dock visat att små, naturligt förekommande variationer i androgenreceptorstrukturen, s k polymorfier, också kan påverka androgenresponsen på ett fysiologiskt och kliniskt relevant sätt och möjligen också modifiera individers känslighet för vissa miljögifter – sådana som har hormonliknande effekt.
Enzymet 5a-reduktas katalyserar omvandlingen av testosteron till dihydrotestosteron. Dihydrotestosteron är en mer potent stimulator av androgenreceptorn än testosteron. Metabolisering av testosteron till dihydrotestosteron sker perifert i olika vävnader – med prostata, penis och skrotum som de viktigaste dihydrotestosteronberoende organen. Plasmakoncentrationen av totalt dihydrotestosteron ligger normalt på ca 10 procent av den totala testosteronkoncentrationen. Dihydrotestosteron är inte bara en starkare stimulator av androgenreceptorn än testosteron, utan vissa androgena effekter är absolut dihydrotestosteronberoende. I fosterlivet gäller detta utvecklingen av yttre manliga genitalia och prostata [3], medan vuxna män behöver dihydrotestosteron för den androgena effekten på prostata och hårfolliklar, vilket bl a relaterar till vuxenuttrycket av 5α-reduktas I-genen.
Androgener är också viktiga för normal kvinnlig fysiologi, men hos mannen spelar de en avgörande roll för utvecklingen av normal fenotyp, pubertet och vuxen funktion hos reproduktions- och andra organ. Man bör också hålla i minnet att en del av de hormonella effekter som man tidigare trodde gick via androgenreceptorn, t ex skelettmognad, till största delen är en konsekvens av metabolisering av androgen till östrogen, som i sin tur verkar genom östrogenrelaterade receptorer [4].
Androgenreceptorn
Androgener binder till en intracellulär androgenreceptor, som uttrycks i målorganen. Denna receptor hör till en familj av steroidhormonreceptorer som förmedlar alla steroid- och tyreoideahormonrelaterade effekter [5].
Androgenreceptorgenen finns i en enda kopia, belägen på X-kromosomen, och följer ett X-bundet recessivt nedärvningsmönster. Således har individer med 46,XY-karyotyp endast en androgenreceptorgen. Androgenreceptorgenen innehåller, som andra steroidhormonreceptorer, olika funktionella domäner: en transaktiverande domän belägen i exon 1, en DNA-bindande i exon 2–3 och en hormonbindande domän i exon 4–8 [6]. Mellan exon 3 och 4 finns en s k hinge-region, som innehåller en nukleär lokaliseringssignal.
Androgener diffunderar in i målceller och utövar sin verkan genom att binda till den intracellulära receptorn som finns inaktiv i cytoplasman. När testosteron eller dihydrotestosteron bundit till receptorn frigörs s k heat-shock-proteiner från receptorn, och denna genomgår en konformationsändring till en aktiv form. Androgenreceptor–hormonkomplexet transporteras till cellkärnan, där androgenreceptorn binder till en målgen, och s k kofaktorer attraheras till receptorn och cellens maskineri för att bilda de proteiner som bidrar till att den androgena effekten startar [7].
Androgenreceptormutationer
I androgenreceptorgenen finns fler än 300 mutationer registrerade i en databas ‹ http://www.androgendb.mcgill.ca › [8]. En övervägande del av mutationerna återfinns hos patienter med komplett eller partiell androgenokänslighet, och vid närmare granskning av dessa mutationer kan fyra olika typer urskiljas: 1) punktmutationer; 2) nukleotidinsertioner eller -deletioner, oftast orsakande en s k läsramsmutation och ett icke-funktionellt protein; 3) komplett eller partiell gendeletion; 4) mutationer i introner, som påverkar den s k splicingen av RNA. De flesta mutationer, ca 70 procent, är lokaliserade till den hormonbindande domänen, medan 20 procent finns i den DNA-bindande delen och resten i den transaktiverande domänen [8].
Androgenokänslighet hos XY-individer är tillstånd som fenotypiskt spänner över ett brett spektrum: från helt kvinnlig fenotyp, karakteriserad av normala kvinnliga yttre genitalia och avsaknad av inre manliga genitalia, till normal manlig utveckling, eventuellt med mikropenis och/eller infertilitet [3]. Testiklarna ligger vid fullständig androgenokänslighet vanligen intraabdominellt men kan också vara belägna i inguinalkanaler eller labiae. Under puberteten resulterar nedsatt hypotalamisk androgenokänslighet i bristande negativ feedback, som får till följd att sekretionen av LH ökar, och sekundärt till detta ökar sekretionen av testosteron från testiklarna. Via perifer aromatisering av testosteron produceras sedan östrogen i tillräckliga mängder för att ge upphov till normal bröstutveckling och tillväxtspurt under puberteten. Då en fungerande androgenreceptor krävs för sekundär könsbehåring kommer däremot en sådan att vara reducerad eller saknas helt hos flickor med komplett androgenokänslighet.
Komplett androgenokänslighet har rapporterats förekomma hos 1/20 000 genetiska män [9]. Vid partiell androgenokänslighet har testosteron och dihydrotestosteron haft varierande grad av biologisk effekt under perioden för könsdifferentieringen. De kliniska manifestationerna omfattar ett brett spektrum: från uttalade defekter, där yttre genitalia kan uppfattas som kvinnliga med lätt klitorishypertrofi, till lindriga former med isolerad hypospadi [2]. Även utvecklingen av de wolffska gångstrukturerna (epididymis, vas deferens och vesicae seminales) varierar beroende på graden av androgenokänslighet: från rudimentära till normalt utvecklade. Förutom att det finns individer med lindriga symtom på undermaskulinisering och infertilitet som huvudsymtom så finns enstaka rapporter rörande mutationer i androgenreceptorn hos normala män.
Den kliniska bilden vid androgenokänslighet beror således på graden av nedsatt androgenreceptorfunktion. Värt att notera är att beträffande androgenreceptorgenen finns ingen entydig koppling mellan specifika mutationer och fenotyp, utan en och samma mutation kan resultera i olika fenotyper, kvinnlig respektive manlig [10].
Androgenreceptorpolymorfier
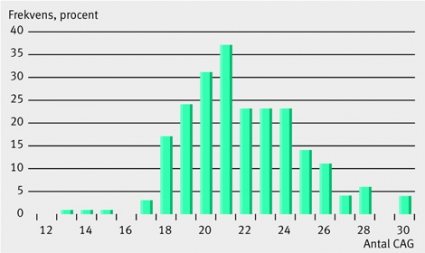
Unikt för androgenreceptorn jämfört med övriga steroidreceptorer är två segment, bestående av ett variabelt antal av aminosyrorna glutamin och glycin i den transaktiverande domänen. Det första kodas av ett varierande antal CAG-bastripletter, följt av GAA. Den variabla delen kallas för CAG-repetitionen. Beträffande CAG-repetitionens längd vet man att etniska skillnader finns; individer av europeiskt ursprung har i medeltal ca 22 CAG, varierande från 10 till 30 i en normalfördelning (Figur 1), asiater något fler och amerikaner av afrikanskt ursprung något färre CAG [11]. Individer med fler än 40 CAG kan utveckla Kennedys sjukdom, en neuromuskulär sjukdom [12]. I experimentella studier har CAG-längden visats ha en negativ korrelation med androgenreceptorns förmåga att aktivera en målgen, dvs ju fler CAG, desto sämre fungerande receptor [13].
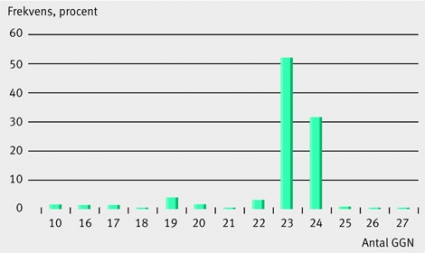
Beträffande GGN-repetitionen så består den genetiska koden av (GGT3GGG(GGT)2GGCn, i vilket GGC-delen varierar mellan olika individer och populationer. I en europeisk befolkning finns två dominerande varianter om 23 respektive 24 GGN (Figur 2). De sex första tripletterna antogs länge vara en fast del av GGN-repetitionen, men i dag vet man att ca 1 procent av befolkningen bär på andra kombinationer än de vanligaste [14]. I experimentella studier har man visat att GGN-repetitionen påverkar androgenreceptorns förmåga att aktivera en målgen [15], men vilken fysiologisk funktion området har är ännu inte känt. Nya rapporter har dock indikerat att antalet GGN är associerat med kryptorkism och hypospadi, som är de vanligaste medfödda missbildningarna hos pojkar [16].
Mekanismen bakom CAG- och GGN-repetitionernas effekt på receptorns aktivitet är okänd. En arbetshypotes är att ett varierande antal glutamin respektive glycin, som dessa repetitioner kodar för i längder som finns i en generell population, kan attrahera olika kofaktorer till transkriptionsmaskineriet eller att receptor–hormonkomplexet skulle påverkas i sin stabilitet, men inga studier rörande dessa molekylära mekanismer har ännu publicerats.
Kliniska implikationer av variationer i CAG- och GGN-längd
Eftersom in vitro-studier indikerar att längden på CAG- och GGN-repetitionerna påverkar androgenreceptorns funktion är det närliggande att föreställa sig att dessa polymorfier även kan ha in vivo-effekter. Det mest påfallande exemplet på ett direkt samband mellan variationer i androgenreceptorn och ett väldefinierat sjukdomstillstånd är Kennedys sjukdom eller spinobulbär muskelatrofi (SBMA). Sjukdomen uppträder hos män med 40 eller fler CAG-repetitioner och debuterar oftast i 30–50 års ålder [17]. Klassiska symtom på SBMA inkluderar muskelkramper, tremor, ökad risk för diabetes mellitus, tecken på hypogonadism–gynekomasti, dålig spermakvalitet, testikelatrofi och höga gonadotropinnivåer. De neuromuskulära symtomen relaterar till den neurotoxiska effekten av många CAG-repetitioner snarare än till en minskad androgen effekt.
Värt att notera är att ju fler CAG-repetitioner en individ med SBMA har, desto värre blir den neurotoxiska effekten. Orsaken till detta är inte klargjord, men det kan tänkas att antalet CAG påverkar proteinets struktur, medförande proteinaggregationer och en generell celltoxisk effekt. I djurförsök där man inkorporerat ett antal glutamin kodade av en lång CAG-repetition i proteiner som normalt inte innehåller ett expanderat område av denna aminosyra har visat sig vara tillräckligt för att orsaka neurodegenerativ skada. Dessa studier antyder att det kan finnas en gemensam underliggande orsak till sjukdomstillstånd som är associerade med långa CAG-repetitioner, som Kennedys sjukdom och Huntingtons sjukdom.
Mindre klart är sambandet mellan variationer i CAG- och GGN-antal inom ett fysiologiskt variationsintervall och sjukdomsrisk. Eftersom prostata är ett i högsta grad androgenberoende organ har en del uppmärksamhet samlats kring androgenreceptorpolymorfier i relation till prostatacancer och benign prostatahyperplasi (BPH). På populationsnivå är prostatacancerrisken högst hos svarta amerikaner, som också har det lägsta CAG-genomsnittantalet, och lägst hos asiater, vilka också i medeltal har det högsta CAG-antalet. I båda avseendena intar individer av europeiskt ursprung en intermediär position [18]. Dessa samband har dock inte varit lika tydliga i fall–kontrollstudier. Resultaten av dessa studier är något motstridiga, förmodligen beroende på att prostatacancer är en multifaktoriell sjukdom, där faktorer som bl a livsstil och ålder i inkluderade studiegrupper kan spela en roll för utfallet. De studier som tagit hänsyn till dessa faktorer indikerar att lågt CAG-antal disponerar för en högre risk för prostatacancer och/eller tidigare ålder vid diagnos. Data beträffande GGN-antal i relation till prostatacancer är mer sparsamma, men ett samband mellan GGN-antal och risk för tidig dödlighet i prostatacancer har rapporterats [19]. Även för BPH har man funnit högre risk för sjukdomen om CAG-antalet är ≤19 än om det är 25, men alla studier har inte kunnat bekräfta detta samband.
Spermatogenesen är en androgenberoende process, varför man skulle kunna förvänta en lägre spermieproduktion och en större risk för infertilitet hos män med många CAG och en därav följande sämre androgenreceptorfunktion. Resultaten inom detta område har varit motstridiga, vilket kanske inte är förvånande, eftersom spermakvalitet och fertilitet påverkas av flera andra faktorer än den intratestikulära androgena miljön. Dock har en nyligen publicerad metaanalys visat att infertila män har statistiskt signifikant högre antal CAG än fertila kontroller [20]. Sambandet var emellertid ganska svagt, och att bära på många CAG bör därmed betraktas som en predisponerande faktor snarare än en orsak till dålig spermakvalitet. Kombinationen av vissa CAG- och GGN-längder kan också spela en roll för utfallet. I två studier har sambandet mellan infertilitet och högt CAG-antal varit mer uttalat hos män med en GGN-längd på 24 eller fler [21, 22].
Av andra reproduktionsrelaterade effekter kan man nämna att CAG-antalet associerar negativt med serumnivån av fritt testosteron och LH. Möjligen kommer man i framtiden att ta hänsyn till denna farmakogenetiska effekt i samband med androgensubstitution.
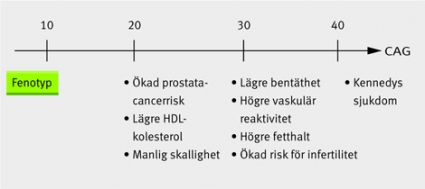
Androgener har en genomgripande effekt på flera slags extragonadal vävnad, och i överensstämmelse med detta har man observerat att ett långt CAG-segment är associerat med lägre bendensitet, högre HDL-koncentration, högre kroppsfetthalt, högre arteriell vasoreaktivitet och lägre risk för skallighet. Studier rörande GGN-längd i förhållande till androgenrelaterade effekter är få, och generellt är sambanden mindre tydliga än för CAG. Sambandet mellan CAG-antalet och olika patologiska tillstånd visas i Figur 3.
Androgenreceptorpolymorfier och gen–miljöinteraktion
Under de senaste åren har en livlig diskussion beträffande livsstils- och miljöfaktorers eventuella negativa effekt på den manliga reproduktionsfunktionen pågått. Ett exempel är cigarettrök, för vilket exponering i vuxenlivet, men kanske speciellt i fosterlivet, verkar medföra lägre spermieproduktion [23]. En del av de toxiska substanser som finns i tobaksrök och andra miljögifter har effekt på androgenreceptorn. Det är därför närliggande att föreställa sig att polymorfier i androgenreceptorn inte bara påverkar de fysiologiska effekter som androgener har utan också kan modifiera miljögifters effekt på reproduktionssystemet.
Vi har i en nyligen publicerad studie visat att den in vitro mest aktiva formen av androgenreceptorn med GGN-antalet 23 är mindre vanligt förekommande hos patienter med hypospadi respektive kryptorkism [16]. Denna variant finns hos 55 procent av alla av europeiskt ursprung men hos endast 30 procent av individer med hypospadi respektive kryptorkism. Vi har därför föreslagit att 23 GGN kan vara skyddande mot risken att utveckla hypospadi och kryptorkism. Grönländska inuiter exponeras för extremt höga nivåer av miljögifterna PCB och DDE, som är kemikalier med hormonstörande effekt. Trots detta har inuiter tio gånger lägre risk för hypospadi än vad svenskar har. En möjlig förklaring är att nästan 90 procent av inuiterna har en androgenreceptor med en GGN-längd på det skyddande antalet 23 [24].
I en stor EU-finansierad studie rörande effekterna av DDE- respektive PCB-exponering på den manliga reproduktionsfunktionen sågs inget samband mellan exponeringsnivå och spermieantal [25]. Hos 20 procent av alla de män som hade en CAG-längd under 20 var emellertid spermieantalet 40 procent lägre hos högt exponerade än hos lågt exponerade män [26]. Båda dessa studier indikerar att variationer i CAG- respektive GGN-längd kan modifiera miljöfaktorers påverkan på det manliga reproduktionssystemet. Mekanismen bakom denna gen–miljöinteraktion är inte klargjord än, men man kan spekulera över om en del av förklaringen ligger i att CAG- och GGN-längderna kan påverka miljögifters inverkan på receptorfunktionen. En annan förklaring kan vara att de är av betydelse för rekryteringen av kofaktorer, som i sin tur är av betydelse för receptorfunktionen.
Androgener spelar en viktig roll inte bara för reproduktionssystemet utan också för andra organs funktion. Eftersom det hos mannen endast finns en kopia av androgenreceptorn får variationer i denna gens struktur betydelse för den totala androgeniteten. Vissa sällsynta mutationer kan ha en genomgripande effekt på fenotypen, medan polymorfierna kan finjustera en individs androgenkänslighet och även påverka sensitiviteten för vissa miljögifter.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna