Sammanfattat
Likvorundersökning bör ingå i varje minnesutredning.
Undersökning av celltal, blod–hjärnbarriärfunktion och eventuell intratekal immunglobulinproduktion används för att utesluta neuroinfektiösa och neuroinflammatoriska sjukdomar.
Likvornivåer av total-tau, fosfo-tau, (beta)-amyloid och neurofilament används för att differentiera olika primärdegenerativa sjukdomar med minnessymtom.
Degenerativa processer i centrala nervsystemet (CNS) återspeglas i likvor. Likvor, eller cerebrospinalvätska, finns i hjärnans ventriklar och subaraknoidalrummet, som omsluter hjärnan och ryggmärgen. Likvorrummets volym hos en vuxen människa är ca 150 ml, varav 20–30 ml finns i ventriklarna. Produktionshastigheten av likvor är relativt hög, ca 20 ml per timme. Den mängd man oftast tappar ut vid likvoranalyser (8– 12 ml) återbildas således inom en halvtimme. Likvorrummet åtskiljs från hjärnans extracellulärrum av endast ett enkelt lager ependymceller. Detta ependymcellslager har hög permeabilitet för de flesta ämnen, inklusive proteiner, och därför sker ett fritt utbyte av substanser mellan hjärnans extracellulärrum och likvor, vilket utnyttjas i diagnostiskt syfte vid likvoranalyser. Som beskrivits i Läkartidningen är lumbalpunktion en enkel och säker undersökning [1], som mycket väl kan utföras i primärvården.
Vikten av tidig diagnostik
Alzheimers sjukdom är den vanligaste orsaken till demens [2]. Den är en långsamt progredierande neurodegenerativ sjukdom med ett betydande prekliniskt förlopp. Sannolikt startar sjukdomsprocessen 20–30 år innan patienten får de första kliniska symtomen [3]. Symtomen börjar smygande, och initialt märks endast lätta minnessvårigheter, som successivt blir mer uttalade. Denna fas av sjukdomen, med isolerad minnesstörning utan andra demenssymtom, kallas lindrig kognitiv störning (mild cognitive impairment, MCI) [4].
I dag söker flertalet patienter med minnesstörning tidigt med mycket lindriga symtom. Det är i detta skede svårt att kliniskt avgöra om patienten håller på att utveckla alzheimer eller någon annan demenssjukdom eller om symtomen härrör från depression/utbrändhet eller godartad åldersrelaterad minnesfunktionsnedsättning. Samtidigt är det vid alzheimer viktigt att starta farmakologisk behandling med acetylkolinesterashämmare så tidigt i sjukdomsförloppet som möjligt för att lindra symtomen och förbättra livskvaliteten. Om den nya typen av sjukdomsmodifierande läkemedel, som troligen angriper primärpatogenetiska processer, visar sig effektiv kommer det att bli helt avgörande att kunna initiera behandlingen så tidigt i sjukdomsförloppet som möjligt, innan hjärnskadorna har blivit för omfattande [5].
De ökade kunskaperna om demenssjukdomarnas naturalförlopp innebär att de kriterier som använts under mer än 20 år för klinisk diagnostik och som huvudsakligen vilar på uteslutningsprincipen kan anses föråldrade. Nyligen publicerades nya forskningskriterier för alzheimerdiagnostik [6]. De bygger på en kombination av sedvanlig klinisk diagnostik och biomarkörer inkluderande likvoranalyser, magnetkameraundersökning (MR) och/eller positronemissionstomografi (PET). En viktig princip i dessa kriterier är att diagnosen kan ställas mycket tidigare i sjukdomsförloppet om patienten har lindrig kognitiv störning och biomarkörer som talar för alzheimer.
Likvoranalyser vid utredning av minnessjukdomar delas in i basala och specifika. Med basala likvoranalyser kan exempelvis infektiösa, inflammatoriska och cerebrovaskulära sjukdomar identifieras. Specifika likvoranalyser som avspeglar sjukdomsspecifika molekylära skeenden har utvecklats för diagnostik av alzheimer, men vad beträffar övriga demenssjukdomar återstår fortfarande mycket forskningsarbete.
Basala likvoranalyser
De basala analyser som rutinmässigt bör ingå i en demensutredning är cellräkning och bestämning av blod–hjärnbarriärfunktion och intratekal immunglobulinproduktion (Tabell I).
Vid cellräkning kvantifieras erytrocyter (»röda«) och leukocyter (»vita«), som delas upp i polynukleära (»poly«) och mononukleära (»mono«) leukocyter. Vid serösa meningoencefaliter (tex tuberkulos, neuroborrelios, HIV-encefalit, svampinfektioner, olika virusmeningiter) ses lätt till uttalad mononukleär cellökning. En diskret monocytär cellstegring kan också ses vid olika inflammatoriska sjukdomar, tex multipel skleros. Primära neurodegenerativa sjukdomar har normala celltal.
Med blod–hjärnbarriären menas den barriär som finns mellan blodet och hjärnan, då hjärnans kapillärer har betydligt lägre permeabilitet än kapillärer i andra organ [7]. Som mått på blod–hjärnbarriärfunktionen används albuminkvoten [8]. Albumin syntetiseras inte i CNS, och allt albumin i likvor har därför passerat över blod–hjärnbarriären. Normalt finner man en lätt ökning av albuminkvoten hos äldre individer. Vid ökad albuminkvot talar man om blod–hjärnbarriärskada, vilket ses vid olika tillstånd med ökad kapillärpermeabilitet, såsom infektioner (tex neuroborrelios), inflammatoriska sjukdomar (tex Guillain–Barrés syndrom), tumörer och hjärntrauma. Kraftigt ökad albuminkvot ses även vid spinala tumörer som förhindrar passagen av likvor längs spinalkanalen. Vid cerebrovaskulära sjukdomar ses ökad albuminkvot, och vid vaskulär demens ses därför ofta lätt till måttlig blod–hjärnbarriärskada. Vid degenerativa sjukdomar, som alzheimer och frontotemporal demens, är blod–hjärnbarriärfunktionen däremot normal. Detta kan användas differentialdiagnostiskt; blod– hjärnbarriärskada talar emot primärdegenerativ hjärnsjukdom som enda förklaring till patientens symtom.
Vid kroniska inflammatoriska processer och infektioner svarar immunsystemet i CNS med att producera antikroppar. Detta kallas intratekal immunglobulinproduktion och kan bestämmas dels kvantitativt genom att beräkna IgG- och IgM-index, dels kvalitativt genom att påvisa oligoklonala band i likvor (Tabell I). De kvantitativa måtten IgG- och IgM-index ger en uppskattning av mängden IgG och IgM som produceras i CNS [8, 9]. Vid isoelektrisk fokusering (IEF) av serum och likvor kan likvorselektiva oligoklonala IgG-band påvisas. Med en annan elektroforetisk teknik kan intratekal IgM-produktion påvisas [10, 11]. Intratekal immunglobulinproduktion ses vid dels olika infektioner (tex neuro-aids, neurosyfilis och neuroborrelios), dels inflammatoriska sjukdomar (tex multipel skleros och cerebral systemisk lupus erythematosus). Fynd av intratekal immunglobulinproduktion bör föranleda kompletterande diagnostisk utredning med odling och serologi (tex syfilis, borrelia, HIV). Omvänt talar avsaknad av intratekal immunglobulinproduktion emot inflammatorisk hjärnsjukdom.
Specifika likvoranalyser för alzheimerdiagnostik
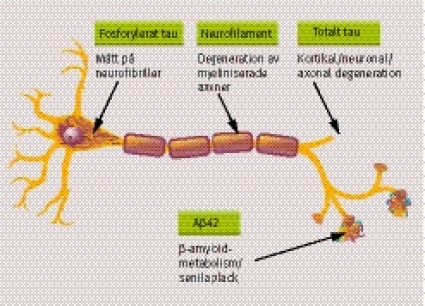
De biokemiska analyser som specifikt utvecklats för diagnostik av alzheimer är total-tau (T-tau), som avspeglar axonal nervcellsdegeneration, fosforylerat tau (fosfo-tau, P-tau), som avspeglar hyperfosforylering av tau och bildning av neurofibriller, samt olika varianter av b-amyloid (A(beta)42 och A(beta)40) som avspeglar metabolismen av (beta)-amyloid och bildningen av senila plack (Figur 1). Enligt SBU:s rapport om demenssjukdomar från 2006 bidrar kombinationen av T-tau och A(beta)42 starkt till det diagnostiska arbetet med att urskilja alzheimer från kontrollgrupper och andra demenstillstånd, medan P-tau bidrar måttligt starkt.
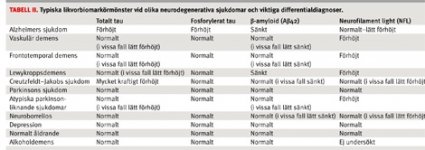
Total-tau (T-tau). Tau finns i nervcellernas axoner i hjärnan, företrädesvis i tunna icke-myeliniserade kortikala axoner [12]. Dess funktion är att binda till mikrotubuli i axonerna och därigenom stabilisera dessa (Figur 1). En fosfatgrupp kan kopplas till ett antal aminosyror i tau, och därför kan tau kan vara fosforylerat i olika grad. Genom att använda monoklonala antikroppar som reagerar med alla isoformer av tau oberoende av fosforyleringsgrad har man kunnat utveckla ELISA-analyser som bestämmer nivån av T-tau. Ökad nivå av T-tau i likvor avspeglar graden av neuronal/axonal degeneration och skada [13]. Ett flertal studier har visat att det finns måttligt till kraftigt ökad nivå av T-tau i likvor vid alzheimer; medelnivån är mer än tre gånger högre än hos friska individer i samma ålder. Detta fynd har verifierats i över 50 studier inkluderande mer än 5000 fall. Sensitiviteten för T-tau att identifiera alzheimer är hög: ca 85 procent av alla alzheimerfall har ökat T-tau i likvor [13]. Eftersom nivån av T-tau speglar det axonala sönderfallet ses ökad nivå även vid andra sjukdomar med aktivt axonalt sönderfall. De högsta nivåerna ses därför vid stor akut stroke och Creutzfeldt–Jakobs sjukdom [14, 15]. Lätt till måttligt ökad nivå av T-tau i likvor kan även ses hos en del fall med frontotemporal demens och lewykroppsdemens (Tabell II) [16]. Vid vaskulär demens är litteraturen inte helt entydig.
Sammanfattningsvis finner man normala nivåer av T-tau i likvor hos patienter med cerebrovaskulär sjukdom i lugnt skede liksom vid »ren« vaskulär demens. Normala nivåer av T-tau i likvor ses förutom vid normalt åldrande vid flera viktiga differentialdiagnoser till alzheimer, inkluderande depression, utbrändhet och kroniska neurologiska sjukdomar (tex progressiv supranukleär paralys och Parkinsons sjukdom) samt vid alkoholdemens (Tabell II) [17].
Fosfo-tau (P-tau). Vid Alzheimers sjukdom kopplas en fosfatgrupp på ett antal aminosyror på tau-proteinet, dvs tau fosforyleras i olika grad. P-tau har sämre förmåga att binda till mikrotubuli i nervcellernas axoner, varvid axonerna får nedsatt stabilitet, vilket påverkar nervcellernas funktion. P-tau har även en tendens att aggregera till parade helikala filament (paired helical filaments, PHF), som sedan bildar de större proteinaggregat som bygger upp neurofibrillerna [18]. I den mest använda metoden för att mäta P-tau i likvor används en monoklonal antikropp (HT7) som reagerar med alla former av tau tillsammans med en antikropp (AT180) som specifikt reagerar med fosforylerat tau. Då AT180 är specifik för fosforyleringen på aminosyra 181 kallas analysen P-tau181. Ett flertal studier har visat att det finns en måttlig till kraftig ökning av P-tau i likvor vid alzheimer (Tabell II). Sensitiviteten för P-tau för att identifiera sjukdomen är hög; ca 80 procent av alzheimerfallen har ökat P-tau i likvor [13]. Ett viktigt fynd är att flera studier har funnit att specificiteten för P-tau är högre än för T-tau [17]. Normalt P-tau i likvor ses därför vid andra demenssjukdomar (frontotemporal, lewykropps- och vaskulär demens), olika neurologiska (Parkinsons sjukdom) och psykiska sjukdomar (depression, utbrändhet) [17].
Vid akut stroke ses en markant ökning av T-tau, och ökningen korrelerar med infarktens storlek. Däremot är nivån av P-tau helt normal efter stroke [14]. Detta är att förvänta, eftersom nivån av P-tau (i motsats till T-tau) i likvor inte avspeglar neuronal skada utan är kopplad till fosforyleringsgraden av tau och bildningen av neurofibriller. P-tau i likvor är också av värde för att skilja patienter med klassisk alzheimer från dem med blandformer av demens (alzheimer/vaskulär demens). En ökning av både T-tau och P-tau talar för alzheimer, medan en ökning av T-tau tillsammans med normalt P-tau talar för axonalt sönderfall av annan genes. Vid Creutzfeldt–Jakobs sjukdom ses väsentligen normala nivåer av P-tau i likvor tillsammans med mycket kraftigt ökad nivå av T-tau [19]. Vid diagnostik används kvoten T-tau/P-tau. Normalt ligger den på ca 5, så även vid alzheimer. Vid Creutzfeldt–Jakobs sjukdom ses däremot mycket höga nivåer på kvoten, ofta över 50. Vid misstanke om Creutzfeldt–Jakobs sjukdom används en beslutsgräns för kvoten på 25; ett värde däröver tillsammans med kraftigt förhöjt T-tau ger mycket starkt stöd för sjukdomen [20].
Beta-amyloid (A(beta)) är huvudkomponenten i senila plack (Figur 1) och bildas från ett större moderprotein, amyloidprekursorprotein (APP). Under metabolismen av APP klyvs A(beta) ut och utsöndras även till likvor. Nivån av A(beta) i likvor avspeglar därför metabolismen av APP och A(beta) i CNS och är kopplad till bildningen av senila plack [21]. Det finns ett flertal olika långa isoformer (varianter) av A(beta). Det bildas mest av en 40 aminosyror lång variant (A(beta)40), medan den två aminosyror längre isoformen (A(beta)42) är den som framför allt faller ut i senila plack. Med hjälp av olika monoklonala antikroppar kan man med ELISA-metodik specifikt mäta de olika isoformerna (A(beta)42 respektive A(beta)40) i likvor. Vid alzheimer är nivån av A(beta)42 i likvor sänkt till ca 50 procent av den hos åldersmatchade friska personer (Tabell II). Detta fynd har verifierats i över 25 studier inkluderande över 2000 fall [13]. Sensitiviteten för sänkt A(beta)42 i likvor för att identifiera alzheimer ligger på över 85 procent. Sänkta nivåer kan ses även vid lewykroppsdemens (Tabell II), en sjukdom där det liksom vid alzheimer bildas senila plack. Lätt sänkta nivåer kan också ses vid andra demenssjukdomar, tex frontotemporal demens (Tabell II). Normala nivåer ses vid normalt åldrande, psykiska sjukdomar som depression och utbrändhet och flera neurologiska sjukdomar (Tabell II).
För att standardisera nivån av A(beta)42 kan man räkna ut en kvot mot den isoform som finns i högst koncentration, A(beta)40. Denna kvot är sannolikt mindre känslig för olika faktorer som kan påverka likvornivån av A(beta)42. Flera studier har visat att kvoten A(beta)42/A(beta)40 är sänkt vid alzheimer och att den diagnostiska säkerheten är högre än för A(beta)42 som enda analys [22-24]. Bestämning av kvoten A(beta)42/A(beta)40 kan därför vara ett komplement i diagnostiken av alzheimer och i differentialdiagnostiken mot andra demenssjukdomar.
Neurofilament (NFL) är ett strukturellt protein som är kraftigt uttryckt i myeliniserade axoner subkortikalt [25] och i långbanor, som pyramidbanan [26]. Markören har sitt värde i att dels monitorera långbanesymtom, tex vid amyotrofisk lateralskleros (ALS) [27], dels tillsammans med T-tau ge ett mått på den neurodegenerativa processens utbredning i vit och grå substans. Uppvisar patienten främst ökning av NFL talar det för en övervägande subkortikal sjukdomsprocess, medan tau-övervikt talar för att det axonala sönderfallet framför allt sker i cortex cerebri [28-30]. Höga nivåer av NFL men förhållandevis normala av T-tau, P-tau och A(beta)42 är förenligt med subkortikal vaskulär demens (Tabell II). Man har även sett att NFL är värdefullt för att skilja ut atypiska parkinsonliknande sjukdomar, såsom kortikobasal degeneration, progressiv supranukleär paralys och multipel systematrofi, från ren parkinson. Ett högt NFL-värde i likvor tillsammans med ett dåligt levodopasvar talar emot renodlad parkinson och för något av de andra tillstånden [31, 32].
Likvoranalyser under utveckling
Ytterligare alzheimermarkörer i likvor som ännu inte nått klinisk rutin är (beta)-sekretasaktivitet och fragmentmönster av A(beta)-nedbrytningsprodukter, där signifikanta skillnader ses mellan alzheimerpatienter, kontrollpersoner och patienter med andra neurodegenerativa sjukdomar [33-35]. Det saknas i dagsläget specifika biomarkörer för andra demenssjukdomar än alzheimer. För de neurodegenerativa sjukdomar som hör till gruppen synukleinopatier (lewykroppsdemens, progressiv supranukleär paralys, kortikobasal degeneration mfl) har man länge hoppats att bestämning av (alfa)-synukleinnivåer i likvor skulle kunna vara diagnostiskt vägledande. De till dags dato publicerade metoderna med patientjämförelser visar dock på inga eller små och kliniskt oanvändbara sjukdomsassocierade förändringar [36, 37]. Fortsatt forskning pågår angående huruvida specifika fragment eller aggregationsformer av (alfa)-synuklein uppvisar bättre diagnostisk träffsäkerhet.
Vissa former av frontotemporal demens är associerade med inklusioner av ett protein vid namn TDP-43 (TAR-DNA-binding protein 43) [38]. Fragment av detta protein återfinns i likvor och i högre nivåer hos patienter med frontotemporal demens och ALS, men överlappningen mellan patienter och kontroller är stor [39]. Ett flertal biomarkörkandidater har vidare identifierats i olika explorativa proteomikstudier, men även här krävs verifieringsstudier i oberoende material och med oberoende tekniker innan slutsatser om markörernas kliniska betydelse kan dras [40].
Kombinerade likvoranalyser vid lindrig kognitiv störning
Ett flertal studier har visat att biomarkörerna T-tau, P-tau, A(beta)42 och A(beta)42/A(beta)40-kvoten är positiva redan vid lindrig kognitiv störning, som under kommande år kommer att progrediera kliniskt till Alzheimers sjukdom med utvecklad demens [22, 41-44]. Exempelvis fann man i en studie med upp till sex års uppföljning att man genom att kombinera T-tau, P-tau och A(beta)42 kunde identifiera 95 procent av fallen med incipient alzheimer och med över 85 procents specificitet skilja dessa från de fall som hade stabil lindrig kognitiv störning eller som progredierade till andra demenssjukdomar [41]. Detta visar att likvoranalyserna är positiva tidigt i förloppet vid alzheimer och värdefulla metoder i den kliniska diagnostiken av lindrig kognitiv störning. Bestämning av T-tau, P-tau och A(beta)42 i likvor fungerar i klinisk rutin [45] och kan sedan 2008 göras vid vårt laboratorium med SWEDAC-ackrediterade metoder.
Markörer i perifert blod – motstridiga resultat
Här tas inte upp allmänna kliniskt kemiska analyser i perifert blod, som Hb, tyreoideastatus och plasmahomocystein, vilka liksom likvorundersökning bör ingå i varje minnesutredning.
Det hade varit önskvärt med enkla blodtest för att identifiera och differentiera olika neurodegenerativa sjukdomar, men pålitliga sådana saknas dessvärre ännu. Störst fokus har forskare satt på plasmanivåer av A(beta), och ett stort antal studier har publicerats som visar att A(beta)40 och A(beta)42 går att mäta i plasma, men med mycket motstridiga resultat. För ett par år sedan rapporterade en forskargrupp att förhöjda nivåer av A(beta)40 i plasma från friska är en riskfaktor för framtida insjuknande i alzheimer [46]. En annan grupp rapporterade nyligen det motsatta resultatet [47]. En tredje grupp såg en riskökning för framtida alzheimer hos individer med höga plasmakoncentrationer av A(beta)42 [48], vilket motsäger data från två andra grupper [46, 49]. Vår grupp såg nyligen inga alzheimerassocierade skillnader i plasmanivåer av A(beta)40 och A(beta)42 [50]. Orsakerna till de motstridiga resultaten är ännu okända och mer forskning behövs. Det har nyligen även publicerats proteomikstudier där man letat efter alzheimerassocierade förändringar i plasmaproteomet med positiva resultat [51, 52], men även här väntar replikationsstudier på oberoende material.
Konklusion
Många vetenskapliga studier har visat att likvoranalyser är värdefulla i utredningen av patienter med kognitiva symtom och misstänkt alzheimer. Kombinationen av högt T-tau och P-tau tillsammans med lågt A(beta)42 kan med ca 85 procents säkerhet identifiera alzheimer och skilja sjukdomen inte bara från normalt åldrande utan också från flera viktiga differentialdiagnoser, såsom depression, utbrändhet och neurologiska sjukdomar. Likvoranalyser kan också med hög säkerhet identifiera incipient alzheimer hos patienter med lindrig kognitiv störning och används i stor omfattning i klinisk rutinsjukvård. Analysresulaten ska inte användas isolerat utan ses som ett led i utredningen och kombineras med resultaten från klinisk undersökning och övriga undersökningar som SPECT/PET och DT/MR.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.