Ikterus är ökat serumbilirubinvärde som följd av hemolys, nedsatt förmåga att konjugera bilirubin och kolestas.
Kolestas indicerar funktionellt (intrahepatiskt) eller mekaniskt (extrahepatiskt) nedsatt gallflöde.
Kronisk kolestas kännetecknar primär biliär cirros och primär skleroserande kolangit.
Akut kolestas ses vid sepsis, total parenteral nutrition, läkemedelsskada och i samband med graviditet.
Patienter med förhöjda levervärden är ofta opåverkade men kan naturligtvis vara allvarligt sjuka. Det gäller tex patienter med ikterus, dvs förhöjt bilirubin. En del patienter med förhöjda levervärden har dessutom förhöjda alkaliska fosfataser. Detta brukar kallas kolestas och kan indikera allvarlig leversjukdom. Vi beskriver ett antal metabola tillstånd som leder till ikterus och/eller kolestas. Tillstånden är komplexa, och de genetiska och molekylära störningarna har kartlagts det senaste decenniet. Vi har valt att inte ta upp de autoimmuna tillstånd som leder till kolestas.
Ikterus
Ikterus är ett tillstånd då bilirubin ansamlas och gör att hud, konjunktiva och andra slemhinnor antar en gulaktig färgton (Fakta 1). Ikterus ses när bilirubin överstiger ca 50 µmol/l.
Icke-leverorsakad ikterus. Ökad hemolys kan ses vid immunologiskt betingad blodsjukdom, sicklecellsanemi, talassemi eller nedbrytning av stora hematom. Laboratorieprov visar anemi, retikulocytos, förhöjt laktatdehydrogenas (LH) lågt haptoglobin, positivt Coombs test och övervikt av okonjugerat bilirubin (70–95 procent av totalt bilirubin; konjugerat bilirubin <5 µmol/l).
Okonjugerat bilirubin är också förhöjt vid Gilberts syndrom [1], som förekommer hos ca 5 procent av alla individer. Det är också det enda diagnostiska test (förutom att utesluta hemolys) som behöver göras hos uppenbarligen friska, mestadels unga, manliga individer, som ibland efter en stressituation (fasta, rökning, alkoholintag, tentamen) upptäcker ikterus. Vanligtvis är bilirubinnivån <80 µmol/l, men enstaka fall visar kontinuerligt värden upp till 300 µmol/l. Således ger nivåerna ingen säker hänvisning till andra men mycket sällsynta ärftliga varianter (Crigler–Najjars syndrom). Ytterst sällsynta ärftliga syndrom med konjugerad hyperbilirubinemi är Dubin–Johnsons och Rotors syndrom med mutationer i ABCC2-genen, som kodar för MRP2-proteinet (Fakta 2).
Intra- och posthepatisk ikterus. Vid dessa typer av ikterus är ultraljudsundersökning av lever och gallvägar det första steget i utredningen, som bör kompletteras med DT- eller MR-undersökning vid inkonklusivitet respektive med magnetisk resonanskolangiopankreatografi (MRCP) vid misstanke om skleroserande kolangit. Vid intrahepatisk ikterus visar laboratorieprov, utöver konjugerad hyperbilirubinemi, hepatit (förhöjda ALAT- och ASAT-värden) eller kolestas (alkaliskt fosfatas, ALP, glutamyltansferas, GT), ofta en blandad bild av båda former.Kolestas och kolestatiska leversjukdomar
Kolestas är försämring av gallbildning och/eller gallflöde, som kliniskt kan innebära trötthet, klåda och – i sin mest uppenbara form – ikterus. Kolestas anses vara kronisk om den varat mer än sex månader.
De flesta kroniska kolestassjukdomar är rent intrahepatiska, medan skleroserande kolangit kan påverka små och stora intra- och/eller extrahepatiska gallgångar. Asymtomatiska patienter med förhöjda serumvärden av ALP och/eller GT identifieras vanligen vid rutinmässig provtagning eller utredning för annan sjukdom. Isolerad förhöjning av serum-GT har liten specificitet för kolestas och kan orsakas av enzyminduktion av alkohol eller läkemedel. Å andra sidan ses isolerad förhöjning av serum-ALP vid vissa sällsynta leversjukdomar (t ex progressiv familjär intrahepatisk kolestas och gallsyrasyntesdefekter) samt vid ökning av icke-leverspecifika isoenzymer, t ex i puberteten, vid skelettsjukdom och graviditet [2].
De kliniskt viktigaste kolestatiska leversjukdomarna hos vuxna är primär biliär cirros, primär skleroserande kolangit, överlappningsformer mellan primär biliär cirros eller primär skleroserande kolangit och autoimmunhepatit, läkemedelsutlöst leverskada, kolestas utlöst av sepsis och/eller total parenteral nutrition samt intrahepatisk kolestas under graviditet. Primär biliär cirros [3], primär skleroserande kolangit [4, 5] och endera i kombination med autoimmun hepatit [6] beskrevs nyligen i Läkartidningen [3, 4].Patofysiologi
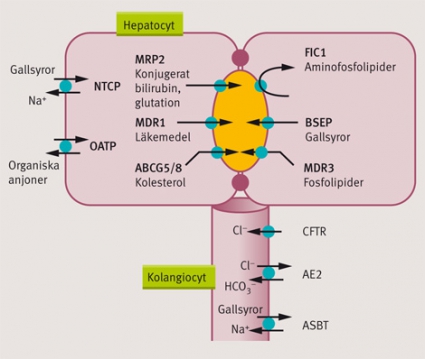
Olika membrantransportsystem längs det enterohepatiska kretsloppet i hepatocyter, gallgånsepitelceller (kolangiocyter) och enterocyter bidrar till normal produktion av galla. De viktigaste är ABC-transportproteinerna på kanalikulära (apikala) hepatocytmembranet som transporterar kolesterol (heterodimer ABCG5/8), fosfolipider (MDR3 eller ABCG4) och gallsyror (BSEP, bile salt export pump eller ABCB11), samt CFTR (cystic fibrosis transmembrane conductance regulator) och AE2 (chloride-bicarbonate anion exchanger isoform 2), som reglerar klorid- och bikarbonatinflödet från kolangiocyter. I både gallgångs- och tunntarmsepitel finns dessutom en transportör (ASBT) för gallsalter, som är beroende av natrium, samt NTCP, som tar upp största delen gallsalter från blod till lever, jämte olika organiska anjontransportörer (OATP) (Figur 1).Ovanliga metabola ärftliga kolestatiska leverjukdomar
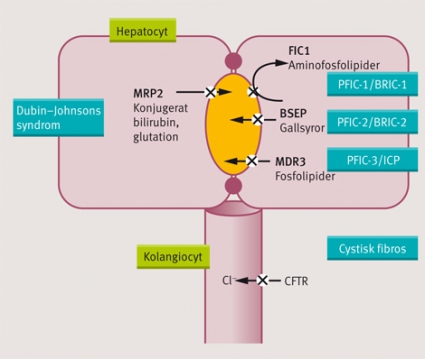
De senaste 15 åren har man upptäckt de molekylära förändringar som leder till metabola ärftliga kolestatiska leversjukdomar och hur transporten av ämnena sker över gallkanalikulärmembranet (Figur 2). Autosomalt recessiva ärftliga defekter i hepatobiliära ABC-transportörer har kopplats till ett brett spektrum av lever- och gallvägssjukdomar: från progressiv familjär intrahepatisk kolestas (PFIC) och benign återkommande intrahepatisk kolestas (BRIC) till graviditetsorsakad intrahepatisk kolestas (Figur 2).
De sällsynta (1–2/100 000) homozygota varianterna av FIC1 och BSEP orsakar progressiva kolestatiska syndrom hos nyfödda och barn (PFIC1, Bylers sjukdom, och PFIC2, Bylers syndrom; båda med låga serum-GT-värden). De mindre uttalade varianterna ger kolestatiska syndrom (BRIC1 och 2) i ungdomen eller vuxenlivet. PFIC ansvarar för 10–15 procent av alla kolestassjukdomar och levertransplantationer i barndomen. Förutom lever och öra (dövhet) drabbar PFIC pankreas, varför diarré och malabsorption kan förvärras efter levertransplantation. Vid PFIC2 finns ökad risk för kolangiocytär och hepatocellulär cancer. Därför är det viktig att följa patienten, även efter levertransplantation.
I motsats till PFIC1 och 2 visar PFIC3 förhöjda serumvärden av GT då den låga fosfolipidmängden i gallan inte räcker till för att bilda miceller med kolesterol och gallsyror. Detta gör att gallsyrorna skadar gallgångsepitelet. Heterozygota mutationer i MDR3 är associerade med återkommande intrahepatiska kolesterolgallstenar (som behandlas livslångt med ursodeoxicholsyra) och graviditetskolestas; vid graviditeskolestas har upp till 14 procent av kvinnorna olika MDR3-mutationer. Även BSEP-mutationer finns som är associerade med graviditetskolestas. Däremot är betydelsen av mutationer i BSEP eller MDR3 både för primär biliär cirros och för primär skleroserande kolangit oklar. Homozygota mutationer i MRP2 orsakar Dubin–Johnsons syndrom med bilirubinavlagringar i levern, medan homocygota CFTR-mutationer ger cystisk fibros med skador i lungor, lever och pankreas.Toxisk och inflammatorisk kolestas
Kolestas (förhöjt ALP, GT, konjugerat bilirubin) ses, förutom vid idiopatiska sjukdomar (graviditetskolestas, primär biliär cirros, primär skleroserande kolangit), vid toxiska (alkohol, läkemedel, anabola steroider, p-piller) och inflammatoriska (sepsisassocierad) tillstånd.
I djurexperiment med toxisk eller obstruktiv kolestas, men även i humana studier, har man kunnat visa hur levern försöker undvika eller minska skadorna av toxiska ämnen, främst gallsyror. Detta adaptiva svar förmedlas mestadels genom nukleära receptorer. Vid stigande nivå av intrahepatiska gallsyror gör FXR (farnesoid X-receptor), delvis via SHP (small heterodimer partner), en annan nukleär receptor, att gallsyrasyntesen från kolesterol och gallsyraupptaget från blod minskas, medan uttryck av kanalikulära (BSEP, MDR3, MRP2) och alternativa exportörer på basolateralsidan (MRP3/4, OSTα/β) induceras, vilket således leder till att gallsyror minskar intracellulärt. Dessutom induceras avgiftningsmekanismer, såsom hydroxylering (CYP-enzymer) och sulfat- eller glukuronidkonjugering (SULT- eller UGT-enzymer).Läkemedelsutlöst leverskada
Kolestas med symtom – ikterus, aptitlöshet/illamående, klåda – men inga tecken på gallvägspåverkan vid röntgenologisk undersökning kan bero på läkemedel [7, 8] och föranleder patienten att söka akut, vanligen 1–3 veckor efter introduktionen av ett nytt läkemedel. Tiden från insättning av läkemedel till symtom kan dock vara så lång som tre månader, i enstaka fall upp till ett år. Leverproven kan uppvisa ett hepatocellulärt, kolestatiskt eller blandat skademönster. Kolestatiska skador tenderar att ha ett mer långdraget förlopp, och det finns fall där bilirubinnivån normaliserats först efter två års uppföljning. Hepatocellulära skador, med bilirubinökning på grund av nekroser, inte på grund av stas, innebär risk för leversvikt och har därmed dålig prognos. Undantaget är paracetamolskador, där effektiv antidot finns.Antalet fall av läkemedelsutlöst leverskada är 1–10/10 000 invånare per år, men förmodligen finns det en betydande underrapportering. I slutenvården upptäcks många asymtomatiska fall. Vuxna är känsligare än barn, och kvinnor är oftare drabbade än män.
Leverreaktionerna delas in i idiosynkratiska, oförutsägbara och dosberoende (t ex paracetamol och metotrexat), men det är också viktigt att särskilja vanliga läkemedelsbiverkningar, som inte alltid måste innebära utsättning av läkemedlet i fråga. Antibiotika och NSAID är de läkemedel som oftast rapporteras som orsak till idiosynkratisk leverskada. Diagnosen är ibland svår att ställa och är ofta en uteslutningsdiagnos. Tidssamband, reaktion som stämmer med misstänkt läkemedel och förväntad reaktion efter utsättning bör kunna vägleda. I vissa fall bör differentialdiagnostisk utredning göras. Leverbiopsi kan vara till hjälp och bör övervägas, framför allt när det gäller nyregistrerade läkemedel. Specifik behandling finns inte, utan symtomatisk behandling med klådstillande medel ges.Sepsis och total parenteral nutrition som orsak till kolestas
Kolestas är en vanlig komplikation vid extrahepatisk bakteriell infektion och sepsis och den vanligaste orsaken till ikterus hos inlagda patienter efter malign gallvägsobstruktion. Den totala incidensen är 40 procent bland kritiskt sjuka [9]. Kliniskt ses sepsisassocierad leverskada med uppkomst av ikterus 2–7 dagar efter att bakteriemin uppkommit, i varierande utsträckning beroende på infektionens svårighetsgrad. Viktiga patogenetiska faktorer är proinflammatoriska cytokiner och kväveoxid, som orsakar gallstas genom att försämra den hepatocellulära och duktala gallbildningen, vilket ses som konjugerad hyperbilirubinemi och blygsamt förhöjda ALP- och transaminasvärden.
Ischemisk leverskada och i sällsynta fall progressiv skleroserande kolangit kan också ses hos patienter med septisk chock eller större trauma med SIRS (systemiskt inflammatoriskt svarssyndrom). Andra viktiga differentialdiagnoser hos kritiskt sjuka patienter med ikterus är ischemisk hepatit med snabbt insättande ikterus (<24 timmar), läkemedelsinducerad leverskada (latens: dagar till flera veckor), total parenteral nutrition (>3 veckor till månader), akalkulös kolecystit och hepatisk abscess.
Det enda effektiva vid sepsisassocierad kolestas är att behandla den underliggande infektionen. Primärt infektionsfokus finns oftast intraabdominellt, men andra infektionstyper (urinvägsinfektion, lunginflammation, endokardit, meningit) kan vara orsakande och måste uteslutas. Antibiotikabehandling med karbapenemer, tredje eller fjärde generationens cefalosporiner och bredspektrumkarboxi- eller ureidopenicilliner i kombination med β-laktamashämmare bör påbörjas så snart sepsis misstänks och lämpliga odlingar tagits.
Antibiotika som utsöndras i gallan (t ex ceftriaxon och mezlocillin) bör undvikas eller användas i reducerad dos. Låg dos kortikosteroider har visats signifikant minska dödligheten och behandlingstiden med vasopressorer hos patienter med septisk chock. Ursodeoxicholsyra eller extrakorporealt leverstöd som behandling vid sepsisassocierad kolestas utreds för närvarande och kan ännu inte rekommenderas. Levertransplantation bör övervägas för patienter med progressiv skleroserande kolangit.
Kolestas inducerad av total parenteral nutrition hos icke-septiska patienter är ovanligt, men vanligare hos barn än hos vuxna. Ibland kan tillståndet leda till fibros, cirros och leversvikt. De patogenetiska faktorerna kan vara relaterade till konsekvenserna av bristen på fysiologiskt enteralt intag (ingen kolecystokininutsöndring, intestinal stas och enterocythypoplasi gynnar bakteriell translokation), till toxiciteten i TPN-komponenterna (kaloriöverskott med glukos- och lipidöverbelastning, specifik toxicitet hos aluminium, koppar och mangan) eller till den underliggande sjukdomen.
För att förebygga kolestas inducerad av total parenteral nutrition ges kalorier mindre än 25 kcal/kg/d, medellånga och långa triglycerider med essentiella fettsyror i en totalmängd lipider som inte överstiger 1 g/kg/d och/eller fett–glukoskalorier i förhållandet högst 40:60. Ett cykliskt schema för total parenteral nutrition med avbrott under 5–8 timmar rekommenderas och i synnerhet att börja tidigt och upprätthålla oral eller enteral nutrition när det är möjligt. Metronidazol kan ha en roll vid behandling av kolestas inducerad av total parenteral nutrition. Taurintillskott i lösningar för total parenteral nutrition samt peroral ursodeoxicholsyra har prövats men inte utvärderats i randomiserade, kontrollerade studier.
Intrahepatisk kolestas under graviditet
Graviditetskolestas (»hepatos« inom obstetriken) [10, 11] är den vanligaste leversjukdomen under graviditet och karakteriseras av intensiv klåda, som debuterar under andra eller tredje trimestern, förhöjda värden av S-gallsyror (>10 µmol/l) och/eller S-ALAT samt ett kliniskt förlopp med restitution inom 4–6 veckor efter partus. Om kliniska fynd kvarstår måste annan leversjukdom övervägas, framför allt primär skleroserande kolangit.
I Sverige diagnostiseras intrahepatisk kolestas hos 0,5 procent av alla gravida. En stor prospektiv studie i Västra Götaland visade dock att 1,5 procent av kvinnor drabbas av tillståndet. Hos <10 procent ses ikterus, men S-bilirubin överstiger mycket sällan 85 µmol/l. ALP-stegringen torde hos flertalet härstamma från placenta. De flesta patienter har normalt S-GT. Genetiska faktorer (varianter i ABCB4, som kodar för fosfolipidtransportproteinet MDR3), hormonella faktorer (ökade östrogen- och progesteronnivåer) och miljöfaktorer (låga vitamin D-nivåer) anses kunna bidra till uppkomst av intrahepatisk kolestas.
Klådan är besvärande men ofarlig för mamman. Däremot anses risken för fetala komplikationer vara ökad, varför kvinnorna remitteras till specialistmödrarvård. Behandlingen utgörs av ursodeoxicholsyra (10–20 mg/kg/dygn), som lindrar klådan och och förbättrar levervärdena vid höga initiala gallsyranivåer (>40 µmol/l). Rifampicin kan ges i svårbehandlade fall. Hos en stor del av patienterna induceras förlossning efter vecka 37 för att undvika fetala komplikationer. Risken för intrauterin fosterdöd är med dagens aktiva obstetriska behandling inte högre än vid en normal förlossning.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.