Sammanfattat
Funktionell MR (fMRI) kartlägger neuronaktivitet genom mätning av signalförändringen som uppträder när någon utför en uppgift i MR-kameran omväxlande med vila.
fMRI kräver avancerad bildbehandling, där aktiviteten bedöms vara signifikant om signalskillnaden mellan aktivitet och vila överstiger en vald tröskel.
I kliniken används metoden i första hand för att lokalisera funktioner som rörelse, känsel, språk, hörsel och syn inför neurokirurgiska ingrepp hos patienter med hjärntumör eller epilepsi.
För att föra in fMRI i klinisk verksamhet behövs samarbete mellan radiolog, neuropsykolog, MR-fysiker och remittent.
År 1890 presenterade Roy och Sherrington sin idé om att hjärnans regionala blodflöde varierar med neuronaktiviteten för att kunna tillföra vävnaden glukos och syre [1]. Blodflödesökningen visade sig vara betydligt större än den lokala omsättningen av syre [2], vilket öppnade vägen för en ny parameter. År 1990 beskrevs en MR-teknik för att mäta förändringar i vävnadens syrehalt i samband med neuronaktivitet, den sk blood oxygenation level-dependent (BOLD)-effekten [3]. Funktionell MR (functional magnetic resonance imaging, fMRI) är icke-invasiv och utförs i kliniken med MR-kamera med en fältstyrka på 1,5 eller 3 T. fMRI baserad på BOLD-effekten vann snabbt popularitet inom psykologin för kartläggning av den friska hjärnans funktioner, och det mesta av den vetenskapliga produktionen finns inom detta område [4].
Det första arbetet om fMRI i kliniken beskrev preoperativ kartläggning med motorstimulering hos två patienter med hjärntumör nära sulcus centralis, och en jämförelse med elektrofysiologiska tekniker gjordes [5]. Under andra hälften av 1990-talet publicerades ett flertal jämförelser av fMRI och den etablerade, invasiva referensmetoden peroperativ kortikal stimulering (PKS) i större patientmaterial; överensstämmelsen varierade mellan 83 procent [6] och 92 procent [7] för motorstimulering och uppgick till 81 procent vid språkstimulering [8]. Om fMRI används på ett standardiserat sätt kan metoden ge betydande bidrag till preoperativ utredning av patienter med hjärntumör eller epilepsi och leda till minskat behov av invasiv utredning [9].
BOLD-effekten och faktorer som påverkar den
Neuronaktivitet leder till ökning av synapsaktiviteten och därmed också av glukos- och syrekonsumtionen. Efter ca 3 sekunder framträder den hemodynamiska responsen i form av kraftigt ökat blodflöde och blodvolym. I vilotillstånd transporteras det mesta av syret till hjärnan bundet till järn i form av oxygenerat hemoglobin (oxi-Hb). När däremot blodflödesökningen överstiger syreextraktionen ökar andelen oxi-Hb, och andelen deoxi-Hb minskar. Deoxi-Hb med sina fyra fria elektroner påverkar magnetfältet lokalt [10], och en sänkning av mängden deoxi-Hb kan påvisas i form av en lokal signalökning (typiskt 1–5 procent) vid användning av lämplig MR-sekvens. Ändrade fysiologiska förutsättningar, som hyperkapni, hypoxi, hypertoni och anemi, kan påverka kopplingen mellan neuronaktivitet och hemodynamisk respons. Ämnen som koffein kan öka BOLD-effekten, medan alkohol kan minska den. Tumörväxt, främst av gliala tumörer som ger upphov till neoangiogenes, störningar i autoregleringen och blod–hjärnbarriären samt kompression av intilliggande kärl, har i ett flertal studier visat sig sänka BOLD-effekten. Arteriovenösa missbildningar kan ge upphov till utbrett sk steal-fenomen, blodflödesförändringar, autoreglering mm och därmed omöjliggöra normal hemodynamisk respons [11].
Utrustning och bildhantering
För att genomföra ett fMRI-experiment med tex motorisk aktivering behövs ingen extra utrustning. För paradigm där patienten behöver få instruktioner visuellt eller stimuli i form av bilder är det vanligt att använda en projektor eller speciella glasögon. Utrustningen ansluts till en dator utanför MR-rummet med mjukvara för att presentera stimuli. Datorn ansluts till MR-kameran för att synkronisera bildtagningen med stimulipresentationen. Vid fMRI-undersökning produceras stora datamängder i ett annat filformat än det som analysprogrammen kräver. I Lund har detta lösts med en fristående server som kan ta emot bilder från MR-kameran. Kliniska fMRI-undersökningar utvärderas med hjälp av ett automatiserat analysverktyg som hanteras av MR-sjuksköterskorna. Resultaten skickas vidare till PACS (picture archiving and communication system) för granskning och visning och till det stereotaktiska operationssystemet.
Undersökningen i praktiken
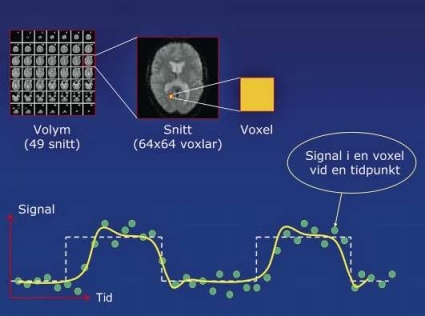
Paradigmet beskriver de uppgifter patienten utför vid fMRI-undersökningen. BOLD-effekten kan inte absolutkvantifieras, eftersom MR-signalen mäts i arbiträra enheter, varför skillnader i MR-signalen mäts vid åtminstone två olika tillstånd: någon form av aktivitet och vila. För att undvika habitueringseffekter är kliniska paradigm ofta uppbyggda i block, där uppgiften utförs under 20–30 sekunder, följt av 20–30 sekunders vila osv. Om perioder om 30 sekunder väljs och repetitionstiden (TR) är 3 sekunder tas tio bildvolymer per block. Tillräckligt underlag för statistisk analys kan erhållas om paradigmet omfattar totalt 3–5 aktiveringsblock och 4–5 viloblock. Den totala undersökningstiden är 3,5–5,5 minuter.
Rörelsestimulering möjliggör exempelvis kartläggning av handens, fotens och tungans representation i primära motorkortex. Oftast används enkla rörelser, tex rytmisk opposition av andra, tredje, fjärde och femte fingret mot tummen (»finger tapping«), flexion av stortån eller uppåt- och nedåtgående rörelser av tungan med stängd mun, där patienten själv bestämmer takten. I de fall då patienten inte kan röra på enstaka fingrar kan rörelsen bestå i att knyta och öppna handen, alternativt kan detta utföras av en annan person. Vilouppgiften är att ligga helt stilla.
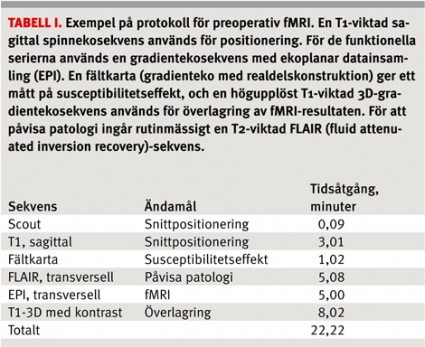
Sensorisk stimulering av handen och foten kan utföras genom att en assistent tex borstar en vald kroppsdel. Språkstimulering innebär oftast ordgenerering, ofta i form av att rimma, t ex på »kock«, eller i form av allitteration, då ord bildas som börjar på given bokstav, tex »k«. För att undvika rörelseartefakter ska orden inte sägas högt, och prestationen kan därmed inte kontrolleras. Vilouppgiften utgörs av att se på ett kryss. För stimulering av visuella kortex kan patienten titta på ett schackrutemönster omväxlande med att vila, och för auditiv stimulering används lyssnande på musik. För att maximera patientens förmåga att utföra uppgiften och följa paradigmets tidsschema läggs stor vikt vid instruktion och övning såväl utanför som inne i MR-kameran. Sekvenserna som ingår i protokollet för preoperativ fMRI på neuroröntgen i Lund redovisas i Tabell I och parametrarna för den funktionella EPI-sekvensen och paradigmet i Fakta 1.
Dataanalys
Figur 1 visar ett blockdesignexperiment, där resultatet är en karta över hjärnan med ett t-värde för varje voxel. Kartan trösklas så att bara de voxlar med vald skillnad mellan vila och aktivering visas. Dessa tilldelas en färgkod och överlagras på en anatomisk bild, vanligen en högupplöst anatomisk sekvens (Tabell I). Dessutom kan tillgång till bildserier med överlagringar på den ursprungliga sekvensen av ekoplanar datainsamling (EPI) rekommenderas, eftersom den anatomiska sekvensen inte är känslig för samma artefakter och därmed kan vara missvisande. Då signalförändringarna orsakade av BOLD-effekten är små kan de överröstas av sådana som orsakar av huvudrörelse, pulsationer till följd av andning och hjärtslag eller variationer i MR-kamerans stabilitet. Därför utförs ett antal förbehandlingssteg före den statistiska analysen. En mer utförlig beskrivning av dessa steg samt typiska val av parametrar finns tex i manualen till SPM (statistical parametric mapping) http://www.fil.ion.ucl.ac.uk/spm/.
Lokalisering av funktioner inför operation
Den främsta indikationen för klinisk fMRI är kartläggning av motorik, sensorik och språk inför operation hos patienter med hjärntumör eller epilepsi. Målet är 1) att kartlägga anatomin, som kan vara förändrad sekundärt till lesionen, 2) att bedöma risken för postoperativt deficit, dvs fastställa avståndet mellan funktionellt område och lesion, samt 3) att vara behjälplig med att planera ingreppet genom att kartlägga samtliga intill lesionen belägna funktioner.
I ett patientmaterial med tumörer i anslutning till sulcus centralis bidrog fMRI hos 55 procent till att bedöma operabiliteten, hos 22 procent till att planera resektionen och hos 78 procent till att avgöra behovet av peroperativ kortikal stimulering [13]. I nuläget är fMRI tillgänglig på alla universitetssjukhus, och det relativt låga antalet undersökta patienter per år och nödvändigheten av att förevisa och diskutera resultaten med neurokirurg på plats indikerar att undersökningen bör centraliseras.
Eftersom undersökningens resultat, dvs aktiverade voxlar, är helt beroende av tröskeln kan funktionens lokal inte avgöras exakt. Upprepad fMRI är inte till hjälp, eftersom aktivitetens utbredning har begränsad reproducerbarhet, även om samma system framträder vid upprepning av paradigmet [14]. Avståndet mellan lesion och funktionellt område påverkas således i hög grad av tröskeln för signifikant aktivitet. På vårt sjukhus anges därför avståndet i steg om 0,5 cm, från 0 till 2 cm, då ett avstånd över 2 cm har visat sig innebära att risken för postoperativt deficit är mycket liten [15, 16]. Neurokirurgisk praxis i Lund är att resektionen bedöms kunna utföras utan risk för deficit om lesionen och funktionen skiljs åt av en sulcus.
Ibland saknas aktivitet på de lokaler där sådan kan förväntas, vilket inte kan likställas med att området kan resekeras, eftersom BOLD-effekten kan saknas alternativt vara inverterad. Aktiviteten är dessutom ospecifik, dvs det går inte att bedöma om de aktiverade områden är nödvändiga för en funktion. Det är av stor vikt att föra fram dessa förbehåll för att inte invagga neurokirurgen i falsk säkerhet, därför utförs vid en del centra kompletterande undersökning med PET eller transkraniell magnetstimulering (TMS) [17].
Trots alla förbehåll, fallgropar och svårigheter har fMRI potential att icke-invasivt bidra med viktig klinisk information, som inte kan fås med någon annan metod. Kunskap om en funktions läge möjliggör att funktionen kan sparas och, tex hos patienter med låggradiga tumörer och lång förväntad överlevnadstid, utvidgad resektion. fMRI kan också bidra till att reducera antalet invasiva ingrepp, tex Wada-test, där barbiturat injiceras i hjärnans artärer för att bedöma språk- och minnesdominans.
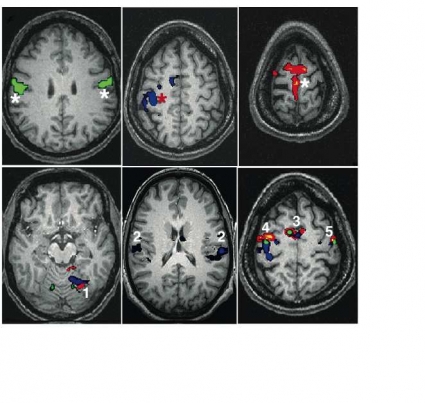
Kartläggning av motorik och sensorik. Motorisk och sensorisk stimulering är robusta uppgifter som aktiverar ett system av kända noder med neuroanatomiskt välkänd lokal. Vid motorstimulering, enligt ovan, sker även viss sensorisk stimulering. Förutom handens, fotens och tungans representation i kontralaterala primära motorkortex i gyrus precentralis aktiveras motorkortex ipsilateralt, sensoriska barken kontra- och ipsilateralt, supplementära motorarean (SMA), cerebellum ipsilateralt och premotorarean bilateralt (Figur 2 och 3). Vid bedömning av aktiveringskartorna kontrolleras först om dessa områden har aktiverats, som ett kvitto på att patienten har utfört uppgiften. Det är dock enbart skador på primära motoriska barken som ger upphov till bortfall [18], och bedömning av aktiveringskartorna syftar därför till att lokalisera den undersökta kroppsdelens representation i primära motoriska barken. Handens representation utgörs av en utbuktning på gyrus precentralis som lätt kan kännas igen [19], fotens är belägen medialt och kranialt därom och tungans kaudalt om handens vid botten på sulcus centralis.
Motorisk stimulering ger något starkare BOLD-effekt än sensorisk stimulering, medan sensorisk stimulering inte är beroende av att patienten följer någon uppgift. Det kan därför vara av värde att utföra båda typerna av stimulering [20]. Sensorisk stimulering kan dessutom ersätta motorisk sådan hos paretiska patienter. Sensorisk stimulering aktiverar den stimulerade kroppsdelens representation i kontralaterala primära sensoriska kortex i gyrus postcentralis, sensoriska kortex ipsilateralt, motoriska barken kontra- och ipsilateralt, sekundära sensoriska barken vid botten av sulcus centralis bilateralt, SMA och cerebellum ipsilateralt. Kunskap om det normala aktiveringsmönstret är av stor vikt för att kunna lokalisera funktionerna hos patienter där de anatomiska förhållandena kan vara kraftigt förändrade.
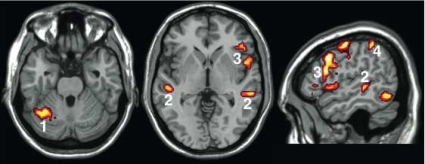
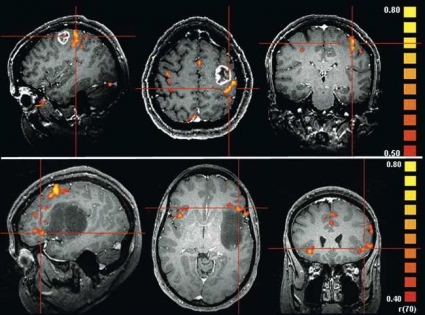
Figur 4 visar en aktiveringskarta med bilder i sagittal, transversell och koronar projektion från motorstimulering av höger hand hos en patient med tumör på vänster sida belägen i anslutning till sulcus centralis. Aktiviteten finns i gyrus precentralis posteriort om tumören på ett avstånd av 5 mm; användning av lägre tröskel hade inneburit ett kortare avstånd. Patienten genomgick total resektion (PAD: höggradigt gliom) och fick i efterförloppet övergående pares i höger hand. Kontroll-fMRI två månader senare visade normalt aktiveringsmönster.
Kartläggning av språkområden. Språk är en komplex funktion som inkluderar ordförståelse, semantiska associationer, planering av artikulatiuon, akustisk och visuell bearbetning av språklig information, och något enskilt paradigm som identifierar »språkkortex« finns därför inte. Aktiveringsmönstret varierar med paradigmet, vilket försvårar jämförelser av resultat [21]. Ordgenerering (bilda ord som börjar på viss bokstav), som används i Lund, aktiverar Brocas och Wernickes areor och deras högersidiga homologer. Dessutom aktiveras områden i gyrus angularis, gyrus frontalis medius, främre gyrus cinguli och cerebellum, där aktiviteten i gyrus frontalis medius och främre gyrus cinguli relateras till stimulering av arbetsminne och koncentration.
Resultat från fMRI-studier på friska har bidragit till att den klassiska modellen för språkfunktion, med Wernickes area som impressiv del och Brocas area som expressiv del, har fått revideras såtillvida att expressiva språkområden finns motsvarande Brocas area och temporalt motsvarande Wernickes area. Man ser också skillnader i aktivitetsmönster mellan patienter, bla på grund av anatomiska varianter och fMRI-svarets variabilitet. Brocas area är anatomiskt väldefinierad, medan prekortikal stimulering har påvisat flera, upp till några kvadratcentimeter stora, öar som svarat på stimulering inom ett område som var betydligt större än den klassiska Wernickes area [22]. Ofta tolkas aktivitet motsvarande gyrus temporalis superior höra samman med Wernickes area (Figur 3). Bedömning av aktiveringskartor syftar till att lokalisera Brocas och Wernickes areor samt bedöma var språkdominansen finns.
För lokalisering av språkområden gäller i synnerhet att bedömningen försvåras av att aktiviteten är ospecifik, dvs alla områden som »lyser upp« på aktiveringskartan är inte nödvändigtvis relaterade till ordgenerering, samtidigt som försiktighet måste påbjudas för att inte skada patienten. Figur 3 är en aktiveringskarta med bilder i sagittal, transversell och koronar projektion från språkstimulering (ordgenerering) hos en patient med låggradigt astrogliom frontalt på vänster sida. Aktiviteten finns i Brocas area i gyrus frontalis inferior direkt anteriort om tumören (avstånd: 0 mm). Patienten genomgick partiell resektion av tumörens posteriora parti i syfte att minska tumörutlöst epilepsi; inget bortfall noteras postoperativt. Kontroll-fMRI två månader senare visade normalt aktiveringsmönster.
Bedömning av språkdominans. Uppgift om vilken hemisfär som är dominant för språk behöver inhämtas inför operation för terapiresistent epilepsi med resektion av mediala temporalloben. Aktiveringskartor från ordgenering kan användas som underlag för bedömning av språkdominans, och resultaten har visat sig jämförbara med dem vid Wada-test [23]. Sistnämnda innebär att ett kortverkande narkosmedel injiceras i höger och sedan vänster a carotis interna via angiografikateter, varefter språk- och minnesfunktionen kan lokaliseras. Svaret på undersökningen blir antingen »typisk dominans«, dvs vänster hemisfär är språkdominant, eller »atypisk dominans«, dvs högersidig dominans eller kodominans.
Språkdominans kan bedömas visuellt (på vilken sida finns mest aktivitet) och beräknas med en formel för lateralitetsindex (LI): LI = (L – R)/(L + R), där L och R är antalet aktiverade voxlar i höger respektive vänster hemisfär. LI har ett värde mellan –1 och 1, där intervallet –1 till –0,2 indikerar högersidig dominans, 0,2 till +1 vänstersidig dominans och –0,2 till 0,2 kodominans.
Fördelen med att beräkna LI är att ett objektivt mått på språkdominans erhålls. Nackdelen, som manar till försiktighet, är att LI varierar med paradigmet, eftersom olika språkparadigm kommer att ge något olika aktiveringskartor. LI varierar också med det område som valts till grund för beräkningen: exempelvis kan aktiverade voxlar i båda hemisfärerna inkluderas eller enbart de i Brocas area. LI är dessutom starkt beroende av tröskeln: När tröskeln sänks och närmar sig brusnivå kommer fler voxlar att överleva i den icke-dominanta hemisfären, och LI närmar sig då kodominans. Förhoppningen är att det invasiva Wada-testet ska kunna ersättas med fMRI. I så fall krävs att även det verbala minnet kan undersökas med fMRI. Detta är ett aktivt forskningsområde för närvarande.
Lokalisering av andra funktioner. Svåra smärttillstånd, som trigeminusneuralgi, kan behandlas med en elektrod som stimulerar den afficierade kroppsdelens representation i motorkortex. Inför ingreppet kan fMRI vara till hjälp för lokalisering av denna. Vid hörselnedsättning på grund av tex en medfödd missbildning i innerörat kan det vara av värde att utföra fMRI för att se om hörselkortex finns och fungerar. fMRI kan också vara till nytta vid planering av strålbehandling när man vill undvika strålning av primära funktionella områden.
Lokalisering av epileptiskt fokus. fMRI och EEG kan utföras samtidigt i MR-kameran vid frekvent epileptiform aktivitet, där mellanliggande tid räknas som vila. Metoden kräver stora tekniska insatser för att få EEG-apparaturen att fungera i kameran utan att störa den.
Klinisk fMRI – nutid och framtid
Etablerad klinisk fMRI-verksamhet finns nu i Göteborg, Linköping, Stockholm och Lund. fMRI är fortfarande under utveckling, och under de närmaste åren kan utvecklingen komma att omfatta anpassning av dataanalys till kliniska applikationer, kvalitetssäkring, optimering av MR-parametrar samt kombination av fMRI med andra tekniker, såsom diffusion tensor imaging (DTI). För att kunna jämföra resultat från olika sjukhus krävs standardisering av paradigm och bedömning. Även uppföljning av patienter, med fokus på större kontrollerade studier, krävs för att påvisa om användningen av fMRI vid preoperativ utredning minskar postoperativ morbiditet och mortalitet.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.