Sammanfattat
Magnetresonansspektroskopi (MRS) tillåter, som komplement till bildgivande och funktionella MR-metoder, kemisk analys av vävnader in vivo.
Förändringar i metaboliternas koncentrationer återspeglar patofysiologiska processer i hjärnvävnaden, tex neuronundergång eller neurondysfunktion (minskning av neuronmarkören N-acetylaspartat), proliferation eller nedbrytning av cellmembran och myelin (ökning eller minskning av kolin och myoinositol) eller ackumulation av laktat i samband med anaerob glukolys.
I klinisk rutin används MRS främst inom differentialdiagnostiken (mellan tex hjärnabscesser, primära och sekundära hjärntumörer eller mellan olika metabola sjukdomar) och för kartläggning av sjukdomsutbredning inom hjärnan (vid tex encefaliter eller epilepsi).
Magnetresonansspektroskopi (MRS) har använts som analytisk metod av kemister och fysiker sedan introduktionen av NMR-tekniken under 1940-talet. Nästan parallellt med intåget av den bildgivande MR-tekniken i den kliniska verksamheten under 1980-talet utvecklades MRS-tekniker, som utöver de sedan tidigare möjliga kemiska in vitro-analyserna av kroppens vävnader tillät in vivo-undersökningar. Förväntningarna på klinisk MRS var stora under teknikens barnaår, men trots att den tekniska utvecklingen av MRS har hållit jämna steg med de övriga bildgivande MR-metoderna har en bred klinisk användning av MRS-tekniken uteblivit.
MRS tillåter, som komplement till bildgivande och funktionella MR-metoder, kemisk analys av vävnader in vivo. MRS-undersökningar utförs med en vanlig klinisk magnetkamera utrustad med en mjukvara som tillåter insamling och utvärdering av MRS-data.
Det område eller de områden som ska analyseras definieras under MRS-undersökningen. I vanliga fall samlas data in från ett eller flera cirka 222 cm stora volymer (single volume MRS) alternativt från ett större område, som i sin tur delas in i mindre volymer (multivoxel-MRS, chemical shift imaging eller MRS imaging).
Undersökningstiden varierar beroende på frågeställning och antal undersökta områden, men vanligen krävs 15 till 30 minuter. Därtill kommer utvärderingstiden, som även denna är beroende av frågeställning, undersökningsprotokoll, utvärderingsverktyg och vana.
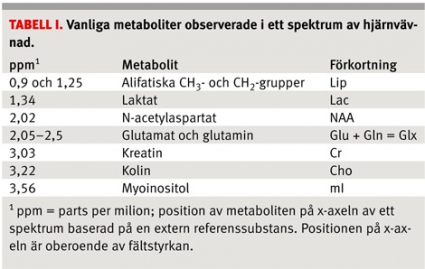
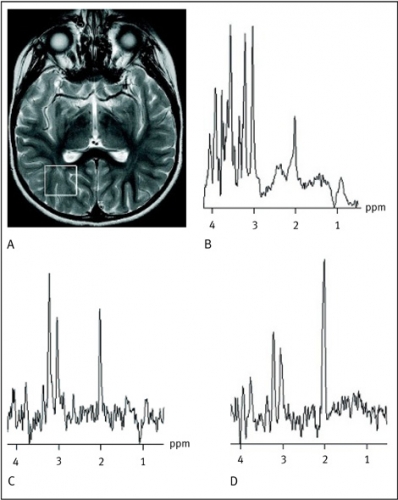
Resultaten av undersökningen presenteras i ett MR-spektrum (Figur 1), och dess utseende varierar något beroende på undersökningsparametrar, undersökningsområdet, patientens ålder och patologin.
På grund av att antalet undersökningsparametrar är stort är det svårt att erhålla robusta kvantitativa data, varför metaboliternas koncentrationer ofta anges som kvoter mellan olika metaboliter eller som arbiträr enhet. Kvantitativa data kan erhållas om standardiserade undersökningstekniker tillsammans med speciella utvärderingsverktyg såsom jMRUI [1] eller LCModel [2] används.
Sensitiviteten hos en MR-kamera med en fältstyrka på 1,5 tesla är cirka 0,1 mmol/l, och enbart molekyler som är »MR-synliga« omfattas av undersökningen.
MRS kan utföras på de flesta av kroppens vävnader, men det huvudsakliga kliniska användningsområdet är undersökning av hjärnvävnad. Metaboliter relevanta för analysen av hjärnvävnad sammanfattas i Tabell I och beskrivs närmare i Fakta [3]. Bedömningen av ett MR-spektrum utgår från dels variationer i kemiska koncentrationer, som förändrar arean under topparna för den specifika metaboliten, dels förekomst av i ett normalt spektrum inte synliga patologiska metaboliter (tex laktat, acetat, alanin) eller exogena substanser (tex mannitol eller propandiol).
MRS har blivit en robust teknik när det gäller reproducerbarhet och användarvänlighet. Detta har medfört att intresset för MRS i klinisk verksamhet har ökat, och tröskeln för användningen av metoden har sjunkit. Tyvärr är artefakter i MRS inte lika iögonfallande som vid MRI, och även om fallgroparna är minst lika vanliga, är de ofta inte lika kända [4].
Detta medför problem för oerfarna radiologer när det gäller tolkning av resultaten och extern granskning av undersökningar där undersökningsprotokoll och grunddata saknas eller där enbart delar av tex multivoxelundersökningar är tillgängliga.
Kliniska användningsområden
MRS ska ses som ett komplement till andra bildgivande eller funktionella undersökningsmetoder, och undersökningen ska vara inriktad på en specifik frågeställning. Förändringar i metaboliternas koncentrationer (som är proportionella till arean under topparna i spektrumet) återspeglar patofysiologiska processer i hjärnvävnaden, tex neuronundergång eller neurondysfunktion (minskning av N-acetylaspartat), cellproliferation eller celldöd (bla ökning eller minskning av kolin), ackumulation av laktat i samband med anaerob glukolys etc.
Eftersom många sjukdomar kan leda till liknande patofysiologiska processer, finns en stor överlappning mellan metaboliternas reaktionsmönster och olika patologiska tillstånd. Därför krävs att MR-spektrum analyseras mot bakgrund av klinisk, funktionell och anatomisk/morfologisk information.
MRS har sina största användningsområden inom differentialdiagnostiken (av tex hjärntumörer mot abscesser eller olika metabola sjukdomar), inom kartläggningen av sjukdomsutbredningen i hjärnans olika delar (tex vid encefalit, metabola sjukdomar och vitsubstanssjukdomar) och inom fastställandet av prognostiska kriterier (efter tex drunkningstillbud, hypoxi eller inför operation vid tex terapiresistent epilepsi).
Nedan illustreras några kliniska problem där MRS kan användas som länk i den diagnostiska kedjan.
Abscesser och tumörer
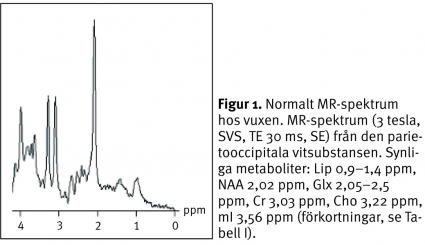
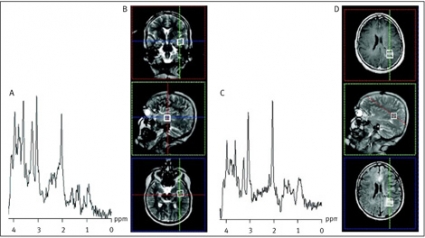
Avkapslade bakteriella hjärnabscesser kan differentialdiagnostiskt vara svåra att skilja från cystiska eller nekrotiska primära hjärntumörer eller metastaser såväl som från opportunistiska eller parasitära infektioner. MR-spektrumet av den cystiska komponenten i en pyogen abscess återspeglar bakteriernas metabola aktivitet och har ett karakteristiskt utseende [5]. Avsaknaden av kolin, kreatin och N-acetylaspartat, ackumulationen av laktat och alifatiska CH3- och CH2-grupper samt förekomsten av metaboliter som normalt inte ses i ett humant hjärnvävnadsspektrum (acetat, succinat och alanin) ger spektrumet dess karakteristiska utseende (Figur 2).
Vid avsaknad av de sistnämnda abscesspecifika metaboliterna återstår differentialdiagnostiskt även den sterila abscessen. Under antibiotikabehandling försvinner dessa metaboliter. Ett sådant spektrum kan representera en steril abscess likaväl som någon annan form av cystisk nekrotisk hjärnlesion (Figur 2 C) [6, 7]. En analys av cystans omgivande vävnad kan i dessa fall ge ytterligare information om lesionens genes.
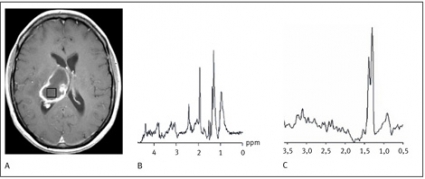
De vanligaste primära hjärntumörerna är kända för sitt infiltrativa och heterogena växtsätt, vilket återspeglas i patologiska spektrum i tumöromgivningen med normalt morfologiskt utseende såväl som heterogena spektrum i olika tumörområden (Figur 3).
Avsaknad av denna infiltration i kringliggande vävnader talar å andra sidan också mer för ett lokalt nodulärt växtsätt, vilket är vanligast hos metastaser eller meningiom. Sistnämnda entitet är dock sällan ett radiologiskt differentialdiagnostiskt problem.
MRS används även för att kunna kartlägga en lesions malignitetsgrad närmare [6]. En hög membranomsättning, ökad celltäthet och ökad vaskularitet i högmaligna tumörer återspeglas inte bara i perfusions- och diffusionsförändringar, utan även i generellt kraftigt ökat kolinvärde, minskat N-acetylaspartatvärde och i varierande grad ökade värden av laktat och alifatiska CH3- och CH2-grupper.
Encefaliter
MRS kan normalt inte fastställa vilket agens som ligger bakom en encefalit eller en inflammatorisk process. Metodens styrka ligger dock i möjligheten att detektera sjukdomens utbredning och eventuellt engagemang av hjärnparenkym som på konventionella MR-bilder fortfarande förefaller friskt [8]. Även för uppföljningen kan MRS vara av värde genom att tidigt kunna uppmärksamma patofysiologiska processer talande för progress eller regress av sjukdomen.
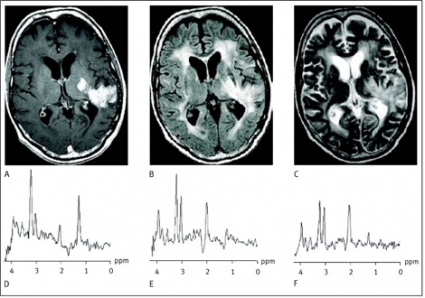
Spektrum vid encefaliter karakteriseras i första hand av en minskning av N-acetylaspartat som uttryck för både en dysfunktion och/eller en undergång av nervceller. Ökningen av kolin står i det akuta stadiet i första hand för den ökade cellomsättningen på grund av parenkymskadan och destruktionen, medan samma parameter vid läkningen och i ett mer kroniskt stadium återspeglar bla reparationsmekanismer såsom glios. Ett annat vanligt fynd vid encefalit är en ökning av myoinositol [9] (Figur 4).
Metabola sjukdomar
Spektroskopi vid metabola sjukdomar används kliniskt för att hitta eller bekräfta en sjukdom, underlätta bedömningen av prognosen och monitorera behandlingsresultat eller sjukdomsförlopp [10]. Upptäckten av laktat hos patienter med känd eller misstänkt mitokondriell sjukdom bekräftar diagnosen eller sjukdomens engagemang av det centrala nervsystemet.
Ytterligare exempel på typiska spektroskopifynd vid metabola sjukdomar är fenylalanintoppen (7,3 ppm) vid fenylketonuri, total avsaknad av kreatin vid obehandlat Frahm– Hanefeld–Bianchi-syndrom och partiell återhämtning av kreatintoppen vid behandling av detta syndrom med kreatintillskott, exceptionellt höga värden N-acetylaspartat vid Canavans sjukdom eller en ackumulation av glutamat och glutamin vid brist på ornitintranskarbamylas (OTC).
Multipel skleros
Patologiska fynd vid multipel skleros omfattar såväl ödem, demyelinisering, degeneration och axonskada, såsom reparationsprocesser och remyelinisering. Beroende på sjukdomens status ses MRS-fynd av varierande grad [11]. MRS detekterar patologiska områden veckor till månader innan konventionella MR-undersökningar visar tecken på fokala demyeliniserande lesioner. I MR-synliga MS-plack ses en ökning av kolin, myoinositol, laktat och alifatiska CH3- och CH2-grupper, vilken beror på membran- och myelinnedbrytningen och en ökad gliacellsaktivitet. Minskningen av N-acetylaspartat är ett uttryck för både ödem (vilket medför en minskning av antalet neuron/axon per mätt volymenhet) och nervcellsdysfunktion och först i andra hand ett uttryck för axondegeneration eller nervcellsundergång. Detta återspeglar sig också i en partiell återhämtning av N-acetylaspartat vid remyelinisering.
Epilepsi
Inom diagnostiken av epilepsisjukdomar används MRS som ett komplement för lateralisering av det epileptogena fokuset [12, 13]. Den största andelen av de epilepsipatienter som undersökts med MRS har temporallobsepilepsi (TLE), där MRS visar en cirka 20-procentig minskning av N-acetylaspartat i fokussidan och en sensitivitet på cirka 80–100 procent för lateraliseringen. Minskningen av N-acetylaspartat motsvarar histologiskt vanligen en mesial temporal skleros med neuronundergång och glios. Andra MRS-fynd är en lätt ökning av kolin och kreatin.
En temporär postiktal ackumulation av laktat anses vara en markör för det epileptogena fokuset. Mellan 20 och 55 procent av patienter med unilaterala EEG-fynd visar bilaterala patologiska spektrum, dock med en mer marginell N-acetylaspartatminskning kontralateralt till fokuset. Även hos patienter med normala MR-fynd kan metoden användas för lateralisering och detektion av tidiga metabola förändringar. Patienter med grava bilaterala MRS-förändringar har dålig prognos avseende anfallsfrihet postoperativt, medan lätta kontralaterala MRS-förändringar inte anses vara en prognostiskt negativ faktor.
Även patienter med extratemporalt belägna epileptogena fokus såsom frontallobsepilepsier visar i första hand minskad halt N-acetylaspartat. Minskningen är mest uttalad i området för det epileptogena fokuset, men mindre uttalade MRS-förändringar ses även utanför fokuset och kontralateralt till den icke-epileptogena hemisfären. Även lesionsassocierade epileptiska fokus uppvisar ofta grava metabola avvikelser, som uttryck för både det epileptiska fokuset och den underliggande patologin (Figur 5).
Normalt åldrande och demens
Eftersom MR-spektrum återspeglar bla nervcellernas, myelinets och gliacellernas täthet och funktion, ses stora skillnader i det spektrala mönstret mellan nyfödda barn med en mycket låg myeliniseringsgrad och parenkymmognad och gamla patienter med parenkymdegeneration eller parenkymskada av varierande grad. Den nyföddes spektrum karakteriseras av, jämfört med en vuxens, låga nivåer N-acetylaspartat och höga kolin- och myoinositolvärden. Under de första levnadsmånaderna sker i takt med myeliniseringen en övergång till ett vuxenspektrum [14].
Trots stora skillnader i studieupplägg (lokalisation av mätområden, mätparametrar och utvärderingsmetod) sammanstrålar resultaten i litteraturen till en generell konsensus att nivåerna av N-acetylaspartat sjunker några få till tio procent med normalt åldrande, som uttryck för minskad neurontäthet och metabol viabilitet. När det gäller åldersrelaterade förändringar av de resterande metaboliterna går dock åsikterna isär. Differentialdiagnostiken mellan olika demenssjukdomar baserar sig i första hand på analysen av metabolitförändringar i olika områden. MR-spektrum vid Alzheimers sjukdom karakteriseras i första hand av en ökning av myoinositol och en minskning av N-acetylaspartat [15].
Omfattningen av reduktionen av N-acetylaspartat är större vid alzheimer än vid normalt åldrande. I differentialdiagnostiken mellan olika demenssjukdomar är distributionen av minskningen av N-acetylaspartat över hjärnans olika områden en viktigare parameter än dess storlek. De spektrala förändringarna är vid tex alzheimer först synliga och störst i hippocampus och temporalloben, medan distributionen av MRS-förändringar vid frontala demenstyper motsvarar frontalloberna. Vid multiinfarktdemens motsvarar den vitsubstansförändringarnas utbredning sedd på MR.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.