Sammanfattat
Diffusionsviktad MR kan påvisa cerebral ischemi mycket tidigt och med stor sensitivitet.
Perfusions-DT eller MR kan definiera ischemisk penumbra och är mycket användbar för terapival.
DT- och MR-angiografi påvisar kärlstenoser och ocklusioner minimalt invasivt.
Kärldissektioner påvisas bäst med MR.
Utvecklingen under det senaste decenniet har inneburit dels nya kliniska behandlingsmetoder (tex intravenös trombolys vid akuta infarkter) och ett antal nya radiologiska tekniker som snabbt fått klinisk användning, dels ett breddat interdisciplinärt samarbete kring patienter med stroke, där neurologer, internmedicinare, neurokirurger, radiologer, interventionella neuroradiologer och flera andra specialiteter aktivt deltar i den akuta handläggningen.
Mångfalden av radiologiska metoder innebär att radiologen ofta måste ta ett större ansvar och initiativ för att undersöka patienten med en eller flera av de mest relevanta teknikerna, och då behövs mer specifika kliniska uppgifter om patienten än tidigare.
Samtidigt kan även den mest pålästa kliniska kollega ofta finna att frågeställningen och den kliniska preliminärdiagnosen spelar betydligt större roll för uppläggningen av den radiologiska utredningen än det ursprungliga metodförslaget på röntgenremissen.
Det förefaller därför vara på sin plats att överblicka den arsenal av neuroradiologisk metodologi som snabbt växt fram och reflektera över dess kliniska användning. För att underlätta läsningen presenteras den vildvuxna flora av ständigt nya akronymer och förkortningar, som inte bara utväxlas radiologer emellan utan också ofta ger röntgenutlåtanden en air av tekniskt fikonspråk (Tabell I).
De cirka 25000–30000 insjuknanden i stroke som varje år inträffar i Sverige (med flest vårddagar av alla sjukdomsgrupper och stor morbiditet och som utgör den tredje vanligaste dödsorsaken) motiverar att diagnostiska framsteg rapporteras. Dessa framsteg får potentiellt betydelsefulla effekter i såväl ett humanitärt perspektiv som ett vårdbehovs- och samhällsekonomiskt perspektiv i form av minskade handikapp och mindre beroende av hjälpinsatser.
De senaste årens utveckling tyder på att ett paradigmskifte kan ha inletts, där utvecklingen nu går mot betydligt mer aktiva och tidiga insatser vid akut stroke, både kliniskt och inom specialiteter inriktade på bild- och funktionsdiagnostik.
Intracerebrala hematom
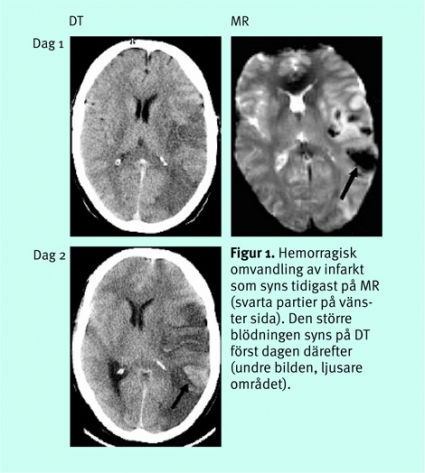
Hemorragi är orsaken till stroke hos bara cirka 15 procent av patienterna, men hemorragi är en viktig differentialdiagnos, som enkelt påvisas eller utesluts med DT i rutinfallet. MR har mycket stor känslighet för blödningar (Figur 1), och ett diagnostiskt program för akut stroke kan mycket väl drivas enbart med MR, förutsatt att sekvenser känsliga för hemoglobinprodukternas paramagnetiska egenskaper ingår: tex T2*-gradientekobilder [1, 2] eller de mycket susceptibilitetskänsliga (dvs känsliga för vävnadens magnetiska egenskaper) snabba ekoplanära gradientekosekvenser som används för perfusionsviktad MR.
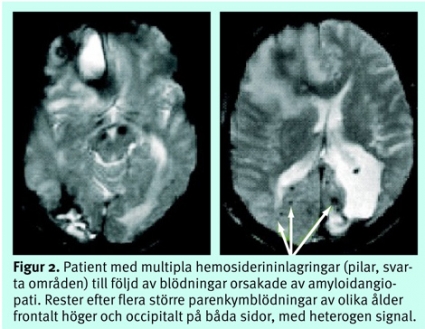
Dessa tekniker kan också påvisa mikroblödningar orsakade av lipohyalinos eller amyloid angiopati (Figur 2).
Ischemisk stroke
Modern diagnostik av fokala infarkter. Majoriteten av de akuta hjärninfarkterna orsakas av trombos eller emboli i större cerebrala artärer. I ett område av grå substans leder en stark nedsättning av blodflödet (20–25 procent av det normala, dvs 12 ml/100 gmin–1) inom några minuter till infarkt med upphävd funktion av membranpumparna. Den cellsvullnad detta orsakar, »cytotoxiskt« ödem, ökar nästan linjärt de första timmarna [3].
Datortomografi har större känslighet för dessa förändringar än vad som allmänt antogs för något decennium sedan, om man ser till att upplösningen av låga kontraster är god. DT kan ofta påvisa infarktförändringar med låg attenuering efter 1–1,5 timmar, i sällsynta fall redan efter 50–60 minuter. Konventionell MR-teknik (tex T2-viktade bilder) har bara marginellt större känslighet för tidiga infarktförändringar, med en fördel framför DT endast vid förändringar i bakre skallgropen [3].
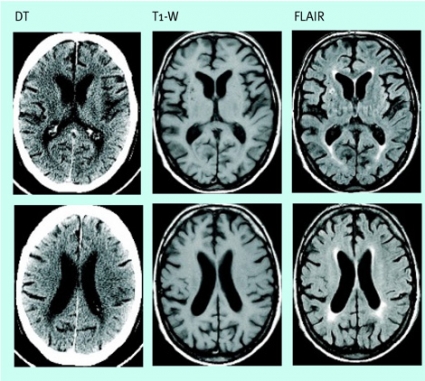
Diffusionsviktade MR-bilder (DWI), som framför allt avspeglar protonernas rörlighet i det extracellulära vattnet, har däremot mycket hög känslighet för det cytotoxiska ödemet. Cellsvullnaden orsakar en sekundär inskränkning av extracellulära rummet vid tidiga infarkter, och DWI kan påvisa sådana förändringar redan efter minuter. Sensitiviteten respektive specificiteten med DWI de första 6 timmarna efter infarktinsjuknandet anses vara i storleksordningen 95 procent respektive nära 100 procent [4], och känsligheten även för små lakunära infarkter är vida överlägsen känsligheten med DT.
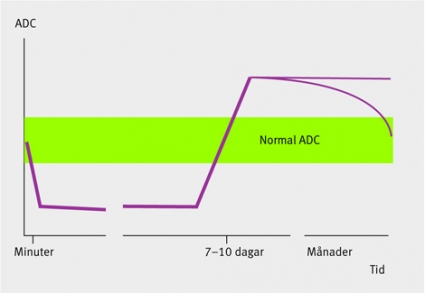
DWI-bilderna ger således hög kontrast och lämpar sig väl för att påvisa patologiska förändringar (Figur 3). Diffusionen låter sig också beräknas i absoluta tal som »apparent diffusion coefficient« (ADC). Sådana bearbetningar eliminerar effekterna av tex förhöjd T2-signal, som annars kan leda till misstolkningar, och gör att man kan skilja cytotoxiskt ödem från vasogent.
Registreringen av ett läkemedel för intravenös trombolys (2003) och framväxten av tekniker för intraarteriell trombektomi eller trombolys har gjort det viktigt att kunna påvisa och bedöma utbredningen av tidiga förändringar vid hjärninfarkter [5, 6]. Storleken av en eventuell irreversibel infarkt tycks ha betydelse både för patientens chans att dra stor nytta av behandlingen och för komplikationsrisken, framför allt risken för större hematom [7]. Uttalade diffusionsförändringar vid akut infarkt har ett visst samband med slutlig infarktstorlek, men måttliga och lättare inskränkningar i diffusionen kan vara reversibla, särskilt om akut behandling mot ocklusionen lyckas. Någon entydig gräns mellan reversibel och irreversibel diffusionsinskränkning har inte kunnat anges [8].
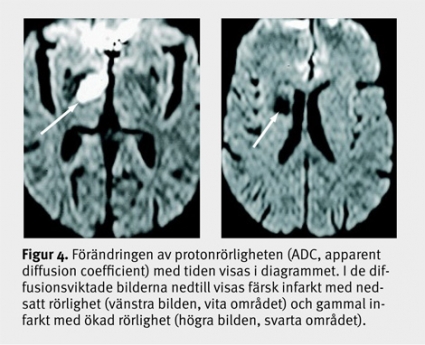
Efter 7–10 dagar domineras diffusionsmönstret inte längre av cytotoxiskt ödem, och i det subkroniska och kroniska stadiet av infarkten ses förändringar som vasogent ödem, som innebär större rörlighet än omgivningen (Figur 4) och ökad signal på T2-bilder på grund av nekros. Precisionen i att särskilja färska infarkter från äldre infarkter och degenerativa förändringar har ökat väsentligt med DWI.
Akut avbildning av cirkulationsfysiologi. Neuronal vävnad nedströms en tromb eller embolus försörjs ofta mycket snabbt av kollaterala blodflöden från angränsande kärlområden, och vid omkring 70–80 procent av alla större infarkter finns områden som överlever med hjälp av dessa reservmekanismer. I sådana regioner kan nervvävnaden ha nedsatt eller upphävd elektrisk aktivitet som följd av att perfusionstrycket inte räcker till. Områden med sådana »förstummade« neuron tenderar ofta att infarcera om inte blodflödet snabbt restitueras. (Neuron med upphävd elektrisk funktion tros kunna överleva i detta tillstånd i 2–3 timmar [8].) Att rädda sådana regioner som ännu inte skadats ohjälpligt (ischemisk penumbra) är en central målsättning för nutida, aktiv behandling vid hjärninfarkt, och tiden att rädda hjärnvävnad är således knapp.
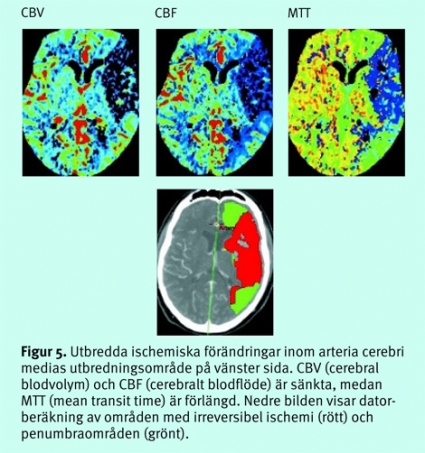
Kliniskt använda neuroradiologiska tekniker för att bedöma perfusionen baseras på att koncentrationen av ett kontrastmedel i hjärnans mikrocirkulation följs med en serie upprepade DT- eller MR-bilder, med 1,5–3 sekunders intervall, under 30–40 sekunder efter en snabb och välkontrollerad intravenös kontrastbolus [9, 10]. Efter bearbetning av bildmaterialet beräknas blodvolym (CBV), blodflöde (CBF) och passagetid (MTT, mean transit time = CBV/CBF) i en arbetsstation, och resultaten presenteras som bildkartor. Beräkningar med DT-teknik kan ge kvantitativa värden, medan MR-tekniken ger relativa värden beroende på svårigheter att exakt följa artärkoncentrationen av kontrastmedlet. Avvikelser som homogent drabbar hela hjärnan är därför svåra att avslöja.
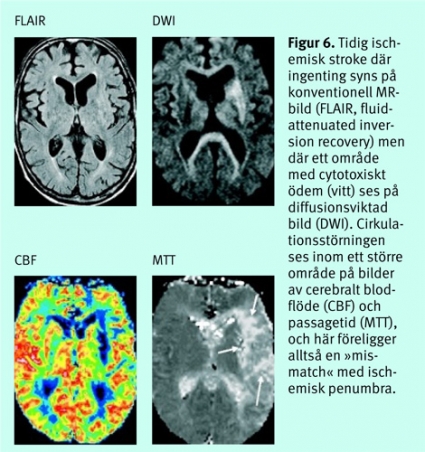
Vid en cirkulationsstörning sker först en ökning av CBV för att kompensera för sänkt perfusionstryck (autoregulation). Vid ytterligare sänkt perfusionstryck sjunker CBF och därefter både CBV och CBF. Vid analysen görs i allmänhet en jämförelse med den friska sidan. Vid DT-perfusion kan penumbraområdet beräknas genom analys av graden av perfusionsstörning (Figur 5).Vid MR-perfusion används samma princip, men man kan där också illustrera penumbraområdet genom subtraktion från området med cirkulationsstörning av området med cytotoxiskt ödem på diffusionsviktade bilder. När man har en »mismatch«, dvs större vävnadsvolym med cirkulationsstörning än området med cytotoxiskt ödem, föreligger en situation där det finns vävnad (penumbra) som potentiellt kan räddas från vävnadsdöd (Figur 6).
Perfusionsmätning med MR täcker hela hjärnan men är relativt opraktisk för undersökningar av akuta patienter, eftersom tillgängligheten är begränsad. Metoden har därför kommit att användas mest i det subakuta skedet. DT finns alltid tillgänglig för akuta undersökningar, men perfusionsmätning täcker bara en 2–4 cm tjock skiva av hjärnan med de flesta utrustningar. Analysen tar, vid både DT och MR, cirka 10 minuter. Utvecklingen är emellertid mycket snabb, och nya DT-utrustningar som kan täcka hela hjärnan är under introduktion. En annan nackdel med DT-perfusion är att stråldosen är relativt hög, vilket gör att upprepade undersökningar undviks. Sannolikt kan man dock förvänta sig att DT-perfusion kommer att utföras rutinmässigt på alla patienter som ska behandlas akut med trombolys eller interventionella metoder i framtiden.
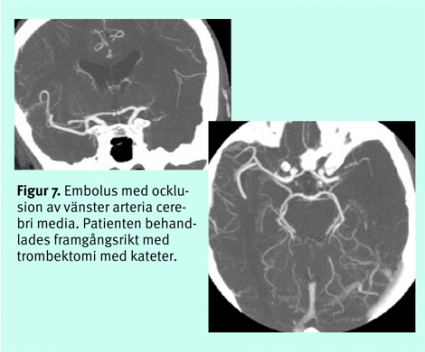
Akut tomografisk kärldiagnostik. Eftersom den akuta behandlingen riktar sig mot artärocklusioner, får snabba, låginvasiva angiografiska tekniker stor relevans. Stora studier av betydelsen av ocklusioner för intravenös trombolys saknas ännu, men intuitivt förefaller naturligtvis sådan terapi inte gagna patienter utan synlig tromb eller embolus. Ocklusioner som omfattar både karotissifonens topp och första delarna av arteria cerebri anterior och media har små chanser till rekanalisering med intravenös terapi [3].
Den senaste tidens utveckling av DT-angiografi med multidetektorteknik gör det möjligt att morfologiskt kartlägga cerebrala artärer från aortabågen ut till 2:a eller 3:e ordningens förgreningar. DT-angiografi från aortabågen till hjärnan är en snabb metod; avbildningen tar under 1 minut, medan bearbetningen och bedömningen av bilderna kräver 5–30 minuter. DT-angiografi används allt oftare för akut bedömning av embolikälla i karotis och embolier i intrakraniella kärl (Figur 7). DT-angiografi används också som första led i utredningen vid många universitetskliniker för att påvisa aneurysm vid subaraknoidalblödning.
MR-angiografiska tekniker har också förbättrats men kan inte tävla med DT vad gäller hög geometrisk upplösning, trots att kontrastförstärkt MR-angiografi och högre fältstyrkor inneburit stora framsteg. MR-angiografier utan kontrastmedel ger möjlighet att visualisera flöden, och känsligheten för flödets hastighet kan väljas för att passa för tex artärer eller vener. Bedömningen av kärlens morfologi, som vid MR utan kontrastmedel egentligen är indirekt, störs ibland av flödesorsakade artefakter. Ingen av dessa tekniker kan kartlägga kollateral cirkulation; information av detta slag kräver konventionell angiografi, som vid akut stroke vanligen görs enbart som led i en intravaskulär terapeutisk intervention.
»Lakunära« infarkter.
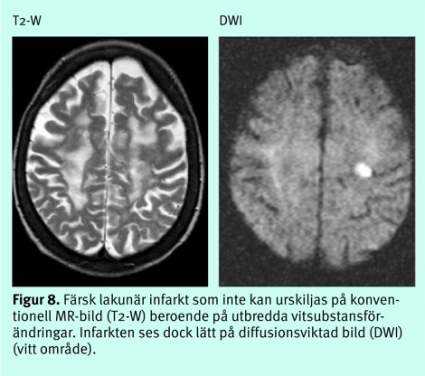
Man kan inte visualisera den småkärlssjukdom med väggförtjockning av små perforerande artärer och arteriolier som anses vara orsaken till lakunära infarkter. Kliniska neurologiska fynd som vid ett lakunärt syndrom (tex rent motoriskt eller sensoriskt bortfall) kan ge stark misstanke om en sådan orsak till akut stroke. MR med diffusionsviktade bilder kan oftast påvisa lakuner eller avgöra om de är färska eller nytillkomna. Med DT, eller konventionella MR-bilder, är denna typ av infarkter ofta svåra att avgränsa från de mer diffusa vitsubstansförändringar som småkärlssjukdom ofta ger upphov till (Figur 8) och från vida men normala perivaskulära rum.
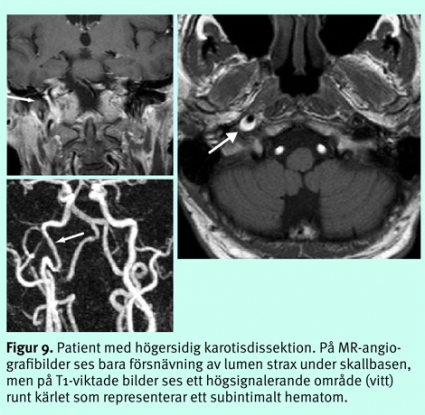
Akuta sjukdomar i halskärlen. Medvetenheten har ökat om att dissektioner i halskärlen är en viktig potentiell orsak till embolisk stroke [11, 12], och om en sådan drabbar arteria vertebralis intradurala segment kan den någon gång vara orsak till subaraknoidalblödning. Bilder bara av lumens grovmorfologi med MR-angiografi eller DT-angiografi är otillräckligt och kan leda till underdiagnostik. MR med T1- och PD-bilder eller analys av kärlväggens tjocklek och attenuering vid DT är viktiga för att avslöja ett subintimalt hematom (Figur 9). Majoriteten av dissektionerna läker inom ett par månader. Relativt stor enighet råder om att en uppföljande undersökning med någon av de dessa modaliteter, eller doppler, cirka 3 månader efter debuten är värdefull för att eventuellt kunna avsluta den antikoagulantiabehandling som är gängse.
Globala ischemiska skador
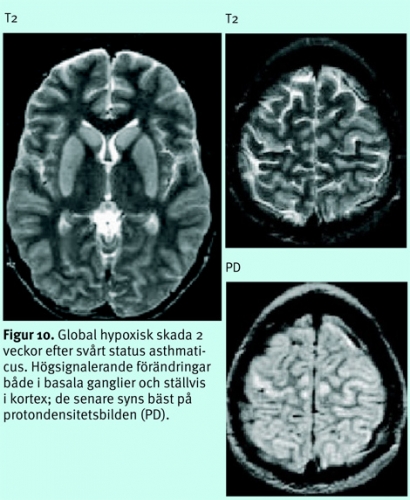
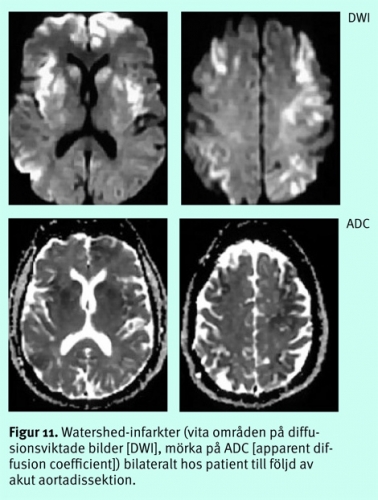
Diffus hjärnskada efter djup anoxi/hypoxi eller excessivt lågt systemblodtryck, tex efter hjärtstillestånd, status asthmaticus, kolmonoxidförgiftning, grav hypovolemi etc, ger, om den inte är letal, en selektiv skada på vissa neuronpopulationer, framför allt på dem med högst krav på energitillförsel, dvs i basala ganglier, i kortex känsligaste lager (3, 4 och 5), hippocampi, thalami mfl (Figur 10), ibland i watershed-områdena (Figur 11) [13].
Sedan decennier vet vi att skador av global ischemi ibland kan visualiseras med DT subakut och att de vanligen blir tydligare efter 3–4 dagar. Diffusionsviktade bilder är ett betydligt känsligare instrument för att påvisa globala hypoxiska/ischemiska förändringar, men den kliniska nyttan är ofta begränsad. Radiologen kan sällan infria intensivvårdsläkarens förhoppningar om säker prognostisk information om huruvida ett permanent vegetativt tillstånd är att vänta, eftersom någon entydig gräns mellan förändringar som kan vara förenliga med återhämtning och irreversibla skador inte finns, inte ens med denna teknik. Utbredda, kraftiga förändringar i basala ganglier kan dock ge en fingervisning om ett dåligt neurologiskt utfall.
Någon gång kan DWI förbättra förståelsen av en komplicerad intensivvårdssituation och tex ge indicier på om hypovolemi/lågt perfusionstryck eller hypoxi varit väsentliga orsaker till det kliniska tillståndet.
Venösa stroke
De snabba framstegen vad gäller framför allt MR-diagnostiken kring durala vensinus och hjärnans centrala vensystem har, tillsammans med mer differentierade behandlingsrutiner, bidragit till att prognosen för patienter med sinustrombos och besläktade tillstånd förbättrats betydligt. För att påvisa venocklusionen används antingen noninvasiv MR-teknik känslig för långsamma flöden, där skillnader i protonspinnens fas mellan rörliga protoner i venerna och statiska spinn i vävnad utnyttjas (faskontrastbilder, PC), eller höga signaler från osaturerade protoner som flödar in i det avbildade snittet (inflödesangiografi, TOF), alternativt MR-angiografi under intravenös kontrastinjektion (CE-MRV).
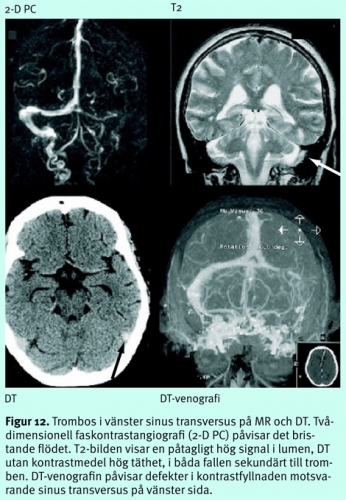
Inte sällan får flera tekniker kombineras för att få en konklusiv tolkning. Konventionella MR-bilder bidrar här, eftersom MR dels har god känslighet för sekundära förändringar som ödem eller hemorragiska lesioner orsakade av stas, dels ibland visualiserar själva trombmassorna eller abnorma signaler i kortikala vener (Figur 12). Vid DT utan kontrastmedel är det jämförelsevis svårare att detektera tromber (täthet högre än vad som svarar mot den normala hematokriten) och påvisa ödem. DT-venografi under kontrastinjektion ger en bättre diagnostisk säkerhet än MR, eftersom metoden besväras av färre tekniska svårigheter och fallgropar än MR. DT kombinerad med DT-venografi kan därför komma att etablera sig som första linjens diagnostik vid misstänkt sinustrombos, särskilt som tillgången till MR under jourtid på många håll är dålig.
Patienter med sjunkande medvetandegrad, eventuellt svårkontrollerade kramper och påvisad svår sinustrombos kan behöva diskuteras för akut interventionell behandling, med kateterangiografi och -venografi, följd av trombektomi och/eller intravaskulär trombolys.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.