Sammanfattat
Diffusions- och perfusions- MR av intrakraniella tumörer förbättrar tumörkarakteristiken och bedömningen av relationen till vitsubstansbanor. Metoderna är dessutom till nytta vid differentialdiagnostiska problem.
Metoderna kan också vara av värde vid bedömning av terapieffekt.
Diffusions-MR kan med relativt hög säkerhet skilja mellan en obehandlad abscess och en malign hjärntumör med central nekros.
Vid långdragna epileptiska anfall kan man se reversibla diffusionsförändringar i hjärnan.
Perfusions-MR kan påvisa blodflödesförändringar vid olika typer av demens.
Diffusions-MR är sensitiv för detektion av kontusioner i hjärnparenkymet.
MR är den bästa radiologiska metoden för diagnostik och uppföljning av intrakraniella neoplastiska, inflammatoriska, infektiösa och neurodegenerativa sjukdomar och kan vara till nytta vid skalltrauma. Man kan öka sensitiviteten och specificiteten i morfologiska bildsekvenser genom att lägga till fysiologiska metoder som diffusions-MR, perfusions-MR och spektroskopi. Kombination av flera av dessa metoder ger ofta optimal information, men alla patienter kan inte ligga stilla under en lång MR-undersökning.
Diffusions- och perfusions-MR har kort skanningstid och kan därför användas frikostigt utan att förlänga undersökningstiden i MR-apparaten alltför mycket. Radiologen får fler bildsekvenser att bedöma, och viss bildbehandling och beräkning utförs efter själva MR-undersökningen (postprocessning), men denna ökade tidsåtgång uppvägs av bättre diagnostik. Detta kommer ju både behandlande kliniker och inte minst patienten till godo.
Diffusionsviktad MR
Diffusionsviktad MR (diffusion weighted imaging, DWI) avspeglar mikrostrukturen i normal och patologisk vävnad baserad på vattenmolekylernas möjlighet till spontan mikroskopisk rörelse. Apparent diffusion coefficient (ADC)-kartan för ett snitt i hjärnan avspeglar medeldiffusionens storlek (mean diffusivity, trace/3) oberoende av T1- och T2-relaxationsvärden i vävnaden och oberoende av diffusionens riktning. Tekniken beskrivs också i artikeln om stroke.
Medeldiffusionen (mean diffusivity) är relativt uniform i normalt hjärnparenkym (ca 0,7 x 10-3 mm2s-1). Cerebrospinalvätska har hög medeldiffusion (ca 3 x 10-3 mm2s-1). Nedsatt diffusion (hög signal på DWI och låg signal på ADC-karta) är inte specifikt för akut stroke utan ses även vid ett flertal andra sjukdomstillstånd.
Diffusion tensor imaging
Diffusion tensor imaging (DTI) utförs med hjälp av diffusionsmätning med MR i minst sex riktningar. De bilder man erhåller avspeglar vattendiffusionens anisotropi, dvs i vilken grad diffusionen är riktningsberoende. Det viktigaste faktorn som bestämmer riktningsberoendet i en viss typ av vävnad är dess arkitektur. Diffusionen sker tex mycket lättare längs banorna i hjärnans vita substans än vinkelrät mot dessa. Alltså finns en hög grad av anisotropi, dvs riktningsberoende, i normal vit substans. Myeliniseringen av den vita substansen spelar också en roll och ej utvecklade myelinskidor eller destruerade sådana minskar riktningsberoendet av vattendiffusionen, vilket innebär nedsatt anisotropi.
Man kan mäta anisotropi i vävnaden, fractional anisotropy (FA), och FA-mätvärdena kan variera mellan 0 och 1. Den högsta anistropin i normal hjärna finner man i corpus callosum (FA-värde ca 0,7–0,8) där fibrerna är kompakt organiserade och vattendiffusionen dominerar längs fibrerna. Den lägsta anisotropin intrakraniellt ses i cerebrospinalvätska, där vattenmolekylerna diffunderar fritt i alla riktningar (FA-värde ca 0,1). De flesta patologiska processer i hjärnan har nedsatt anisotropi jämfört med normal vit substans.
Diffusionstensortraktografi
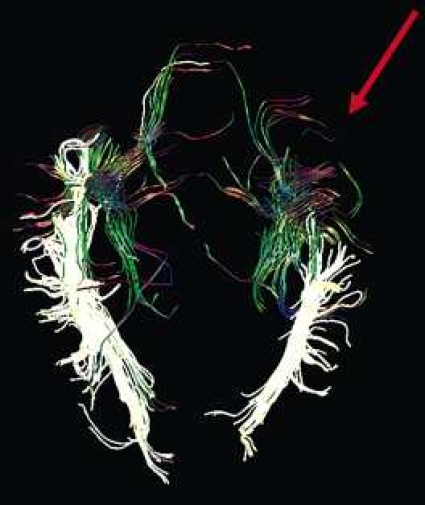
Diffusionstensortraktografi (DTT) är en postprocessningsmetod där datorn med hjälp av DTI-data gör en tredimensionell (3D) kalkyl av den mest sannolika diffusionsriktningen, som kan följas från voxel (bildelement) till voxel. Därmed erhåller man en 3D-bild av hjärnans bansystem, och man kan visa hur banorna är dislocerade eller destruerade av tex en intrakraniell tumör. Det finns emellertid en osäkerhetsfaktor i beräkningen av diffusionens huvudsakliga riktning, och det uppstår problem där banor korsar varandra eller förlöper genom ödem, varför bilderna av »banorna« aldrig är helt sanna.
Man brukar visualisera banor som förlöper i kranio-kaudal riktning med blå färg, i riktning höger–vänster med röd och antero-posteriort med grön. De spagettiliknande strukturer man visualiserar representerar inte de enskilda axonerna eller banorna utan endast deras huvudsakliga riktning. Med datorns hjälp kan man beräkna FA-värdet för en viss »bana« i hjärnan och kan därmed jämföra tex en frisk med en degenererad bana. Man kan också bestämma »antal fibrer« i en viss nervbana, men det är endast ett relativt värde som kan jämföras med motsvarande värde på den kontralaterala sidan.
DWI har i dag stor användning vid MR-undersökning av hjärnan i klinisk radiologisk rutinverksamhet, medan DTI med traktografi hittills huvudsakligen använts inom forskning. Kliniska tillämpningar är emellertid på väg inom kort.
Perfusions-MR
Perfusions-MR avspeglar genomblödningen av vävnaden, och man kan erhålla kartor med snitt genom hela hjärnan med hemodynamisk information i form av regionalt cerebralt blodflöde (rCBF), regional cerebral blodvolym (rCBV) och genomsnittlig passagetid (mean transit time, MTT). Vid den mest använda perfusions-MR-metoden, dynamic susceptibility contrast imaging (DSCI), injiceras en bolus med gadoliniumbaserat kontrastmedel snabbt intravenöst, och kontrastmedelspassagen genom hjärnparenkymet följs med snabb bildtagning. En annan perfusionsteknik, arterial spin labeling (ASL), använder endogen kontrast med magnetisk märkning av arteriellt blod och är därmed icke-invasiv. Den har längre skanningstid än DSCI och kan användas för att mäta regionalt cerebralt blodflöde. ASL har hittills använts mest i forskningsstudier men är på väg in i klinisk radiologisk verksamhet. Perfusions-MR-tekniken beskrivs också i artikeln om stroke. Metoden har stor klinisk användning även vid andra sjukdomar i hjärnan.
Intrakraniella tumörer och deras karakteristik
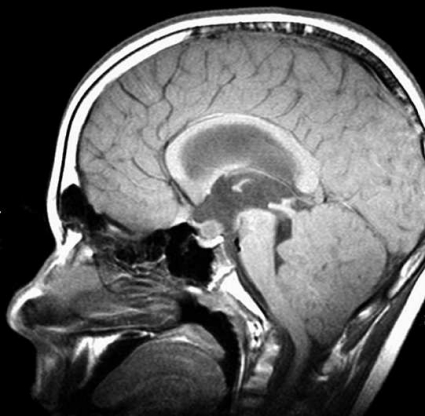
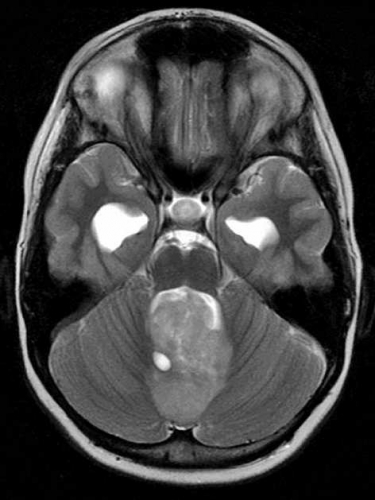
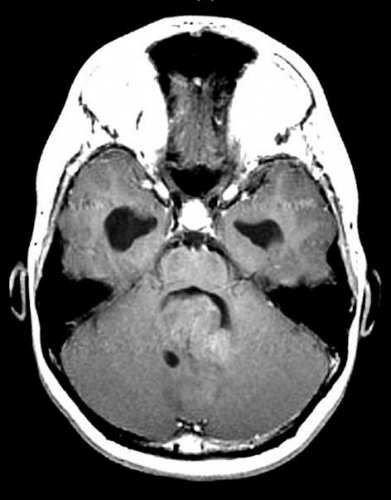
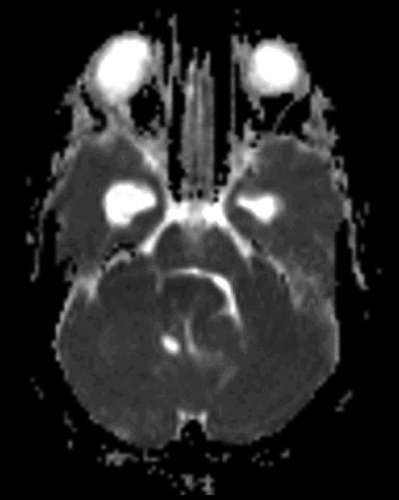
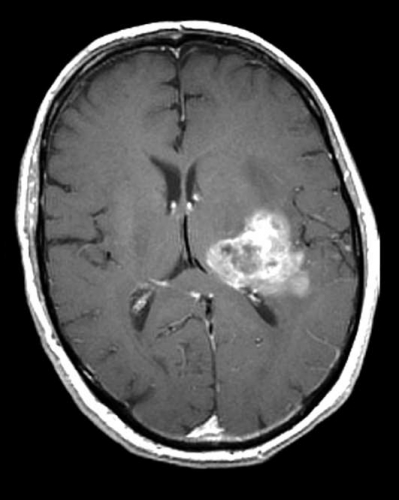
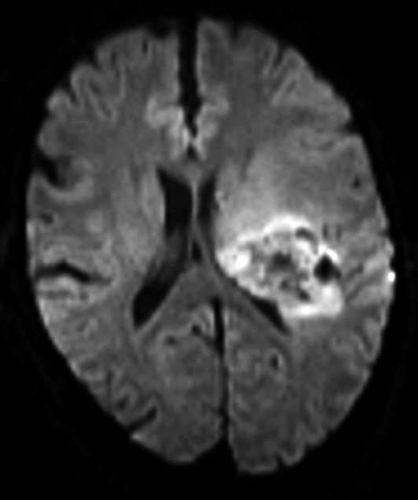
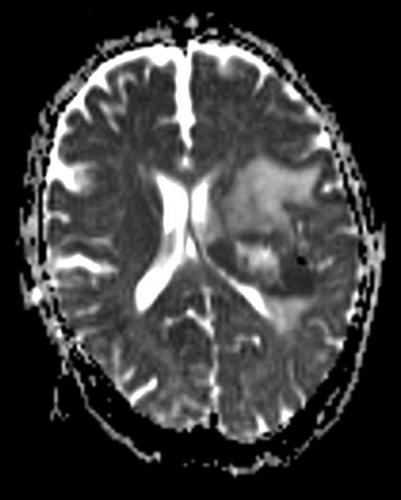
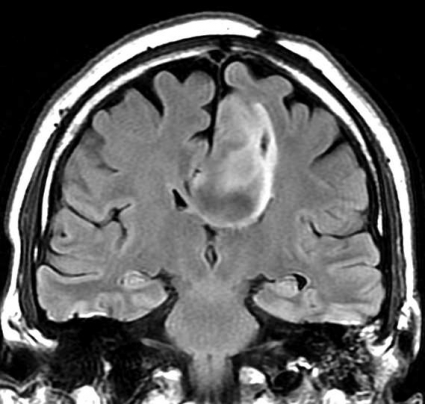
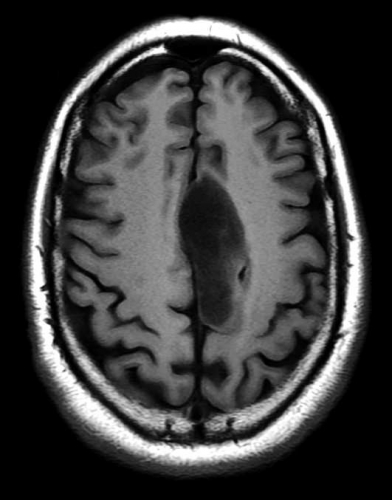
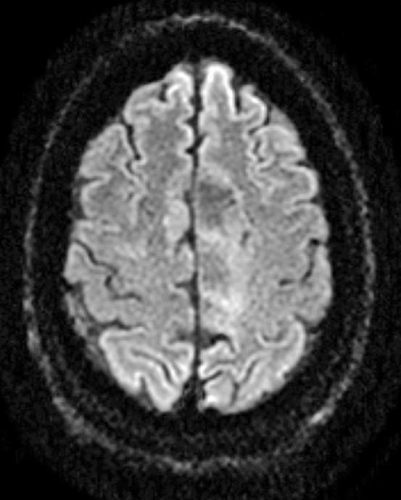
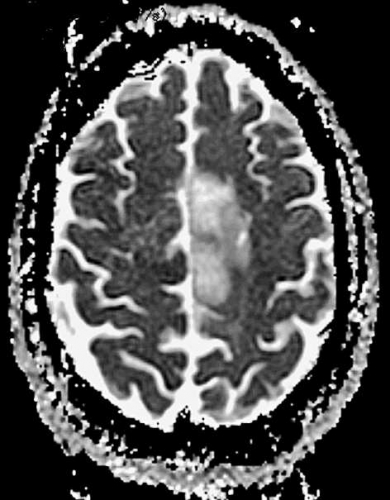
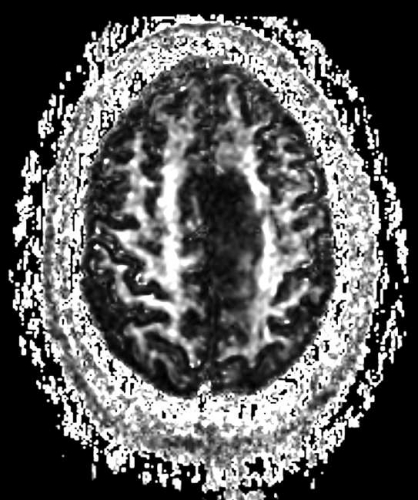
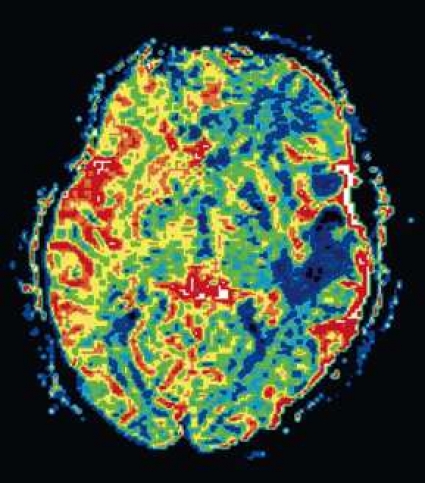
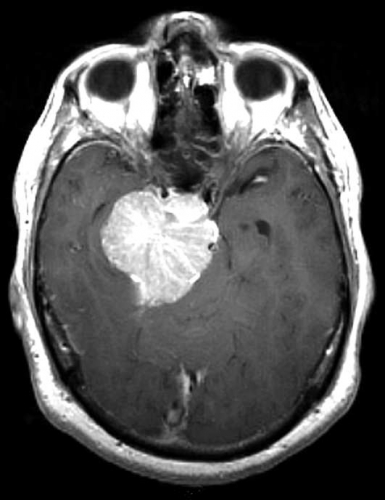
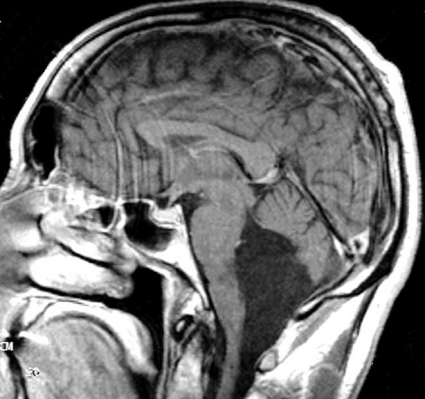
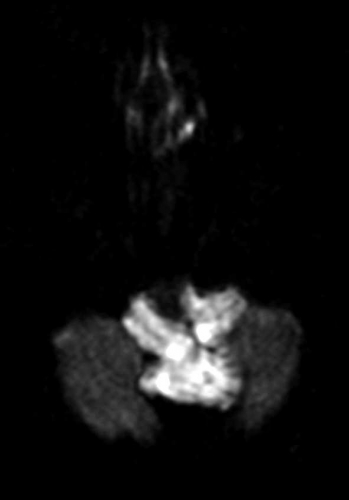
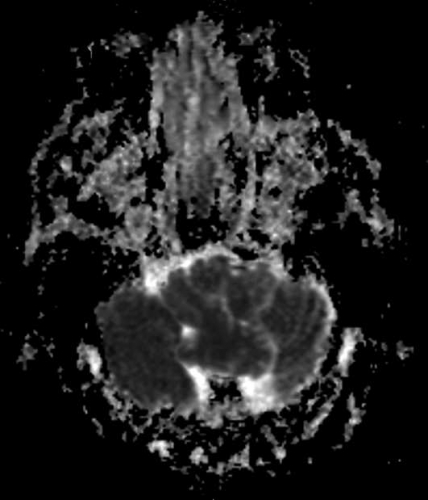
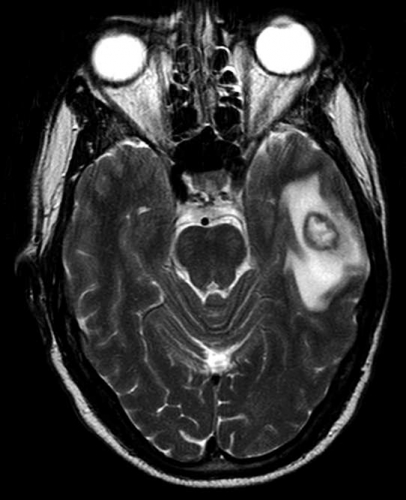
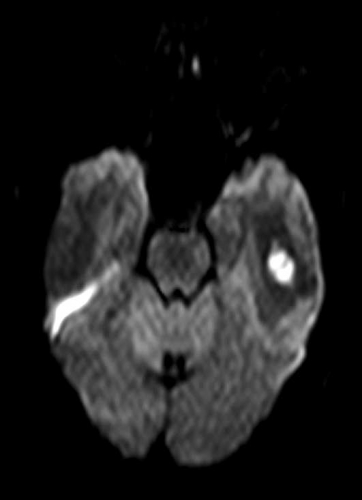
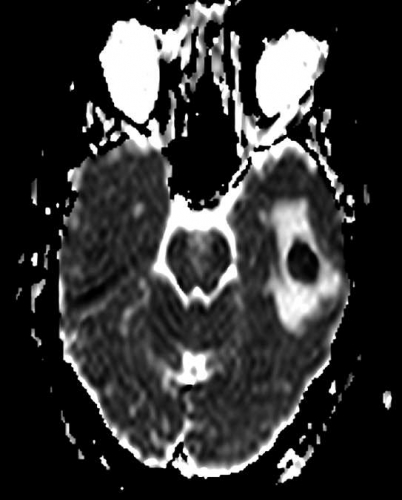
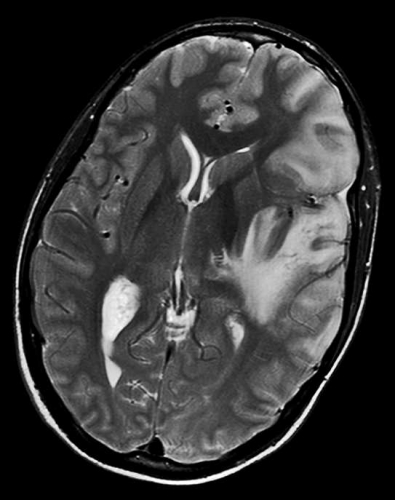
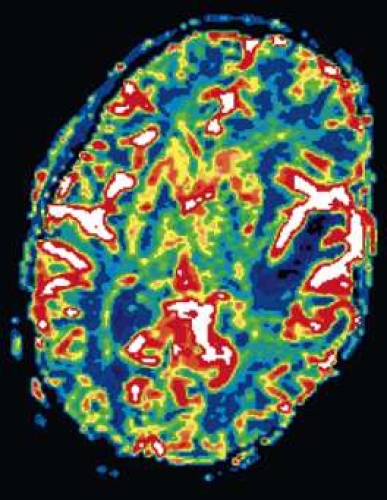
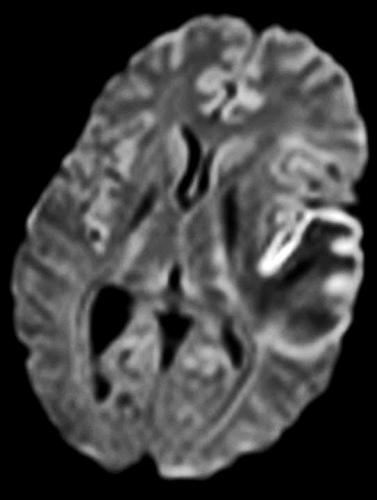
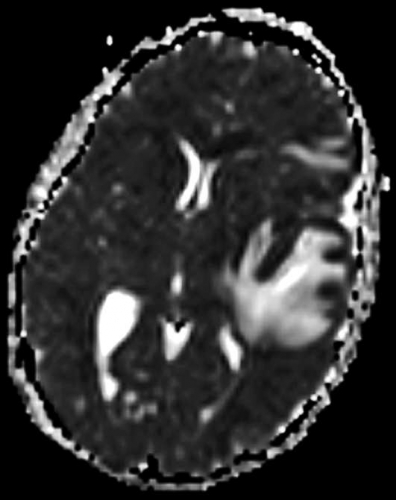
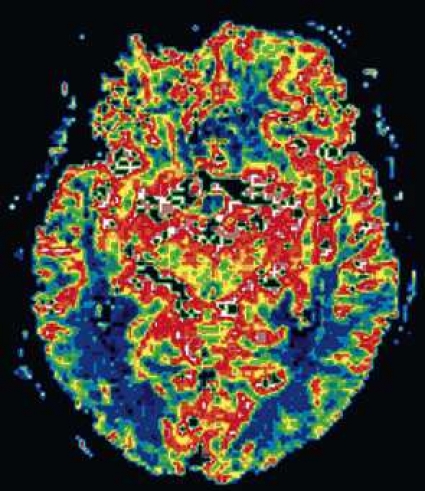
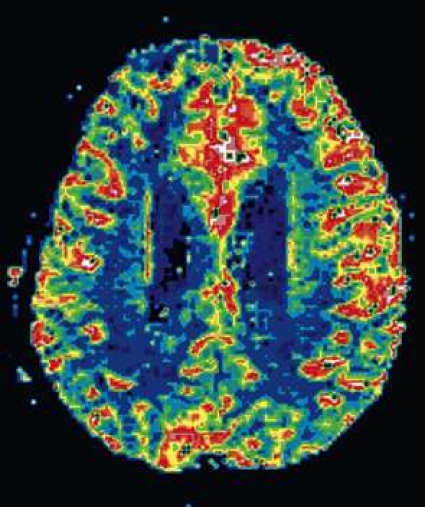
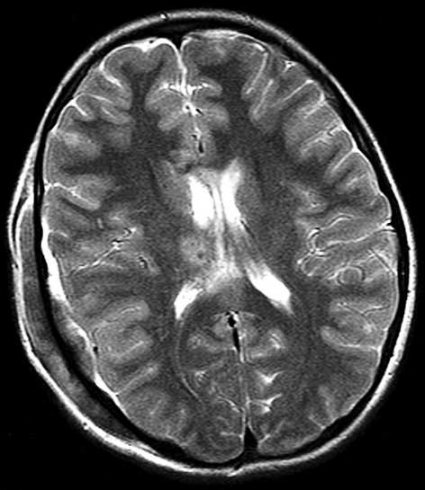
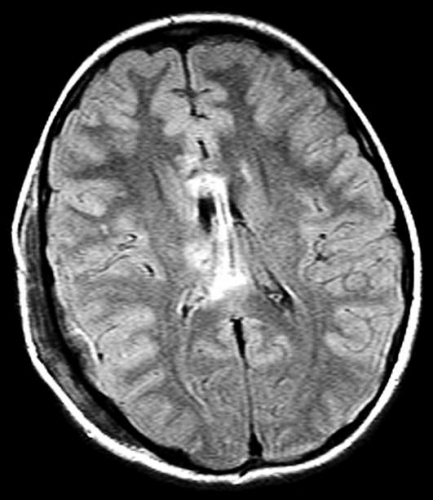
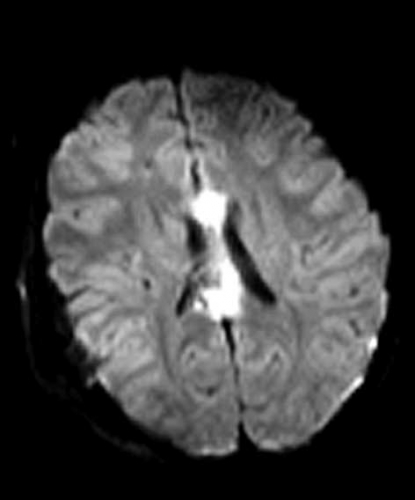
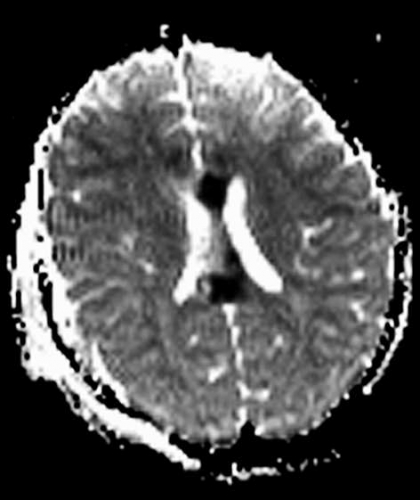
Diffusions- och perfusions-MR kan användas för tumörkarakteristik och för bedömning av tumörens relation till närliggande vitsubstansbanor. Metoderna kan också användas för differentialdiagnostik mellan tumörer och andra patologiska processer samt för bedömning av terapieffekt. Hög celltäthet, dvs många relativt tätt belägna membranstrukturer, medför restriktion av diffusionen. Tumörer med tätt packade små celler, tex lymfom, medulloblastom (PNET) (Figur 1), metastaser från småcellig bronkialcancer och vissa meningeom, har därför nedsatt diffusion jämfört med tumörer med lägre celltäthet [1, 2]. De har ofta lägre eller ungefär samma signal som normalt hjärnparenkym på en ADC-karta. Astrocytom grad 2–4 har stigande celltäthet med ökande malignitetsgrad och därmed också sjunkande diffusion. Glioblastoma multiforme (WHO grad 4) har ofta lägre diffusion inom sin solida tumörkomponent än ett diffust astrocytom (WHO grad 2) (Figur 2 och 3).
På MR-undersökning utförd omedelbart efter tumörexstirpation kan man kring den postoperativa kaviteten se områden med kraftigt nedsatt ADC som följd av kirurgiskt trauma. I dessa områden ses ofta kontrastuppladdning på senare undersökningar, och tidig postoperativ MR med låg ADC indikerar att denna barriärskada är sekundär till kirurgiskt trauma snarare än en kvarvarande eller recidiverande tumör [3]. Därför kan tidig postoperativ MR-undersökning med diffusion vara till stor hjälp i den fortsatta bedömningen av uppföljande MR-undersökningar.
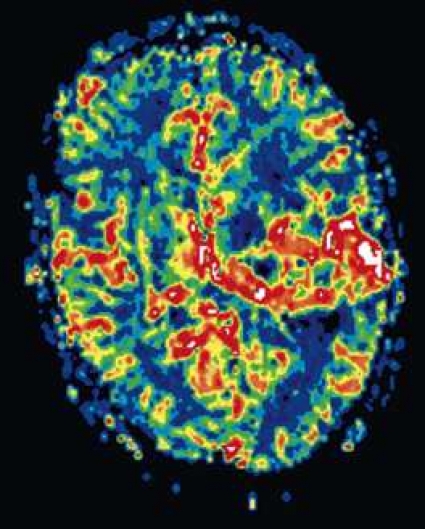
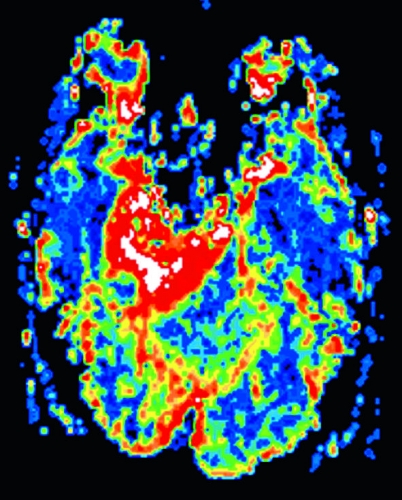
Perfusions-MR är till stor hjälp vid tumörkarakteristik och anses vara säkrare än MR-spektroskopi för bedömning av malignitetsgrad. Man har påvisat korrelation mellan regional cerebral blodvolym och histopatologisk grad i gliom (WHO grad 2–4). Angioneogenes med nybildning av patologiska kapillärer är mest uttalad i maligna gliom och avspeglas i förhöjd regional cerebral blodvolym [4] (Figur 2). Det är svårt att absolutkvantifiera regional cerebral blodvolym med den mest använda MR-perfusionsmetoden DSCI, men man får en bra uppfattning om graden av neovaskularisering och därmed graden av malignitet med hjälp av kvoten mellan regional cerebral blodvolym i tumören och i motsvarande område i normal vit substans i den kontralaterala hemisfären.
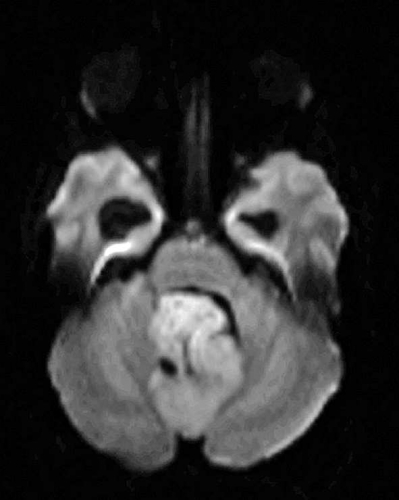
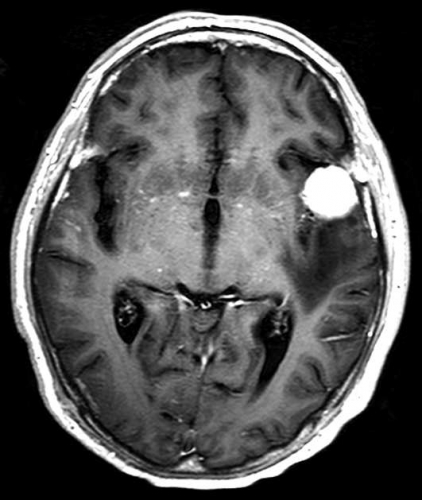
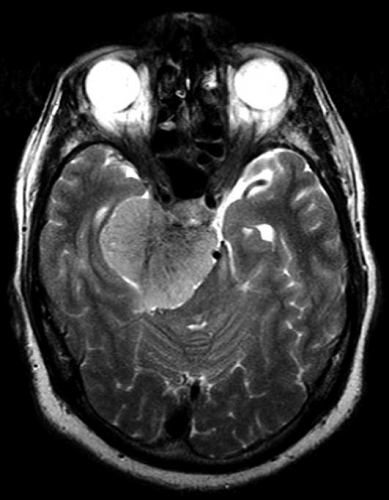
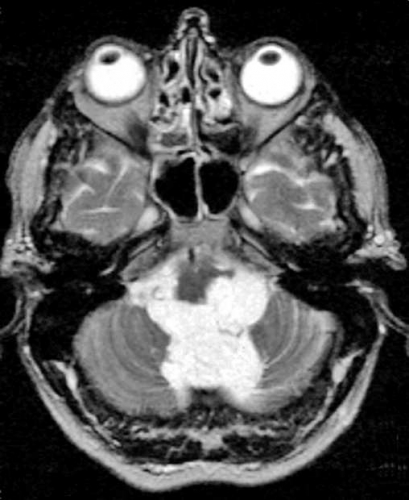
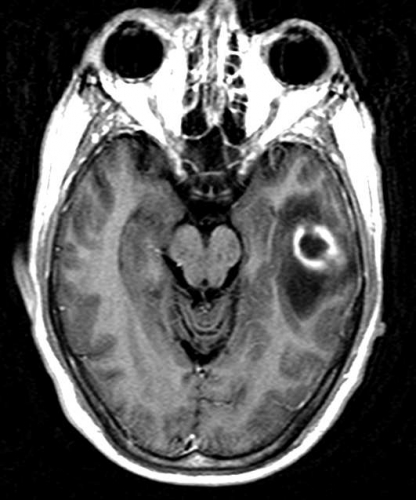
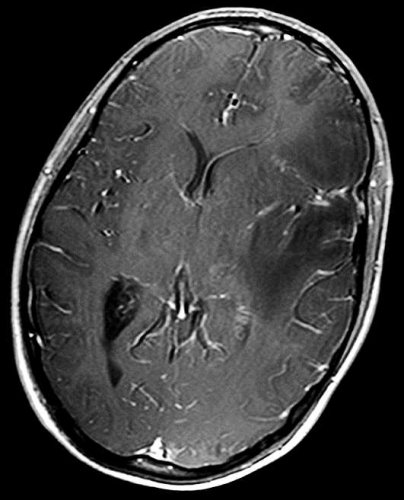
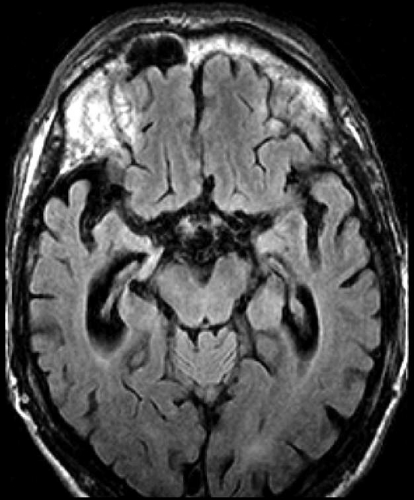
Det cerebrala blodflödet är som regel också högt i tumörer med hög regional cerebral blodvolym. De flesta maligna gliom har barriärskada kombinerat med hög perfusion (Figur 2). Områden med kontrastuppladdning (barriärskada) i maligna gliom sammanfaller emellertid inte alltid med den högsta perfusionen, då man även kan se stort kontrastläckage (barriärskada) i områden med tumörkärl med komplex mikrovaskulär hyperplasi och partiell trombotisering utan ökning av perfusionen [5]. Vid postradiologisk nekros ses också kontrastuppladdning kombinerat med låg perfusion. Intracerebrala metastaser har som regel hög perfusion, medan durala metastaser ofta har låg perfusion (Figur 4). Även rikligt vaskulariserade benigna tumörer kan ha hög perfusion, tex meningeom (Figur 5) och hemangioblastom. Lymfom och schwannom har oftast låg perfusion [1].
Intrakraniella tumörers relation till vitsubstansbanor
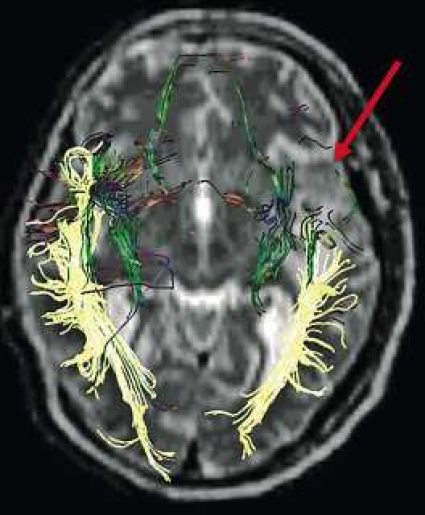
DTI med eller utan traktografi kan användas för preoperativ kartläggning av förloppet av viktiga vitsubstansbanor i förhållande till en intrakraniell tumör [6] (Figur 3 och 4). Detta är ännu inte infört i klinisk rutin men kommer inom snar framtid att bli till stor nytta för neurokirurgen vid planering av det operativa ingreppet. När metoden integrerats i neuronavigationssystem som används under operation kan tumörer sannolikt resekeras mer radikalt utan att skada viktiga funktioner. Metoden blir ett komplement till fMRI (funktionell MR med kortikala aktiveringsstudier) genom att avbilda de banor som binder samman kortikala regioner där viktiga funktioner är lokaliserade. Tumörinfiltration eller avbrott av vitsubstansbanor kan också bedömas på DTI, men i områden med ödem är denna bedömning svår med nuvarande MR-teknik.
Differentialdiagnostik
Araknoidalcystor och epidermoidtumörer har som regel samma signalmönster som cerebrospinalvätska på konventionella T1- och T2-viktade bilder, medan de kan skiljas åt på diffusionsviktade bilder. Araknoidalcystor har hög diffusion (som cerebrospinalvätska eller ibland något lägre på grund av proteininnehåll), medan epidermoidtumörer har lägre diffusion (jämförbar med hjärnparenkym). På en diffusionsviktad sekvens har epidermoidtumörer kraftigt förhöjd signal på grund av kombinationen av relativt låg diffusion och mycket lång T2-relaxationstid, som skiner igenom (Figur 6).
Tumefaktiv MS har som regel mycket lägre perfusion i den kontrastuppladdande perifera delen än maligna tumörer, vilket kan vara till nytta vid differentialdiagnostiska svårigheter. Den centrala nekrosen i tumefaktiv MS har hög diffusion, som en malign tumör (jämför abscess).
Central nekros i en malign tumör har oftast hög diffusion (Figur 2), medan nekros i en obehandlad abscess är mer viskös och har nedsatt diffusion [7] (Figur 7), se nedan. Falskt negativ abscessdiagnos på diffusionsviktad sekvens har beskrivits i ett mindre antal fall, men detta är sällsynt. Falskt positiv abscessdiagnos förekommer också, då vissa metastaser kan ha nedsatt diffusion i centrum. Tumör med blödning i central nekros kan också ha nedsatt diffusion och försvåra differentialdiagnostiken. Konventionella MR-sekvenser kan dock oftast klarlägga att det rör sig om blödning. Perfusions-MR kan vara till nytta, eftersom abscesskapseln är dåligt vaskulariserad och därmed har låg perfusion, medan den perifera delen av en malign tumör har hög perfusion, som nämnts ovan [8].
Postradiologisk nekros och malign tumör kan vara svåra att differentiera på konventionell MR, då båda ofta uppvisar kontrastuppladdning. Perfusions-MR visar låg perfusion vid postradiologisk nekros men hög vid malign tumör.
Bedömning av behandlingseffekt
Diffusions-MR har i longitudinella forskningsstudier visats kunna prediktera respons hos maligna tumörer, då tidig behandlingseffekt är associerad med ökning av diffusionen (förhöjning av ADC) [9]. Hos en malign tumör med hög perfusion kan behandling potentiellt reducera neoangiogenes och vaskularisering, vilket kan ses som reduktion av perfusionen.
Intrakraniell infektion och inflammation
Den centrala nekrosen i en obehandlad abscess har som regel nedsatt diffusion, vilket ses som hög signalintensitet på en diffusionsviktad bild och nedsatt signal på ADC-karta [7] (Figur 7). Abscesskapseln, som uppvisar kontrastuppladdning på konventionell MR, har som regel låg perfusion.
Vid encefalit kan man se nedsatt diffusion i grå substans på grund av att cellerna svullnar vid virusangreppet (cytotoxiskt ödem). Detta är oftast kombinerat med vasogent ödem med hög diffusion i intilliggande vit substans. Perfusionen kan vara hög, tex i kortex, vid hyperemi vid akut encefalit (Figur 8). MS-plack har oftast hög diffusion, men akuta lesioner kan ha låg diffusion på grund av tätt packade inflammatoriska celler [10]. DTI med traktografi kan påvisa skador på vitsubstansbanor vid axonförlust och demyelinisering, men detta används ännu inte kliniskt. MS-plack med akut inflammation kan ha ökad perfusion, men detta har inte heller fått någon klinisk tillämpning ännu [11]. Potentiellt skulle det kunna användas för att prediktera sjukdomsaktivitet och för att monitorera terapieffekt.
Epilepsi
Reversibel diffusionsnedsättning kan ses i kortex och i subkortikal vit substans vid status epilepticus och långdragna eller upprepade epileptiska anfall. Uppföljande MR-undersökning kan avskriva misstanken om akut infarkt på en MR-undersökning med diffusionssekvens med nära tidsrelation till de epileptiska anfallen. Man kan potentiellt också använda MR med diffusion och perfusion för att stödja EEG-lateraliseringsdiagnostik vid terapiresistent temporallobsepilepsi utan påvisad lesion på morfologiska MR-sekvenser. Detta är ännu på forskningsstadiet. Vid epilepsi orsakad av kortikala missbildningar (malformation of cortical development, MCD) kan DTI potentiellt påvisa mikrostrukturella avvikelser i underliggande vitsubstansbanor. Funktionsnedsättning kan därmed förklaras av en kombination av abnorm kortex och nedsatt konnektivitet via vitsubstansbanor. Också detta är på forskningsstadiet.
Neurodegenerativa sjukdomar
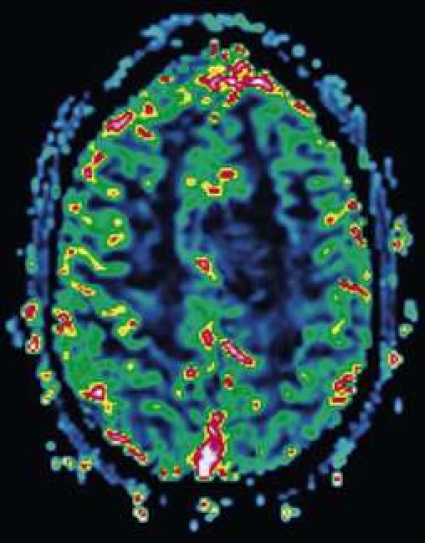
Patienter med Alzheimers demens har kortikal degeneration med nedsatt cerebralt blodflöde i temporo-parietala kortex och posteriora gyrus cinguli och i mindre grad i frontala kortex [12, 13]. Detta kartläggs ofta med isotopmetoder men kan också visas med perfusions-MR (Figur 9). Patienter med fronto-temporallobsdemens har hypoperfusion i frontal- och temporalloberna och kan därför med perfusions-MR skiljas från patienter med alzheimerdemens [13]. När den icke-invasiva MR-perfusionsmetoden ASL (se ovan) optimerats och fått ökad klinisk användning kommer den sannolikt att få stor betydelse för radiologisk utredning av demenspatienter. Vid alzheimerdemens åtföljs den kortikala degenerationen av vitsubstansreduktion, som kan vara wallersk degeneration och/eller orsakad av ischemi.
Vitsubstansförändringar kan detekteras tidigare i sjukdomsförloppet med DTI än med konventionella MR-sekvenser [14]. Vid gruppstudier har man påvisat lägre FA-värden på DTI i temporal vitsubstans, i gyrus cinguli och posteriora delen av corpus callosum hos alzheimerpatienter än hos normala kontroller. Detta överensstämmer med det mönster av regional kortikal neuronundergång som typiskt ses vid alzheimerdemens och kan därför vara sekundärt till axonal skada, i sin tur sekundärt till neuronundergång. Dessa forskningsrön kan potentiellt utvecklas till ett framtida redskap för tidig detektion av alzheimerdemens. Man har också funnit högre ADC-värden i parietal vit substans hos patienter med lindrig kognitiv störning?(MCI, mild cognitive impairment) än hos normala kontrollpersoner [15]. Diffusions-MR med DTI har också högre sensitivitet än konventionell MR för att detektera vitsubstansförändringar vid vaskulär demens.
Vid amyotrofisk lateral skleros (ALS) kan man använda DTI med traktografi för att visualisera och volymbestämma tractus corticospinalis [16]. Man kan påvisa nedsatt volym på dessa banor hos ALS-patienter sekundärt till axonal degeneration.
Vid sporadisk Creutzfeldt–Jakobs sjukdom (CJD) ses ofta nedsatt diffusion i kortex och ibland i basala ganglier utan att man kan detektera något patologiskt på andra MR-sekvenser. Signalförändringarna involverar vanligen kortex nära medellinjen samt i insula, cingulum och gyrus frontalis superior [17]. Diffusionssekvens är känsligare än FLAIR(fluid attenuated inversion recovery)-sekvens för detektion av dessa förändringar. Den kliniska frågeställningen är sällan CJD, varför diagnosen, som ju är sällsynt, kan misstänkas först då man ser diffusions-förändringarna på MR. Om alla MR-undersökningar av hjärnan innehåller också en diffusionsviktad sekvens underlättas diagnostiken av denna och flera andra sjukdomar.
Skalltrauma
Skallskador kan leda till uttalade, sena kognitiva problem trots att man endast påvisat mindre förändringar på DT och konventionell MR. Diffusionsviktad MR kan avslöja lesioner orsakade av diffus axonal skada trots att konventionell MR ibland kan vara helt normal [18]. DTI kan påvisa uttalad reduktion av anisotropin, speciellt i subkortikal vit substnas frontalt och temporalt och i corpus callosum motsvarande en diffus axonal skada. Ofta ses lesioner med cytotoxiskt ödem (nedsatt diffusion) tillsammans med lesioner med vasogent ödem (ökad diffusion) (Figur 10). Kombination med små hemorragiska lesioner är relativt vanligt, och dessa orsakar ofta signalbortfall på såväl diffusionsviktad bild som ADC-karta (artefakt på grund av blodprodukter).
DWI används kliniskt för att detektera cerebrala lesioner (ofta diffus axonal skada) på intensivvårdspatienter som inte vaknar som förväntat efter skalltrauma. DTI kommer säkert att kunna bidra ytterligare till denna diagnostik inom en nära framtid. Perfusions-MR har hittills haft begränsad användning på patienter med skallskada. Någon studie har visat sämre kliniskt resultat hos patienter med nedsatt cerebral blodvolym i subakut skede efter skallskada än hos patienter med normal perfusion vid i övrigt normal MR-undersökning i båda grupperna. Vid barnmisshandel kan DWI och DTI också detektera vitsubstansskador med större sensitivitet än konventionell MR och kommer sannolikt att kunna bli ett kliniskt redskap.
Konklusion
Diffusions-MR med DWI av hjärnan har redan utbredd klinisk användning för många frågeställningar förutom stroke. DTI och traktografi har hittills används huvudsaklingen för forskning men kommer inom en nära framtid att få kliniska tillämpningar. Perfusions-MR används allt mer för klinisk diagnostik i och med att postprocessning av bilderna blivit snabbare och lättare att utföra. Tillägg av perfusions-MR kommer att ytterligare förbättra den diagnostiska specificiteten vid många sjukdomstillstånd.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.