Sammanfattat
Ekokardiografi och mobil myokardskintigrafi är lätta att använda vid sängkanten på akut- och infarktvårdavdelning och kan styra patientflödet.
Akut myokardischemi kan påvisas som nedsatt regional väggrörlighet och/eller perfusion med både ekokardiigrafi och ektomografi.
Kvantitativ myokardrörlighetsanalys underlättar och minskar subjektiviteten i ischemidiagnostiken.
Ekokardiografi (eko) är i dag den mest använda diagnostiska bildtekniken för kombinerad funktionell och morfologisk diagnostik vid i stort sett alla former av hjärtsjukdom. Den erbjuder den ideala sängkantsdiagnostiken vid misstanke om såväl akut koronart syndrom (akut hjärtinfarkt eller instabil kranskärlsjukdom) som stabil kranskärlssjukdom och rekommenderas som primär vägledande grundundersökning vid möjligt akut koronart syndrom om EKG och biomarkörer inte är diagnostiska [1]. Den finns tillgänglig på de flesta platser inom sjukvården, är fullt mobil, relativt billig, ofarlig och kan också användas för monitorering eller långtidsuppföljning.
Begränsande faktorer med traditionellt eko är att bildtolkningen är subjektiv och kvalitativ. Diagnostikens sensitivitet, specificitet och prediktiva värde är starkt erfarenhets- och användarberoende för både manuell registrering och visuell tolkning. Vid diagnostik av kardiella effekter utlösta av kranskärlssjukdom ses tex
• stor variation mellan olika centrum och mellan mer eller mindre erfarna användare vad gäller visuell bedömning av vänsterkammarrörlighet [2],
• sämre diagnostik utan tidigare bilder »side-by-side«, eftersom vänsterkammarrörligheten är åldersberoende och varierar mellan individer, inte minst avseende AV-klaffplan [3],
• inte sällan behov av kontrast för visualisering av vänsterkammartromb och adekvat endokardiell utlinjering [4].
Intravenös kontrast i form av oscillerande mikrobubblor i blodpoolen, och som passerar lungcirkulationen, finns i dag att tillgå i Sverige (svavelhexafluoridgasinnehållande Sonovue eller perflutrengasinnehållande Luminity), men används sparsamt. De är godkända för att underlätta utlinjeringen av endokardiet, men senare års misstänkta biverkningar gör att de används restriktivt i akuta sammanhang, vilket tillsammans med priset bidrar till begränsad spridning.
Vid misstänkt eller känd hjärtsjukdom används eko framför allt för att bedöma global och regional vänsterkammarfunktion och -dilatation (ofta förknippad med hjärtsviktssymtom). Den kanske enskilt viktigaste prognostiska markören är vänsterkammarens uppmätta ejektionsfraktion (EF) [5]. Traditionellt bestäms denna från tvådimensionella (2D) bilder men tredimensionellt (3D) eko har i flera studier visat sig överlägsen 2D EF-bestämning [6]. Eko kan styra behandling; exempelvis har vissa hjärtmediciner indikationsgränser utgående från ekokardiografiska mått [7] och ekodata är indikativa för invasiv behandling vid tex högspecialiserad elektrofysiologi, biventrikulär pacemaker och intrakardiell defibrillator [8, 9]. För primär och sekundär klaffsjukdom är eko både helt avgörande för att bedöma behov av operation och styrande för val av operationsmetod [10].
Ekokardiografi vid akut koronart syndrom
2D-eko har utvecklats till att bli ett primärt diagnostiskt hjälpmedel med prognostisk och terapistyrande verkan, då det har potential att fungera som vattendelare mellan högriskpatienter och lågriskpatienter med akuta bröstsmärtor utan högriskmarkörer på akutmottagningen [11, 12]. Regional rörelsestörning beskrivs i princip vid alla hjärtinfarkter [13]. Riskytan överskattas initialt efter infarkt, då den innehåller även viabla områden. Regional väggrörelsepåverkan har ett stark prognostiskt värde. Normal väggrörlighet identifierar friska patienter med stor säkerhet, där det negativa prediktiva värdet i studier till och med är bättre än traditionell riskvärdering med inläggning för observation med EKG-övervakning och seriella laboratorieanalyser av hjärtskademarkörer [11].
Problemet med visuell regional väggrörelsebedömning är subjektiviteten [2], varför man söker objektiva kvantitativa utvärderingstekniker. 3D-ekot brottas ännu med temporala upplösnings- och bildkvalitetsproblem, begränsad tillgång till apparatur, bearbetningsprogram, visualiseringsalgoritmer etc. 3D-ekot har redan visats vara överlägset för EF-bestäming [6], och med nya matrixprober för både transtorakal och transesofageal diagnostik förutspås dock 3D-ekot en ljus framtid vad gäller bedömning av såväl regional som global vänsterkammarfunktion.
Kranskärlsflödesmätning med doppler. Kranskärlsflöde kan med moderna ultraljudsapparater i dag visualiseras och mätas direkt i kranskärlen [14]. Tekniken har använts framgånsrikt för att detektera ocklusioner eller spontan reperfusion, vilket sker i 10–30 procent av ST-höjningsinfarkter, innan kateterintervention hinner utföras [15]. Tekniken är speciellt användbar vid framväggsinfarkter men något svårare vid bakväggsinfarkter eller mindre hjärtinfarkter, beroende på att det främre nedåtstigande kranskärlet (LAD) och de apikala perforanterna är enklast att visualisera. Metoden är dock något svårtillgänglig och kräver högspecialiserad kunskap och stor erfarenhet, vilket bidrar till den begränsade användningen.
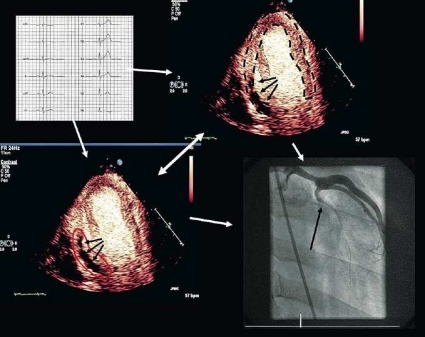
Kontrasteko. Myokardiell kontrast beskrevs efter aortarotsinjektion 1983 medan myokardiell kontrast efter intravenös injektion beskrevs första gången 1990. Med kontrasteko kan man detektera perfusionsdefekter i myokardiet vid akut koronart syndrom redan innan biomarkörer finns tillgängliga (Figur 1). I kombination med ett poängsystem av typen TIMI-scoring har kontrasteko visats bättre prediktera kort- och långtidsprognos än klinisk bedömning inklusive EKG och biomarkörer, och >99 procent negativt prediktivt värde rapporteras för hjärthändelser inom 24 timmar [11, 12]. Kontrasteko för värdering av hjärtmuskelns genomblödning kräver dock högspecialiserad kunskap och stor erfarenhet. Försök till kvantitativ perfusionsanalys med kontrasteko pågår och kräver stor användarskicklighet med behov av individuell modifiering av apparatinställning och infusionstakt mm. Även om precisionen ökar då kvantifiering används i vetenskapliga studier så minskar samtidigt antalet bedömbara segment; med andra ord begränsas metoden av minskad tillgänglighet på segmentnivå [16].
Vävnadsdoppler är i dag en enkel och väletablerad metod för kvantifiering av myokardfunktion, med möjlighet att mäta regionala myokardhastigheter och deformation på ett reproducerbart sätt [17] och därmed detektera myokardischemi [18]. Den kanske viktigaste begränsningen är att rörlighet endast kan mätas i en riktning, främst longitudinellt, och att deformations- (strain) och deformationshastighetsmätningar (strain rate) är mindre reproducerbara än hastighet och rörelseamplitud (förflyttning, »displacement«). Variabiliteten mellan bedömare är i de basala segmenten ca 5–7 procent för hastighet/ förflyttning mot 11–13 procent för deformationsmått [19, 20].
Sammantaget gör detta att metoden med stor säkerhet kan användas för att detektera ischemi men har svårare att ange dess lokalisation om man inte kan följa en och samma patient. Ett annat betydande problem är att metoden mäter rörlighet relativt transducern, vilket i praktiken medför att apikal ischemi är svår att detektera. Färgvävnadsdopplertekniken har med sin höga bildåtergivningsfrekvens (över 200 2D-biler av hela hjärtat per sekund) en stor fördel jämfört med andra bildmodaliteter, vilket innebär att man kan mäta myokardrörlighet även i de isovolumetriska faserna. Detta ökar påtagligt möjligheterna att detektera patologiska förändringar i myokardfunktion på ett tidigt stadium. Den positiva isovolema maxhastigheten (preejektion) minskar redan då kranskärlsflödet reduceras med 30 procent och vänder efter 5 minuter kranskärlsocklusionen. Hos en patient med nylig infarkt har positiva isovolema hastigheter inom områden där rörligheten är nedsatt prognostiserat återhämtning av funktion efter revaskularisering [21].
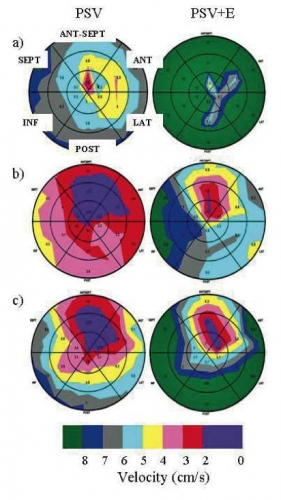
En ny kvantitativ visualiseringsmetod baserad på vävnadsdoppler är under utveckling i samarbete mellan KTH och Karolinska Universitetssjukhuset Huddinge. Metoden använder diskreta färgskalor för att avbilda myokardfunktion i bull´s eye-diagram (Figur 2). Denna teknik ger en intuitivt lättförståelig 3D-samlad bild av regional myokard- och deformationshastighet [22].
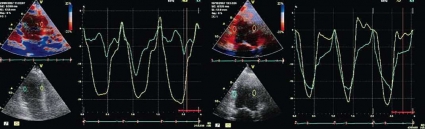
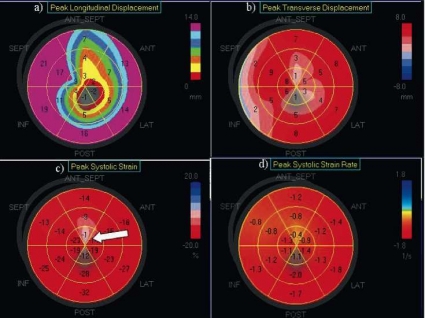
Speckle tracking. Reflektorbaserad teknik används vid sk speckle tracking för att följa specifika punkter (speckles) från bild till bild i gråskalesekvensen. Från den uppmätta förflyttningen i ett stort antal punkter kan hastighet, riktning och deformation beräknas (Figur 3). Preliminära data visar god reproducerbarhet [23]. Alla rörelseriktningar kan här återskapas, vilket ger en fördel framför vävnadsdopplerbaserade mätningar. Begränsningen ligger främst i bildåtergivningsfrekvensen, vilket gör metoden olämplig vid högre hjärtfrekvens. Speckle tracking är i dag kommersiellt tillgänglig i olika varianter hos de tre största ultraljudstillverkarna. Även speckle tracking kan presenteras i bull´s eye-format, vilket ger en snabb 3D-överblick av regional hjärtfunktion, exemplifierat i Figur 4, där visuell bedömning inte visade någon väggrörelsestörning.
I Linköping pågår en studie där ekokardiografi med färgvävnadsdoppler och speckle tracking utförs på patienter med ST-höjningsinfarkt inför kateterintervention. Syftet är att bedöma om utbredningen av väggpåverkan kan relateras till slutlig infarktstorlek bedömd med MR-undersökning av hjärta sex veckor senare respektive om undersökningen kan utföras utan att fördröja interventionen. Viss patientmedverkan fordras, tex registrering i apné, som är nödvändig för all kvantitativ väggrörelsebedömning, vilket knappt 75 procent av patienterna klarar. Själva ekoregistreringen av de tre apikala vyerna på interventionslaboratoriet tar 2 minuter (medel), och total probtid per patient är 2,5 minuter. I de allra flesta fall erhålls bilder av tillräckligt god kvalitet för visuell bedömning, och kvantitativ analys sker i efterhand.
Ekokardiografi vid stabil kranskärlssjukdom
Att subakuta eller sena effekter av ischemisk hjärtsjukdom och/eller tidigare genomgången infarkt företrädesvis diagnostiseras med eko är känt sedan länge. Exempel på sådana effekter är postinfarktperikardit, infarktens utbredning (tex diastolisk förtunning, regional dilatation), mitralisinsufficiens [24] (papillarmuskelruptur eller restriktivitet i chordae sekundär till vänsterkammardilatation eller ischemi i papillarmuskel), septumruptur (VSD), kammartromber, kammaraneurysm eller pseudoaneurysm. För diagnos av vänsterkammaraneurysm ska diastolisk omformning föreligga [25]. Hjärtmuskel som förtunnas (remodellering) efter infarkt har negativ prognostisk innebörd [25]. De ekokardiografiska teknikerna som används är desamma som beskrivs vid akut koronart syndrom; vid misstänkt stabil kranskärlssjukdom tillämpas de även under farmakologisk eller fysisk stress.
Hibernerande myokard. En viktig faktor vid utredning av kronisk ischemisk kardiomyopati med nedsatt vänsterkammarfunktion är detektion av hibernerande myokard (definieras här som myokard med nedsatt kontraktilitet på basen av kronisk ischemi och förbättringspotential vid revaskularisering). Även om det fortfarande saknas prospektiva, randomiserade interventionsstudier finns det starka observationella data som entydigt talar för att det finns ett stort prognostiskt värde i att revaskularisera ett hibernerande myokard, medan revaskularisering saknar effekt (eller till och med kan förvärra prognosen) hos kranskärlssjuka patienter med nedsatt vänsterkammarfunktion utan påvisbart hibernerande myokard [26]. Hibernerande myokard kan detekteras på principiellt flera sätt: 1) som metabol viabilitet, vilket indikerar förekomst av levande viabla myocyter (skintigrafi, PET) alternativt icke-viabelt myokard (late enhancement-tekniken med MR), 2) som kapillär integritet vid kontrastekokardiografi [27] och 3) som förekomst av kontraktil reserv vid dobutaminstresseko.
Noteras bör att viabilitet inte är liktydigt med möjlig reversibel funktionspåverkan. Även viabla myocyter kan degenerera så att den kontraktila apparaten inte kan återställas, och om en alltför stor del av myokardväggen är död förbättras inte kontraktiliteten efter revaskularisering. På grund av olika principiella detektionssätt varierar sensitivitet och specificitet avseende återkomst av kontraktilitet;tex uppvisar metabola metoder och kapillär integritet hög sensitivitet/låg specificitet (ca 90/60), medan detektion av kontraktil reserv ger något lägre sensitivitet men högre specificitet (85/80)[28]. Vävnadsdoppler har också potential, då den höga tidsupplösningen har visat sig kunna avslöja kontraktionsökning i isovolumetrisk kontraktionsfas regionalt, vilket är ett högsensitivt tecken på viabilitet [29].
Ischemidiagostik. För att påvisa utveckling av ischemi i hjärtmuskel används ofta provokationstest, och de rekommenderas framför allt för lågriskpatienter med misstänkt kranskärlssjukdom [30]. Exempel på provokationsmetoder är fysiskt arbete (liggande eller sittande cykling), pacemakerstimulering, medikamentell stimulering (framför allt med dobutamin) eller vasodilation (adenosin eller dipyridamol) som utlöser stöldfenomen. De vasodilatatoriska principerna fordrar bestämning av genomblödning för att nå samma diagnostiska säkerhet som tex med dobutamin [31]. Ekokardiografi under stress har framför allt högre specificitet än tex arbetsprovs-EKG, och dobutamin anses av många vara den bästa provokationen för ekokardiografi, särskilt på grund av bättre bildkvalitet och då många patienter är oförmögna att fullfölja fysiskt arbete tillräckligt länge [32].
Resultat i nyare studier som utnyttjar vävnadsdoppler visar att sensitiviteten och specificiteten för lågriskpatienter är jämförbara med dem vid gammakamera-SPECT [33]. Den visuella tolkningen kompletteras också ofta i dag med vävnadsdoppler för att minska subjektiviteten i bedömningen. Ischemiska tecken är lägre ökning av maximala hastigheter (normalt basalt från 5 cm/s i vila till 12 vid maximalt arbete [18, 19]), försenad förtjockning, lägre deformation och lokal utveckling av postsystolisk förkortning [21]. Kontrastekokardiografi för utlinjering av vänsterkammare används rutinmässigt på flera ställen, särskilt utomlands, för att säkerställa god bildkvalitet. Sk real-time perfusion imaging med kontrastekokardiografi med eller utan adenosin har bevisligen större diagnostisk säkerhet än arbetsprovs-EKG, men användarberoendet och kvantifieringsproblemen försvårar användningen.
Ektomografi, myokardskintigrafi
Enligt SBU [34] ger isotopbaserade metoder som åskådliggör myokardgenomblödningen den bästa prognostiska informationen vid kranskärlssjukdom. Redan på 1980-talet konstaterades att risk för återinsjuknande efter infarkt identifieras bättre av ischemitecken vid myokardskintigrafi (94 procent), än vid angiografi (71 procent) och arbets-EKG (58 procent) [35]. Myokardskintigrafi i vila utförd akut under pågående bröstsmärta hos tidigare kranskärlsfrisk person har ett negativt prediktivt värde för akut koronart syndrom på >99 procent [36], är kostnadseffektivt [37] och har länge rekommenderats i amerikanska riktlinjer, och får nu acceptans även i de svenska nationella riktlinjerna från 2008 [1]. Dess negativa prediktiva värde för hjärthändelse per år är även för stabil kranskärlssjukdom 99 procent. Att metoden fungerar bra som gallringsinstrument även vid stabil kranskärlssjukdom visar en nyligen genomförd dansk studie på patienter som genomgick koronarangiografi [38]. 50 procent av patienterna saknade ischemi på skintigrafi (utfördes utan att påverka handläggningen), och 20 procent av dessa patienter genomgick revaskulariserande ingrepp. Trots goda diagnostiska och prognostiska resultat görs här i Sverige myokardskintigrafi på 2 procent av kranskärlssjuka jämfört med hos 50–70 procent i USA [34].
I ett nyligen genomfört masterarbete vid medicinsk-tekniska institutionerna vid KI och KTH har man visat att användning av ett isotopsystem som »gate-keeper« vid akutmottagningen på Karolinska Universitetsjukhuset i Huddinge skulle spara 20–70 miljoner kr per år. Tillgängligheten nationellt är i dag generellt relativt låg och vanligen begränsad till dagtid. I ett pågående forskningsprojekt byggs en prototyp av en mobil gammakamera (ektomograf) som gör isotopundersökningar lättillgängliga vid sängkanten även för patienter med akuta bröstsmärtor. Här framställs 3D-skintigrafiska bilder från en fast kameraposition genom att rotera bländaren (kollimatorn), som är tillverkad med snedställda hål. Bilden rekonstrueras genom att objektet betraktas ur varierande sneda vinklar.
Konceptet har sitt generiska ursprung i en metod framtagen för röntgenavbildning av Paul Edholm i Linköping. Genom en kombination av bra hårdvara och nyframtagna iterativa insamlings- och rekonstruktionsalgoritmer [39-41] kan kameran avbilda hjärn- eller hjärtgenomblödning på 2,5–3 minuter. Systemet har jämförts med gängse SPECT-system i knappt 800 patientundersökningar och ger likvärdig information som den fasta SPECT-gammakameran, som har 20 minuters insamlingstid eller mer [42]. Vi tror därför att detta system kan vara en framtida väg för att överföra kranskärlsutredning från anatomiskt tänkande till ett mera funktionsbaserat tänkande.
Konklusion
Sammanfattningsvis finns flera kompletterande sängkantstekniker för att detektera akut myokardischemi. Den största begränsningen i traditionell teknik ligger i användarberoende och subjektivitet. Flera nya kvantitativa metoder är i olika faser av utveckling och kan potentiellt användas för diagnostik och riskstratifiering, men värdet av dessa metoder behöver bedömas i kliniska studier innan metoderna tas i bruk som generellt beslutsstöd i det kliniska rutinarbetet.
*
Potentiella bindningar eller jävsförhållanden: Författarna har forskningssamarbete med GE Healthcare och Siemens avseende ekokardiografi. Lars-Åke Brodin är delägare i Adolesco AB, som kommer att marknadsföra ektomografen.