Sammanfattat
Magnetisk resononanstomografi (MR) kan avbilda hjärtats morfologi och funktion samt mäta flödet i de stora kärlen icke-invasivt och utan joniserande strålning.
Därför har MR sedan 1980-talet varit speciellt användbart vid medfödda hjärtfel och hjärttumörer.
De senaste årens tekniska utveckling har gjort hjärt-MR till ett kliniskt verktyg vid en rad andra hjärtsjukdomar; tex kan en hjärtinfarkt lokaliseras och storleksbestämmas med MR.
MR kan dessutom användas vid diagnostik av kardiomyopati, myokardit och stressutlöst ischemi.
Den snabba utvecklingen av magnetisk resonanstomografi (MR) har gjort att MR-tekniken i dag kan användas för att diagnostisera en lång rad hjärtsjukdomar. MR-kameran kan avbilda hjärtats funktion och morfologi, mäta blodflödet genom klaffar och kärl samt avbilda och kvantifiera infarkt och inflammation i hjärtmuskulaturen. (För beskrivning av MR-fysiken se Faktaruta.)
Det finns en mängd publikationer som beskriver MR-tekniken vid olika sjukdomar, men nu behövs kontrollerade studier som utvärderar den kliniska nyttan av tekniken vid olika sjukdomstillstånd.
Vid MR används inte joniserande strålning, vilket gör att MR lämpar sig särskilt väl vid kontroll av barn och vuxna med kongenital hjärtsjukdom. Dessa patienter genomgår flera undersökningar genom livet, och den samlade stråldosen bör hållas så låg som möjligt.
Denna artikel ger en översikt av de olika möjligheter som MR-kameran ger vid diagnostik av olika former av hjärtsjukdom.
Morfologi
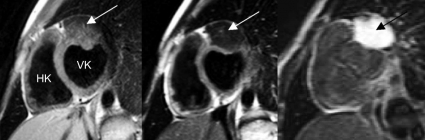
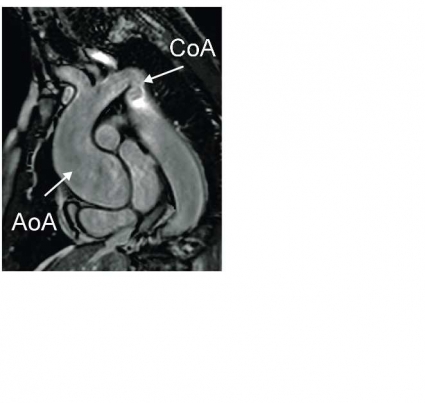
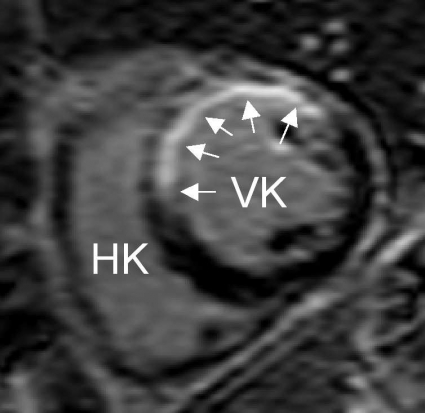
MR-kamerans möjlighet att ge vävnadskarakterisering och detaljerad anatomisk information har gjort att tekniken använts sedan 1980-talet för visualisering av de intratorakala kärlen och för att kartlägga anatomin vid kongenitala hjärtfel. Dess-utom kan MR användas för att utreda avvikande fynd som påvisats vid ekokardiografi (Figur 1) eller datortomografi, exempelvis kardiella tumörer (Figur 2) och tromber. Morfologisk kartläggning av kranskärlsanomalier kan göras, men MR har ännu inte tillräcklig upplösning för att säkert diagnostisera kranskärlsstenoser.
Gränsen mellan funktionell och morfologisk diagnostik är inte skarp; vid utredning av tumörer och kongenitala hjärtfel används i dag också rörliga funktionsbilder och kontrastförstärkt MR-angiografi.
Funktion
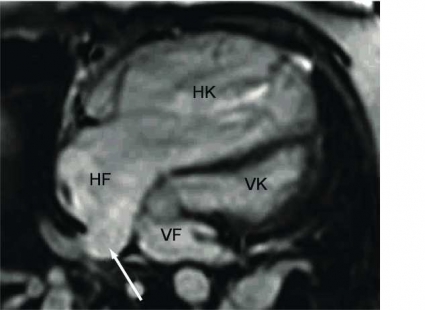
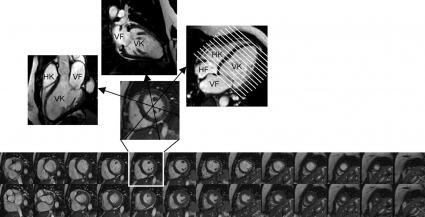
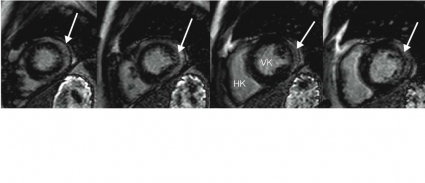
Vid funktionsbedömning tas rörliga bilder av hjärtats kontraktion och fyllnad under hjärtcykeln; ofta tas 30 bilder per hjärtcykel. Dessutom kan MR-bilder tas i valfritt plan i kroppen, och hjärtat brukar avbildas i vänsterkammarens tre olika längsaxelplan samt kortaxelplan (Figur 3) [1]. I längsaxelbilderna kan klaffplansrörelsen och klaffarna bedömas. Kortaxelbilder tas parallellt mot varandra och täcker hela den tredimensionella volymen av hjärtat. Från kortaxelbilderna kan de olika hjärtrummens volymer beräknas (Figur 3).
MR ger bilder med hög spatiell upplösning och god kontrast mellan myokard och omgivning i alla fyra hjärtrummen. Detta gör att MR ofta används som referensmetod för kvantitativ bestämning av hjärtvolymer, myokardmassa och ejektionsfraktion [2, 3]. Kammarens väggförtjockning används för att bestämma den regionala hjärtfunktionen.
Flöde
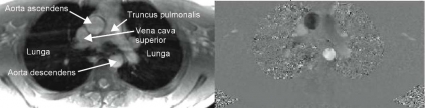
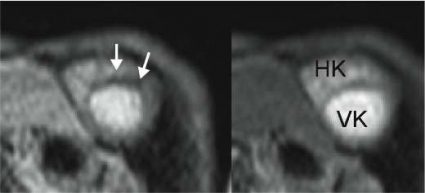
MR kan mäta flödet i stora kärl med hög noggrannhet, mätfelet är enstaka procent [4, 5]. Därför kan MR användas för att mäta hjärtminutvolymen i aorta (Figur 4) och truncus pulmonalis, beräkna vänster- till högershunt som kvoten mellan lung- och systemblodflöde (QP/QS) [6] samt kvantifiera klaffinsufficienser [7].
Till skillnad från ekokardiografi mäts flödet i ett tvärsnitt av kärlet som är vinkelrätt mot kärlets flödesriktning. Flödeshastigheten beräknas för hela kärlarean och för hela hjärtcykeln, vilket innebär att volymflödet bestäms med hög precision. För bestämning av den maximala flödeshastigheten över en stenos är dock ekokardiografi en bättre metod.
Klaffinsufficienser kan kvantifieras genom att beräkna framåtflödet i systole och bakåtflödet i diastole. På så sätt kan den volym blod som läcker bakåt beräknas i absolut volym och som den procentandel av slagvolymen som läcker bakåt genom klaffen (Figur 5).
Infarkt- och viabilitetsdiagnostik
Hjärtinfarkt kan visualiseras efter injektion av MR-kontrastmedel både i akut fas och efter läkning med bindvävsärr. Bilderna tas 10–20 minuter efter kontrastinjektionen, och infarkten framträder vit, den »lyser upp«, medan levande myokard blir svart [8-10] (Figur 6).
Signalintensiteten i denna sorts MR-bilder blir högre ju mer kontrastmedel som finns i vävnaden. Kontrastmedlet består av komplexbundet gadolinium, som fördelar sig extracellulärt i kroppen. Infarktområden har högre procentandel extracellulärrum än levande myokard [11, 12]. Detta gör att infarktområden får högre andel kontrast och därigenom högre signal.
Metoden har validerats i djurmodell, och både infarktstorlek och utbredning visar en slående likhet med histologin [8, 9]. Överensstämmelsen i djurstudierna är så bra att MR har blivit den nya referensmetoden för storleksbestämning och lokalisation av hjärtinfarkt, i både akut och kroniskt skede. I en studie på patienter med kliniskt genomgången hjärtinfarkt påvisade MR infarkt hos 94 procent [13]. Dessutom angav MR i 97 procent korrekt lokalisation av infarkten jämfört med akut koronarangiografi. I kontrollgruppen med 11 friska frivilliga och 20 patienter med icke-ischemisk kardiomyopati sågs ingen infarkt.
Sammanfattningsvis är både specificitet och sensitivitet för att påvisa eller utesluta hjärtinfarkt i både akut och kroniskt skede således mycket hög (nära 100 procent) för MR.
En infarkt har samma MR-utseende i både akut och senare skede. För att särskilja dem kan man använda en MR-teknik som avbildar ödem; den akuta infarkten uppvisar ödem som försvinner efter någon månad [14-16].
Indikationerna för infarktbestämning med MR är fortfarande under utvärdering. Det finns visst vetenskapligt underlag för att infarktbestämning med MR kan användas för att avgöra om patienter med hjärtsvikt kommer att förbättra sin pumpfunktion efter revaskularisering med CABG (kirurgisk behandling) eller PCI (kateterburen intervention) [17]. För ett område med helt transmural infarkt görs inga stora vinster med revaskularisering, däremot bör ett område med nedsatt funktion och levande myokard, sk hibernerande myokard, revaskulariseras om möjligt [18-24].
Icke-ischemisk hjärtsjukdom
MR kan användas för att särskilja olika kardiomyopatier och skilja mellan ischemisk och icke-ischemisk orsak till nedsatt pumpfunktion [25]. Samma teknik som vid infarktavbildning används vid diagnostik och utredning av tex hypertrof kardiomyopati, dilaterad kardiomyopati, hjärtsarkoidos och myokardit (Figur 7). Ökad mängd gadoliniumkontrast ses även vid extracellullär inlagring och bindvävsomvandling orsakad av dessa tillstånd.
Utbredningen av MR-fynden används för avgöra genesen. En ischemiskt betingad infarkt har en subendokardiell utbredning och följer kärlanatomin, och fibros av annan genes återfinns ofta epikardiellt och kan ha fläckvis lokalisation [25-27]. Ventrikulära arytmier kan orsakas av arytmogen högerkammarkardiomyopati, och då spelar MR en viktig roll i diagnostiken. Fettinlagring och/eller ärrvävnad kan ses i framför allt höger kammare men ibland även i vänster kammare.
Förutom vävnadskarakteristik bedöms också funktionen regionalt i båda kamrarna. Vid hjärtamyloidos ses en hypertrof kammare med trög tömning och fyllnad, kontrastuppladdning är mer svårbedömd än vid andra kardiomyopatier och kan till och med saknas.
Myokardit är en svår diagnos där biokemiska markörer såväl som endomyokardiell biopsi kliniskt har relativt låg sensitivitet [28-30]. Ekokardiografi kan ge diagnos, men eftersom perikardvätska och nedsatt funktion inte behöver finnas vid myokardit kan ekokardiografi vara falskt negativ. MR är ett relativt nytt diagnostiskt verktyg vid misstänkt myokardit. Studier där endomyokardiell biopsi utförts mot det område i hjärtat där MR funnit patologiska fynd har visat god samstämmighet mellan biopsin och MR [31].
Ischemidiagnostik
Diagnostik av stressutlöst ischemi med MR kan göras med hjälp av dobutamin eller adenosin. Dobutamin-MR använder precis som stressekokardiografi ökande dobutamininfusion för att öka myokardiets inotropi och kronotropi. Om funktionen inte ökar med ökad farmakologisk belastning, tyder detta på ischemi. Vid adenosin-MR studeras myokardperfusion genom en injektion av gadoliniumkontrast där förstapassagen genom myokardiet avbildas. Detta utförs under farmakologisk vidgning av kärlen med adenosin och jämförs med en undersökning utan adenosin (»vila«) (Figur 8). Teknikerna används ännu inte rutinmässigt i Sverige. Till viss del beror detta på att till skillnad från myokardskintigrafi och stressekokardiografi föreligger det ännu inte några stora randomiserande studier som klarlägger nyttan av undersökningen.
Sammanfattning
MR-kameran ger således nya möjligheter till diagnostik av en rad hjärtsjukdomar. Tekniken är i dag en etablerad del av utredningen vid kongenitala hjärtfel hos barn och vuxna samt vid hjärttumör. Ett flertal artiklar har de senaste åren beskrivit nya möjligheter till diagnostik av infarkt och ischemisk hjärtsjukdom, myokardit samt kardiomyopatier. Den kliniska nyttan av tekniken vid dessa tillstånd behöver utvärderas på större patientmaterial i framtida multicenterstudier. Biokemisk utvärdering av hjärtat med MR-spektroskopi vid kliniska frågeställningar kommer sannolikt att bli möjligt i framtiden.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.