Sammanfattat
Leverbiopsi ger information om inflammationsgrad och fibrosmängd.
Med hjälp av leverbiopsi kan cirros, även kompenserad cirros, diagnostiseras.
Biopsi ger också vägledning om huruvida gallvägssjukdom, parenkymskada eller överlappningssyndrom föreligger.
Leverbiopsi konfirmerar eller förkastar den kliniska diagnosen och ger vägledning om prognos samt möjliggör utvärdering av behandling.
Okända förändringar, t ex fettlever och järninlagring, kan upptäckas med biopsi.
Leverbiopsi är motiverad då biopsins utfall förväntas påverka handläggningen av patienten.
Leverbiopsi ingick tidigare närmast rutinmässigt i utredningen av patienter med leversjukdomar. Utvecklingen av specifika diagnostiska markörer har emellertid inneburit att behovet av leverbiopsi för att fastställa etiologi minskat. Möjligheterna att värdera cirrosförekomst röntgenologiskt med DT och ultraljud har också förbättrats.
Ultraljudselastografi (även kallad FibroScan) är en noninvasiv teknik som vunnit stor popularitet i Sydeuropa, och utrustningen finns nu även på flera sjukhus i Sverige. Ultraljudselastografi mäter leverns stelhet, vilken är ett mått på fibrosstadium; en mekanisk puls skickas in i levern, och leverns styvhet utrycks i kPa. Detta värde är direkt korrelerat till fibrosmängd och översätts på en skala till fibrosstadium. Undersökningen tar några minuter.
Dessa icke-invasiva metoder innebär tillsammans att betydelsen av histologisk undersökning för fibrosbedömning successivt minskat. Det görs betydligt färre leverbiopsier i dag än för ett par år sedan. Däremot finns fortfarande inget alternativ till histologisk karakterisering och gradering av inflammation eller till tumördiagnostik.
Leverbiopsi – en invasiv undersökning
Leverbiopsi är en invasiv undersökning med en liten men ändå befintlig risk för komplikationer, t ex blödning och galläckage. Risken är helt acceptabel under förutsättning att det finns en tydlig frågeställning och att utfallet av biopsin på något sätt påverkar den fortsatta handläggningen av patienten. Risken för komplikationer ökar om trombocytnivån understiger 50 × 109/l och/eller PK(INR) > 1,5. I sådana fall bör nyttan av biopsin särskilt övervägas och ställningstagande till profylaktisk behandling med trombocytkoncentrat och koagulationsfaktorpreparat ske.
Transjugulär biopsi är ett alternativ i sådana situationer, eftersom komplikationsrisken minskar när leverkapseln inte penetreras.
Vid misstanke om dilaterade gallvägar begränsar ultraljudsledd punktion risken för accidentell punktion av gallvägarna. I övriga situationer har det inte övertygande kunnat visas att »blinda« leverbiopsier är förenade med högre frekvens av komplikationer än ultraljudsledda.
Tips inför provtagning med leverbiopsi
Indikation/klinisk frågeställning och gärna förmodad diagnos samt resultat av leverprov bör anges på remissen liksom alkoholkonsumtion, diabetes och övervikt eller annan anamnesuppgift som kan leda leverpatologen rätt. Virusserologi anges i tillämpliga fall. Uppgift om autoantikroppar, IgG och IgM, kan underlätta den histologiska diagnostiken.
Mestadels utgörs prov från levern av nålbiopsier: antingen finnål (0,4–0,6 mm) för cytologi (tumörer och fettlever), mellannål (0,8–1,2 mm) eller grovnål (1,4–1,8 mm). Hos vuxna bör grovnål användas vid misstanke om kronisk hepatit: minst 1,4 mm, gärna 1,6 mm. Hos barn anpassas storleken i varje enskilt fall.
För smal nål försvårar cirrosdiagnostiken, eftersom noduli är större än nålens diameter.
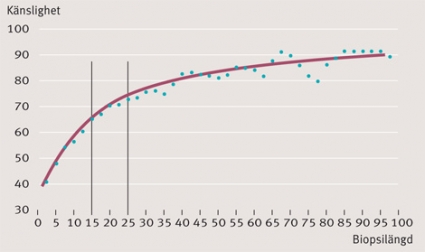
Biopsin bör vara helst 25 mm och innehålla minst 10 portazoner. Större biopsi ger något säkrare diagnos (Figur 1). Vid tumörfrågeställning bör minst två biopsier tas, en från misstänkt tumör och en från förväntat tumörfri vävnad. Detta gäller även vid t ex adenom och nodulär hyperplasi. Om primärtumören är känd vid misstanke om metastas till levern ska detta förstås anges.
Vad gäller kroniska virushepatiter och autoimmun hepatit kan en biopsi besvara två frågeställningar: dels aktivitet, dvs inflammationens utbredning som vanligen anges i en 4-gradig skala [1], dels fibrosstadium som också anges med en 4-gradig skala, där 4 är cirros. Det finns även andra graderingar, men de är mer komplicerade och passar bättre för vetenskaplig utvärdering. Poängsättning är numer rutin för hepatitgradering och ska anges i svaret. Det underlättar jämförelser mellan laboratorier. Enkla kriterier och rikligt med jämförelsematerial kan hämtas från Internet på patologföreningens webbplats (kvastdokumentet »Lever«):
Biopsin ger även möjlighet att påvisa fettlever med eller utan steatohepatit (ASH [alcoholic steatohepatitis] och NASH [non-alcoholic steatohepatitis]) och järninlagring. För autoimmuna gallvägssjukdomar kan biopsin oftast avslöja att det rör sig om en primär gallvägsaffektion och ibland även vilken typ, lite beroende på biopsins kvalitet, sjukdomens progress och anamnestiska uppgifter på remissen.
Problem vid histologisk tolkning av leverbiopsi
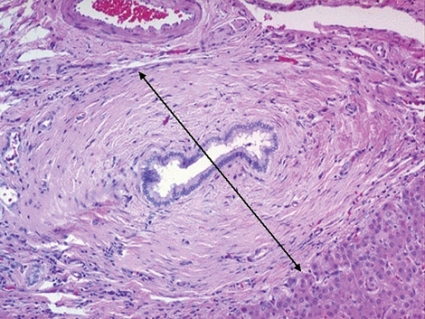
Storlek och kvalitet av biopsin är betydelsefull. Risken för urvalsfel ökar påtagligt om biopsin är kortare än 25 mm och innehåller färre än 10 portazoner (Figur 2). Övertolkning av en liten biopsi är en risk. Det är i allmänhet ganska lätt att sätta en siffra på inflammatorisk aktivitet och fibrosstadium vid en sammanhängande, tekniskt lyckad biopsi. Fragmenterad biopsi inger misstanke om cirros och är svåranalyserad.
Upprepad biopsi är att rekommendera vid autoimmun hepatit. Immunmodulerande behandling har ofta en dramatisk effekt med regress av fibrosmängden även vid tidig cirrosutveckling [2]. Trots normala ALAT-värden kan rebiopsi tre till fem år efter primärbiopsin avslöja ofullständig remission med kvarvarande interfashepatit, och patienten ska då anses underbehandlad.
För primär biliär cirros och primär skleroserande kolangit är värdet av rebiopsi främst att följa hastigheten av fibrosprogressionen. Här kommer sannolikt ultraljudselastografi att kunna användas i framtiden för fibrosbedömning, vilket nu är fallet vid både hepatit C och hepatit B, där denna undersökning kan minska biopsiantalet med upp till 90 procent vid de kliniker som har tillgång till denna teknik. Inflammationsbedömning (aktivitetsgradering) missar man, men det kanske inte gör så mycket vid primär biliär cirros och primär skleroserande kolangit, eftersom tillgänglig behandling anses marginellt påverka inflammationen histologiskt.
Histologisk diagnostik
Autoimmun hepatit. Den histologiska bilden vid autoimmun hepatit (AIH) varierar med aktivitetsgraden (inflammationen), och den ser olika ut vid akut debut (yngre patienter) med ikterus och vid ett mer smygande förlopp (äldre patienter). Oftast ses förändringar som ger starkt stöd för diagnosen autoimmun hepatit, även om fynden inte är specifika. Uppföljande biopsi under behandlingen är väsentlig för att utvärdera om histologisk remission uppnåtts eller om behandlingsmisslyckande/inkomplett svar föreligger [2].
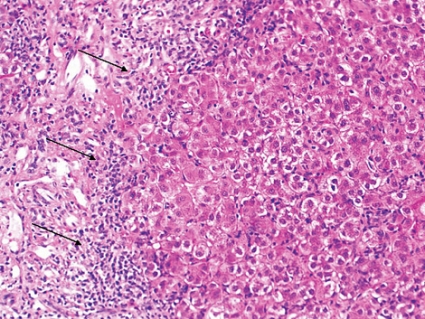
Interfashepatit är ett konstant fynd med infiltrat av lymfocyter och plasmaceller i portazonerna med periportal spridning då inflammationen penetrerar ut i lobuli och leder till hepatocytsvullnad och/eller nekros av leverceller (Figur 3).
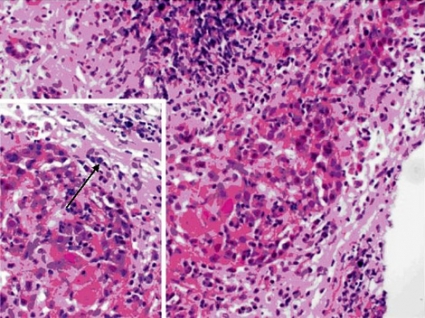
Fokala nekroser av leverceller ses även i lobuli omgivna av lymfocyter och plasmaceller, ibland uttalade sådana som kan leda till kollaps av levervävnad eller bryggnekros (bridging necrosis), som löper från portazon till portazon (Figur 4).
Portal och periportal fibros förekommer, eftersom leverinflammationen alltid pågått i månader innan diagnosen ställs och biopsi tas. Detta fenomen tillsammans med fynden ovan och förekomst av plasmaceller är grundbultarna för den histologiska diagnosen.
Andra histologiska fynd är destruktion av interlobulära gallgångar, kolestas, jättecellstransformation (särskilt hos barn) och rosettbildning av levercellerna, dvs levercellerna formar rosettmönster i stället för att ligga radiärt in mot centralvenen.
Primär biliär cirros. Den histologiska bilden vid primär biliär cirros (PBC) karakteriseras av inflammatoriskt betingade förändringar av de mindre intrahepatiska gallgångarna. Man brukar tala om fyra stadier i utvecklingen mot cirros.
Destruktion av de små intrahepatiska gallgångarna är tidiga förändringar med portal inflammation (CD8 och CD4-celler) och icke-suppurativ kolangit med oregelbundet, svullet gallgångsepitel infiltrat av lymfocyter; detta benämns stadium 1 (Figur 5).
Biliär fibros tillkommer senare i förloppet, stadium 2, förenat med atrofi av gallgångarna och bl a avsaknad av lumen, platt epitel, växlande med gallgångsproliferation. Epiteloidcellsgranulom och lymfoida folliklar ses av och till och stärker diagnosen primär biliär cirros.
Stadium 3 och 4 karakteriseras av tilltagande fibros/cirros och förlust av små gallgångar, medan de lite större sparas.
Differentialdiagnoser är främst autoimmun hepatit och primär skleroserande kolangit, men här ger förekomst av olika autoantikroppar ledtrådar till rätt diagnos. Problemet uppstår när alla ledtrådar saknas. Oftast gäller det då läkemedelsskada som persisterar trots att läkemedlet (t ex dikloxacillin, flukloxacillin, erytromycin, tetracyklin och klorpromazin) är seponerat. Detsamma gäller för en rad neonatala och metabola rubbningar, som går under beteckningen »vanishing bile duct syndrome« och som histologiskt kan likna primär biliär cirros hos vuxna.
Primär biliär cirros progredierar långsamt histologiskt, och de olika stadierna förekommer ofta samtidigt i biopsin. Histologisk stadieindelning av fibrosen annat än vid cirros ger därför osäkert resultat.
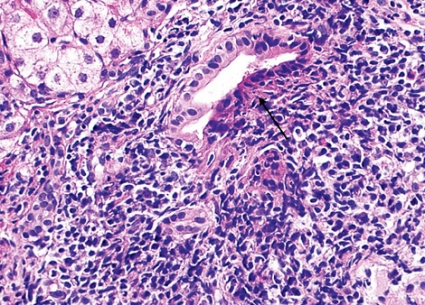
Primär skleroserande kolangit. Primär skleroserande kolangit (PSC) drabbar de extrahepatiska och de större intrahepatiska gallgångarna. Beroende på var leverbiopsin tas i förhållande till förträngningarna i gallträdet kan varierande histopatologiska bilder uppträda (Figur 2). Det finns inga patognomona fynd, och den histopatologiska bilden är okarakteristisk, men fynden ger oftast en ganska säker histologisk diagnos [3]. Om det finns association till inflammatorisk tarmsjukdom, är diagnosen i allmänhet lätt.
Koncentrisk fibros kring mellanstora och större gallgångar, »lökskalsfenomen«, talar starkt för diagnosen och ter sig som periduktal fibros och samtidig degeneration av gallgångsepitelet. Lymfocytär infiltration omger gallgångarna (Figur 6).
Primär skleroserande kolangit progredierar alltid histologiskt (oberoende av behandling) med tilltagande fibros, förlust av gallgångar och utveckling till cirros [4].
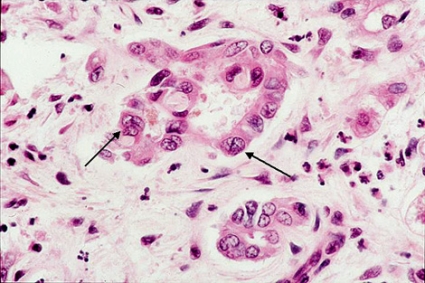
Stor risk för dysplasiutveckling av epitelet och gallgångscancer föreligger, något som endast undantagsvis kan fångas i en leverbiopsi (Figur 7) [6].
De små interlobulära gallgångarna kan förete periduktal fibros, och i avsaknad av radiologiskt (endoskopisk retrograd kolangiografi eller magnetresonanskolangiografi) engagemang av extrahepatiska gallgångar särskiljer man denna form, benämnd »small duct PSC«. Leverpatologen kan inte ställa denna diagnos utan att ha tillgång till utlåtande från magnetresonanskolangiografi eller motsvarande.
Differentialdiagnoser är främst mekanisk gallgångsobstruktion, och man ska vara försiktig med diagnosen primär skleroserande kolangit vid tidigare kirurgi i gallgångarna. Vid primär skleroserande kolangit föreligger en påtagligt stor variation vad gäller framför allt fibrosutveckling, beroende på var biopsin har tagits [7].
Primär skleroserande kolangit kan ha en påtaglig komponent av interfashepatit, och bilden kan då påminna om den vid autoimmun hepatit. Förekomst av uttalad periduktal fibros och förlust av gallgångar liksom inlagring av kopparbindande protein talar dock starkt för primär skleroserande kolangit. Det är inte helt ovanligt att autoimmun hepatit efter många år övergår i en blandform med inslag av såväl autoimmun hepatit som primär skleroserande kolangit, dvs överlappningssyndrom.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.