Sammanfattat
Diagnostik av inflammatorisk tarmsjukdom baseras på en sammanvägning av flera skilda parametrar.
Koloskopi rekommenderas i den initiala utredningen.
MR- alternativt DT-enteroklysma är förstahandsundersökning vid kartläggning av tunntarmen och eventuella fistlar.
Kombinationen av kalprotektin i feces och C-reaktivt protein i plasma är kliniskt användbar för indirekt bedömning av tarminflammation.
Inflammatorisk tarmsjukdom kan inte fastställas med enbart ett blodprov eller en undersökning. Diagnosen bygger i stället på en sammanvägning av sjukhistoria, morfologiska undersökningsmetoder och vävnadsundersökningar, där andra förklaringar uteslutits. Tidsaspekten är också viktig, dvs det kan vara vanskligt att ställa diagnosen vid första insjuknandet. Det finns nämligen flera orsaker till inflammatoriska tillstånd i tunn- och tjocktarmen, där bilden kan påminna om Crohns sjukdom och ulcerös kolit när det gäller kliniskt förlopp, symtom, laboratorieprov, endoskopiska och histologiska förändringar. Diagnosen blir säkrare om sjukdomen visar ett återkommande likartat mönster, s k skov.
I denna artikel kommer vi att diskutera undersökningar vid diagnostik och handläggning av ulcerös kolit och Crohns sjukdom.
Avbildande undersökningar
Endoskopiska undersökningar är det säkraste sättet att detektera sjukdomen, och fördelen med dessa undersökningar är att vävnadsprov kan tas från tarmen för histologisk bedömning. Rektoskopi alternativt sigmoideoskopi är ofta den initiala undersökningen, men i de allra flesta fall behöver denna kompletteras med en koloskopi, vilken helst bör innefatta intubation av terminala ileum.
Den endoskopiska bilden kan hjälpa till att särskilja mellan Crohns sjukdom och ulcerös kolit. Vid ulcerös kolit är den typiska bilden en cirkumferent, kontinuerlig inflammation som breder ut sig proximalt från rektum. Beroende på utbredningen benämns koliten som proktit, vänstersidig kolit, extensiv kolit eller totalkolit. Vid diagnos av ulcerös kolit är sjukdomen begränsad till rektum i ca 30 procent av fallen, ca 40 procent av patienterna har vänstersidig kolit, medan ca 30 procent har extensiv kolit/totalkolit [1].
Till skillnad från ulcerös kolit kan inflammationen vid Crohns sjukdom afficiera hela mag–tarmkanalen och uppträder oftast fläckvis med mellanliggande icke-inflammerad slemhinna. Den typiska inflammationen består av små, »aftösa« ulcerationer eller longitudinella, polygonala (snail-track) ulcerationer. Vid Crohns sjukdom är inflammationen begränsad till kolon hos ca 35 procent av patienterna, ca 25 procent har samtidig aktivitet i terminala ileum och kolon, medan hos ca 30 procent är inflammationen begränsad till enbart terminala ileum [1].
Övre endoskopiundersökningar rekommenderas inte som screening vid Crohns sjukdom, men vid symtom talande för engagemang av övre mag–tarmkanalen är gastroskopi och eventuellt enteroskopi befogat. Dubbelballongenteroskopi är en relativt ny teknik, som gör det möjligt att undersöka en större del av tunntarmen genom att enteroskopet kan fixeras vid tarmväggen. En ballong på enteroskopets spets blåses upp efter intubation och fäster först spetsen, varefter ett flexibelt rör i skopet kan föras ytterligare framåt och låsas med en annan ballong. Genom att växelvis blåsa upp ballongerna och mata fram det flexibla röret kan tunntarmen träs upp på enteroskopet [2].
Det är svårt att endoskopiskt undersöka hela tunntarmen, varför andra metoder såsom leukocytskintigrafi och tunntarmsröntgen med dubbelkontrastteknik har använts. Vid den senare metoden tillförs tarmen kontrast antingen peroralt (enterografi) eller via en nasoduodenal sond (enteroklysma).
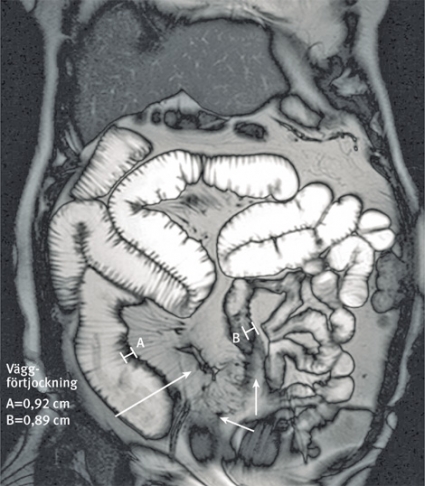
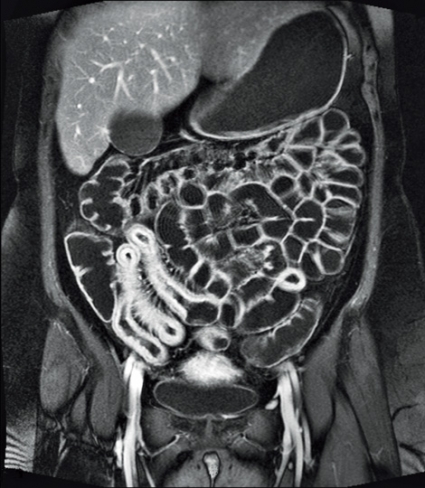
Under senare år har dock nya icke-invasiva metoder med ökad sensitivitet utvecklats. Magnetisk resonanstomografi (MRT) ger en bättre bild av tunntarmen och eventuella fistelsystem. På grund av skillnad i vatteninnehåll i olika vävnader kan MRT differentiera aktiv inflammation från fibros och därmed skilja mellan inflammatoriska och fibrostenotiska lesioner [3]. Eftersom MRT saknar joniserande strålning, är metoden säker att använda vid graviditet och hos personer i reproduktiv ålder (Figur 1 och 2).
Ett alternativ till MRT för kartläggning av tunntarmen vid inflammatorisk tarmsjukdom är datortomografi (DT). En fördel med DT-enteroklysma är den kortare undersökningstiden och att tillgängligheten ofta är högre, även om geografiska skillnader föreligger. En fördel med såväl MR-enteroklysma som DT-enteroklysma är att man förutom tarmväggen också ser komplikationer till sjukdomen. Utöver stenoser och fistlar ses även fibrolipomatös proliferation av mesenteriet som följd av den kroniska inflammationen, lymfadenopati och sekundär peristaltikstörning beroende på aktiv inflammation alternativt kronisk fibros samt MR- och DT-diagnoser av övriga bukorgan, t ex leversteatos, kronisk pankreatit, skleroserande kolangit, gallsten och njursten.
Beroende på lokala förutsättningar rekommenderas därför MR- eller DT-enteroklysma numera som förstahandsundersökningar för kartläggning av tunntarmen [4, 5].
Internationellt sett används ultraljud som ett viktigt diagnostiskt instrument vid inflammatorisk tarmsjukdom. Välutbildade undersökare kan med hög precision visualisera inflammation i såväl tunntarm som kolon. Inflammationen diagnostiseras genom att mäta tjockleken på tarmväggen samt blodflödet via dopplerteknik [6]. Rektalt endoskopiskt ultraljud är också ett alternativ till MRT vid kartläggning av enkla och komplexa perianala fistelsystem. Metoden har dock en begränsning i att den är ytterst beroende av undersökarens skicklighet.
Kapselenteroskopi är en metod där individen sväljer en kapsel innehållande en kamera som skickar bilder kontinuerligt till en bärbar mottagare för senare analys [7]. Metoden är den känsligaste för att detektera lesioner i tunntarmen. Men den höga känsligheten tillsammans med begränsad kunskap kring förekomsten av tunntarmslesioner hos friska individer gör att resultaten ibland är svårvärderade. Specificiteten har därför i jämförande studier visat sig vara låg vid inflammatorisk tarmsjukdom [8]. Nyligen har även en kolonkapsel introducerats på marknaden; kapseln är nu under utprövning. Begränsande faktorer för kapselendoskopi är att metoden saknar möjlighet till biopsitagning, risken att kapseln kan fastna i ett stenoserat tarmavsnitt och den relativt höga kostnaden.
I jämförelse med koloskopi saknar DT-kolon (virtuell koloskopi) möjligheten till fingranskning av tarmslemhinnan samt biopsitagning för histologisk validering, vilket begränsar värdet av DT-kolon som undersökningsmetod vid inflammatorisk tarmsjukdom.
Kombinationen av PET/DT är prövad i mindre serier vid inflammatorisk tarmsjukdom och har visat lovande resultat, men dess kliniska plats är ännu osäker [9].
Undersökningarna kompletterar varandra, och ofta genomgår patienterna flera av dessa avbildande undersökningar för att kartlägga så stor del av mag–tarmkanalen som möjligt.
Laboratorie- och vävnadsundersökningar
Det finns inget blodprov som är specifikt för inflammatorisk tarmsjukdom. Vid mer uttalad inflammation kan man i blodet se en stegring av akutfasproteinerna och en sänkning av albuminvärdet. Ofta är det lättare att hitta ett inflammatoriskt svar vid Crohns sjukdom, medan provfynden vid ulcerös kolit i flera fall är normala. Känsligt C-reaktivt protein (hsCRP) är den akutfasreaktant i klinisk praxis som är mest sensitiv. Denna reaktant har även visat sig korrelera med graden av tarminflammation endoskopiskt [10].
Det finns ett flertal olika genetiska polymorfismer associerade med inflammatorisk tarmsjukdom, men penetransen av varje enskild polymorfism är låg, varför DNA-analyser ännu inte är till hjälp i den kliniska diagnostiken.
Serologiska test av antikroppar mot exempelvis jäststrukturer (ASCA) och cellstrukturer i vita blodkroppar (ANCA) har i forskningssammanhang visat sig användbara för att bl a försöka differentiera mellan ulcerös kolit och Crohns sjukdom men har visat begränsat värde i den kliniska utredningen [11].
Avföringsprov ska alltid ingå i utredningen av patienter med inflammatorisk tarmsjukdom. Det viktigaste är att utesluta en infektiös, i synnerhet bakteriell, gastroenterit, varför en allmän fecesodling och odling för Clostridium difficile bör tas. Vid blodig avföring kan även odling för enterohemorragisk Escherichia coli (EHEC) vara befogad. I åtanke bör även finnas diagnostik för parasiter och amöbor i avföringen.
Ett prov som på senare år har fått stort genomslag i kliniken är analys av kalprotektin i avföringen. Detta är ett cytoplasmaprotein som frisätts av aktiverade neutrofila granulocyter och/eller monocyter–makrofager vid celldöd. Proteinet har troligen regulatorisk betydelse för inflammationen och har både antimikrobiella och antiproliferativa egenskaper [12, 13]. Kalprotektin kan mätas i avföringen tack vare sin resistens mot metabol degradering av tarmbakterierna och är stabilt i upp till en vecka vid rumstemperatur. Normalvärdet för kalprotektin i feces är <50 mg/kg kroppsvikt, men vid ulcerös kolit och Crohns sjukdom ses ofta en mycket kraftig ökning av mängden kalprotektin i avföringen (ibland upp till flera tusen mg/kg).
Kalprotektin i feces har visat sig korrelera med den endoskopiskt skattade sjukdomsaktiviteten vid inflammatorisk tarmsjukdom [14, 15]. Provet är dock inte specifikt, och även vid andra inflammatoriska sjukdomar i tarmen, som bakteriell gastroenterit, divertikelsjukdom, koloncancer eller aktiv celiaki, ses varierande grad av kalprotektinökning. Provet kan även användas som ett screeningtest inför avbildande undersökningar. Ett normalt värde kan, i kombination med den kliniska bilden, styrka differentialdiagnosen irriterade tarmens syndrom (IBS). På så sätt kan provet minska behovet av avbildande undersökningar [16].
Exempel på andra fekala markörer är laktoferrin, som också är ett mått på neutrofila granulocyters aktivering, och ECP (eosinophil cationic protein) och EPX (eosinophil protein X), som speglar en specifik eosinofil aktivering [15, 17].Biopsier som tas i samband med endoskopiska undersökningar från mag–tarmkanalen kan styrka diagnosen men är inte konklusiva för inflammatorisk tarmsjukdom [18]. Histopatologin är personberoende, och det finns problem med inter- och intraobservatörsvariation. En aktiv dialog mellan patolog och gastroenterolog/kirurg är av vikt för att skärpa diagnostiken. Ett multigentest som nyligen har introducerats till kliniken analyserar uttrycket av sju utvalda markörgener i tarmbiopsier [19]. Dess värde är ännu oklart, men en förhoppning är att testet kan tillföra en säkrare histologisk diagnos framöver.Biomarkörer för att säkra diagnos och utvärdera behandling
Vi har under de senaste åren fått en rad nya och förbättrade verktyg för att lättare kunna ställa diagnosen inflammatorisk tarmsjukdom och beskriva dess utbredning. Trots utvecklingen inom området finns det ännu inget enkelt avgörande test, utan diagnosen baseras fortfarande på ett flertal olika modaliteter som kan vara relativt besvärliga och kostsamma.
Intensiv forskning bedrivs därför för att finna enkla biomarkörer i blodet och/eller avföringen som kan användas för att kunna fastställa diagnos och utvärdera behandlingseffekt.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.