Sammanfattat
Det finns specifika grupper av patienter med ulcerös kolit och crohnkolit som har ökad risk för att utveckla kolorektal cancer. Mycket tyder dock på att risken har reducerats under senare tid. Prognosen vid manifest kolorektal cancer har också förbättrats.
Inflammation i sig har visat sig vara en oberoende riskfaktor för kolorektal cancer. Den förbättrade antiinflammatoriska terapin med framför allt 5-aminosalicylsyra har visat sig vara en plausibel förklaring till den minskade risken.
Koloskopisk övervakning och förbättrad terapi vid manifest kolorektal cancer är faktorer som sannolikt ligger bakom en kraftigt förbättrad prognos.
Patienter med ulcerös kolit har ökad risk att drabbas av kolorektal cancer, men omfattningen av denna riskökning är omdiskuterad. Nyare studier antyder att risken för kolorektal cancer nu är mindre än vad man tidigare trott. Varför risken har minskat är inte kartlagt, men data tyder på att åtgärder som koloskopisk övervakning och ökad användning av antiinflammatorisk behandling, framför allt 5-aminosalicylsyra (5-ASA), har varit avgörande faktorer.
Förutom att vi nu vet mer om riskfaktorer för kolorektal cancerutveckling än tidigare, har kunskapen också ökat om skyddande faktorer. Prospektiva randomiserade studier inom området saknas och kommer inte heller att låta sig göras, av framför allt etiska och logistiska skäl. Vår kunskap bygger därför på observationella studier och insikter om bakomliggande biologiska mekanismer.
Minskad risk – men inte helt entydiga data
Av flera orsaker är det svårt att dra några entydiga slutsatser om risken för kolorektal cancer vid ulcerös kolit från de studier som har publicerats. Studierna skiljer sig i flera avseenden såsom geografi, populationssammansättning, definition och utbredningsgrad av sjukdomen, inflammationens svårighetsgrad, behandlingspolicy och analysmetoder. Sjukhusbundna material rapporterar generellt högre risk för kolorektal cancer än de populationsbaserade studierna. Den största sammanställningen på området, av Eaden och medarbetare, som inkluderar båda typerna av studier (41 studier) anger en kolorektal cancerrisk vid ospecifik ulcerös kolit på 2 procent vid 10 års sjukdomsduration, 8 procent vid 20 år och 18 procent vid 30 år [1]. Detta kan jämföras med en total livstidsrisk för kolorektal cancer på ca 5 procent i normalpopulationen.
Eadens och medarbetares metaanalys visar också på intressanta geografiska skillnader i form av en drygt halverad risk i Skandinavien jämfört med England och USA (2 fall av kolorektal cancer per 1 000 patientår jämfört med 4 respektive 5 fall).
Nyligen publicerade data antyder att risken för kolorektal cancer inte längre är så stor som tidigare angivits. Från St Mark’s Hospital, London, som har en av de största och längst följda kohorterna av ulcerös kolit (600 patienter) som genomgått koloskopisk övervakning, rapporteras en risk för kolorektal cancer på 2,5 procent vid 20 års sjukdomsduration och 7,6 procent vid 30 år [2], dvs klart lägre än vad andra sjukhusbundna studier tidigare visat [3]. Intressant nog visade det sig också att risken sjönk över den 30 år långa uppföljningen.
Även populationsbaserade studier har haft svårt att hitta något entydigt svar på risken för kolorektal cancer. I en prospektivt följd dansk population med ulcerös kolit har man inte kunnat konstatera någon ökad risk alls [4], och i en nyligen publicerad populationsbaserad studie från Minnesota finner man en icke-signifikant riskökning på 2,4 (standardiserad incidenskvot, SIR) för extensiva koliter [5].
Senare publicerade arbeten har alltså överlag rapporterat en lägre eller ingen ökad incidens av kolorektal cancer. Mot detta står färska svenska data som visar att risken för kolorektal cancer inte har minskat mellan 1965 och 2002. Ännu mer anmärkningsvärt är dock att risken för personer med ulcerös kolit att dö i kolorektal cancer minskat med 75 procent över samma tidsrymd [6].
Bättre omhändertagande en förklaring
Bortsett från att vi inte vet varför prognosen förbättrats så avsevärt, måste man dra slutsatsen att nuvarande uppföljningssätt är av värde för patienten. De tre mest troliga förklaringarna är tillkomsten av koloskopiövervakning, ökad användning av antiinflammatorisk terapi samt effektivare behandling (bättre kirurgi samt adjuvant strål- och cytostatikabehandling) vid manifest kolorektal cancer. Det vetenskapliga underlaget för att hävda en ökad kolorektal cancerrisk vid långvarig crohnkolit är betydligt magrare än vid ulcerös kolit [7]. Färska data från Stockholm och Uppsala visar dock inte på någon stor riskskillnad mellan ulcerös kolit och crohnkolit [6].
Utbredning av inflammationen viktig riskfaktor
Kronisk inflammation är i sig själv, vilket organ den än drabbar i mag–tarmkanalen, associerad med ökad risk för senare utveckling av cancer i det afficierade organet (t ex hepatocellulär cancer vid hepatit C och esofaguscancer vid långvarig esofagit).
Det är nyligen visat att grad av histologisk inflammation i kolorektalslemhinnan korrelerar till risk för kolorektal cancer [8]. Även makroskopiska tecken på inflammation såsom »backwash ileitis« och pseudopolyper [8, 9] liksom kliniska tecken på inflammation [10] har kopplats till ökad risk för kolorektal cancer.
Kliniskt är dock sjukdomsduration och utbredning av inflammationen de viktigaste riskfaktorerna [11]. Extensiv sjukdom är kopplad till ökad risk, medan vänstersidig kolit innebär en endast obetydlig eller lätt ökad risk [11]. Låg debutålder har visat sig vara en riskfaktor i vissa studier [11, 12] men inte i andra [2, 13, 14].
En annan väletablerad riskfaktor är primär skleroserande kolangit [15]. En metaanalys har visat att risken för kolorektal cancer är ökad med 4,8 gånger för patienter med primär skleroserande kolangit och ulcerös kolit jämfört med enbart ulcerös kolit [16].
Slutligen är hereditet för kolorektal cancer en uppmärksammad riskfaktor [17]. En förstagradssläkting med kolorektal cancer innebär en 2,5-faldig riskökning hos patient med ulcerös kolit. Risken ökar med faktorn 9,2 om kolorektal cancer uppträtt före 50 års ålder hos släktingen [18].
Faktorer som skyddar
Kemoprevention. I beaktande av att graden av inflammation i tjocktarmsslemhinnan verkar vara en riskfaktor för utveckling av kolorektal cancer, borde en minskning av inflammationsgraden också kunna leda till en åtföljande minskad risk för cancerutveckling. Blickarna har i första hand riktats mot 5-ASA-molekylen, som har stora kemiska likheter med acetylsalicylsyramolekylen. Bevisen för att acetylsalicylsyra och andra NSAID är antikarcinogena är övertygande. Djurexperimentella data är mycket samstämmiga [19, 20], och randomiserade, kontrollerade kliniska studier har visat att acetylsalicylsyra förebygger utvecklingen av adenom (närmaste »surrogatmarkören« för kolorektal cancer) [21, 22].
Tillika finns det plausibla cellulära mekanismer som kan förklara verkningsmekanismerna bakom den kemopreventiva effekten, även om det saknas en del pusselbitar [23]. 5-ASA, som är förstahandsbehandling vid ulcerös kolit både vid lindrig aktiv inflammation och som profylax mot skov, skulle därför kunna vara den inflammationsmodifierande terapi som bidrar till den minskande risken för kolorektal cancer.
Detta stöds av en nyligen publicerad metaanalys av 9 studier med totalt 1 932 patienter, som visar en skyddande effekt av 5-ASA. Den minskade risken för att utveckla cancer eller dysplasi/cancer uppskattas till 49 procent, oddskvot 0,51 (95 procents konfidensintervall 0,37–0,69), vid regelbundet användande av 5-ASA [24] .
Hos en subgrupp av patienter med ulcerös kolit och primär skleroserande kolangit, och därmed kraftigt förhöjd risk att utveckla kolorektal cancer, har ursodeoxicholsyra (UCDA) visat sig verka kemopreventivt. UCDA utgör ca 10 procent av de naturligt förekommande gallsyrorna hos människa och har studerats hos patienter med primär skleroserande kolangit för att utröna om cirrosutveckling kan förhindras, men utan övertygande resultat.
I kölvattnet av dessa studier har man kunnat studera effekten av UCDA på dysplasi och cancerutveckling i kolorektalmukosan. I en retrospektiv undersökning av 59 patienter med ulcerös kolit och primär skleroserande kolangit fann Tung et al att risken för att utveckla dysplasi var signifikant sänkt hos patienter som fått UCDA (32 procent) jämfört med placebo (72 procent) [25]. I en annan randomiserad studie på 52 patienter med ulcerös kolit och primär skleroserande kolangit som följdes 48 månader var risken att utveckla dysplasi och eller cancer sänkt med 74 procent [26].
I studierna skiljde sig inte användningen av 5-ASA mellan de jämförda grupperna. Patienter med ulcerös kolit som också har primär skleroserande kolangit bör utifrån dessa resultat behandlas med UCDA. Om denna kemopreventiva effekt är överförbar även vid ulcerös kolit utan primär skleroserande kolangit vet vi för närvarande inte. Den enda studie som behandlat frågan hittills är en mindre svensk dubbelblind, prospektiv undersökning där 19 ulcerös kolit-patienter med låggradig dysplasi och/eller aneuploidi följdes i 2 år. Av de 9 patienterna som fick placebo utvecklade 2 allvarligare form av dysplasi, jämfört med ingen i gruppen som fick UCDA [27].
Koloskopisk övervakning. En säkert skyddande faktor mot att utveckla kolorektal cancer vid ulcerös kolit vore att göra proktokolektomi, lämpligast efter 8–10 års sjukdomsduration. Denna metod praktiserades också före den endoskopiska eran, men har ersatts av koloskopisk övervakning. Det finns dock inga säkra bevis för att koloskopiövervakning verkligen förlänger överlevnaden. En Cochrane-analys med det begränsade underlaget av två studier kunde inte demonstrera någon skillnad i överlevnad [28].
Ett indicium på att koloskopisk övervakning ändå kan minska mortaliteten kommer från Karlén och medarbetare, som i en fall–kontrollstudie fann en relativ risk på 0,29 (95 procents konfidensintervall 0,06–1,31; således ej signifikant) för koloskoperade patienter att dö av kolorektal cancer jämfört med patienter som aldrig koloskoperats [29]. I studien fanns det också en tendens till ett dos–responsförhållande, dvs de patienter som genomgått två eller flera koloskopier hade mindre risk än de som genomgått endast en.
Data visar också att kolorektal cancer kan upptäckas i ett tidigare stadium med koloskopisk övervakning än utan, med en signifikant bättre 5-årsöverlevnad som följd [30]. Flera centra har rapporterat goda resultat och hög behandlingsföljsamhet med koloskopiska övervakningsprogram [2, 31]. I en nyligen publicerad studie från St Mark’s konkluderar man att den övervägande majoriteten av asymtoma
tiska ulcerös kolit-patienter förblir icke-opererade
och att den totala 5-årsöverlevnaden för fall av kolorektal cancer som upptäckts i programmet var 74 procent [2].
I sin nyligen pu-blicerade avhandling kunde Jan Lindberg dra slutsatsen att ett koloskopiskt övervakningsprogram i ett
geografiskt avgränsat område (upptagningsområdet för Örnsköldsviks sjukhus) är effektivt för att förhindra död i kolorektal cancer och att majoriteten av patienterna, liksom i St Mark’s-studien, förblev icke-opererade [31].
Principer för koloskopisk övervakning
Sedan 1995 har vi i Sverige ett nationellt program för koloskopisk övervakning av patienter med ökad risk för kolorektal cancer [32]. Programmet har nyligen genomgått revision. Riskpatienter som bör erbjudas regelbunden koloskopisk övervakning är de med kolit som sträcker sig proximalt om vänsterflexurer vid ulcerös kolit eller kolit som omfattar mer än en tredjedel av kolon vid crohn och med en sjukdomsduration som överstiger 8–10 år.
Speciella riskgrupper är patienter med samtidig förekomst av primär skleroserande kolangit och patienter med hereditet för kolorektal cancer. Tidig kolitdebut (<20 års ålder) har också betraktats som en speciell riskfaktor, även om studierna inte är helt entydiga på denna punkt. För att ett övervakningsprogram ska fungera framgångsrikt med god patientföljsamhet krävs noggranna rutiner för inklusion och uppföljning. Ett särskilt register för detta ändamål kan vara värdefullt.
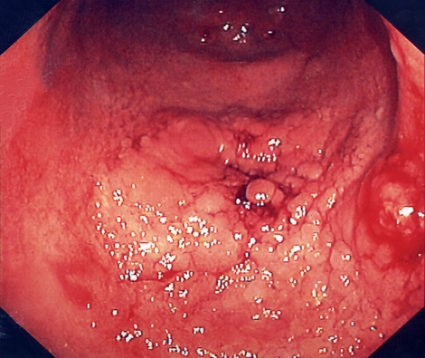
Syftet med det koloskopiska övervakningsprogrammet är att identifiera högriskpatienter för kolorektal cancer. Det görs genom att man med regelbundna koloskopier och multipel biopsitagning identifierar tidiga neoplastiska förändringar (dysplasi) i kolonslemhinnan. Dysplasi indelas förenklat i två grader: låggradig och höggradig. Om makroskopiska förändringar förekommer i anslutning till dysplasin talar man om DALM (dysplasia associated lesion or mass) (Figur 1). Dysplasidiagnostiken är ett särskilt problem. Genom biopsitagning från fel område, »sampling error«, kan dysplasi förbises; ett fel som kan minimeras genom att många biopsier tas.
Vidare är den histologiska diagnostiken svår, framför allt vid låggradig dysplasi, med såväl inter- som intraobservatörsvariation. Samtidigt förekommande inflammation i slemhinnan är också en försvårande faktor.
Höggradig dysplasi och DALM betraktas som absoluta operationsindikationer. Fynd av låggradig dysplasi är mer kontroversiellt. Tätare intervall mellan koloskopikontrollerna är definitivt indicerat, och om fyndet upprepas vid flera undersökningar och/eller finns i flera lokaler i tarmen bör proktokolektomi övervägas. Operationen görs i lämpliga fall kontinensbevarande med en ileal bäckenreservoar, annars med terminal ileostomi.Mer kunskap behövs för att kunna identifiera riskgrupper
Risken för kolorektal cancer är fortfarande ökad i vissa grupper av patienter med ulcerös kolit och crohnkolit. Mycket talar dock för att risken har minskat över tiden, och det ligger nära till hands att tro att det beror på vårt förbättrade sätt att omhänderta patienterna, med utveckling av specialiserade IBD-mottagningar.
Det är mycket troligt att den ökade användningen av antiinflammatorisk terapi, framför allt 5-ASA-preparat, har modifierat risken för kolorektal cancer, inte minst i ljuset av att kronisk inflammation i kolonmukosan visat sig vara en riskfaktor i sig. Förutom den rent antiinflammatoriska effekten av 5-ASA har substansen även kemopreventiva egenskaper.
Den andra faktorn som troligen haft avgörande betydelse är koloskopisk övervakning av selekterade riskgrupper, en teknik som det finns stora möjligheter att förfina. Dagens för ögat osynliga dysplasier är genom tekniska framsteg inom endoskopin på väg att synliggöras och möjliggör mer fokuserade undersökningar. Mer forskning behövs för att tydligare identifiera riskgrupper så att övervakningsresurser kan optimeras.
*
Potentiella bindningar eller jävsförhållanden: Robert Löfberg har arvoderats som föreläsare/deltagit i olika rådgivande vetenskapliga möten sponsrade av Abbott, Asahi, Astra Zeneca, Celltech, Centocor, Cosmo, Elan, Ferring, InDex, Meda, Otsuka, Pfizer/Pharmacia, Schering Plough, Serono, Swedish Orphan, UCBs.