Sammanfattat
De mest fördelaktiga medicinerna för behandling av neuropatisk smärta återfinns inom preparatgrupperna antidepressiva, antiepileptika och opioider.
Endast knappt hälften av patienterna får värdefull smärtlindring.
Behandlingsstudier har framför allt genomförts för smärtsam diabetespolyneuropati och postherpetisk neuralgi. Få studier finns att tillgå avseende central neuropatisk smärta.
Prediktorer för val av terapi saknas i det enskilda fallet, och behandlingen kan beskrivas som »trial and error«-betonad.
Effekten av kombinationsbehandlingar, sk rationell polyfarmaci, behöver studeras.
Behandlingsarsenalen vid långvarig neuropatisk smärta inbegriper såväl läkemedel som elektriska stimuleringsmetoder (tex transkutan elektrisk nervstimulering och ryggmärgsstimulering).
Samtliga i dag använda farmakologiska strategier har intressant nog inte primärt utvecklats för behandling av neuropatisk smärta utan för behandling av tex depression eller epilepsi. Smärtområdet har adopterat strategierna delvis till följd av att preparatens verkningsmekanismer, så långt de är kända, förefallit passa tänkbara mekanismer för den neuropatiska smärtans uppkomst och underhåll.
Denna artikel är baserad på ett nyligen publicerat dokument från en arbetsgrupp inom EFNS (European Federation of Neurological Societies) [1], där författaren ingått, som sammanställt och efter organisationens riktlinjer [2] värderat olika behandlingsalternativ utifrån rekommendationsnivåer baserade på kvaliteten på den underliggande dokumentationen.
Evidensbaserad farmakologisk behandling
Följande preparatgrupper har i randomiserade kontrollerade studier visats vara mest fördelaktiga vid behandling av neuropatisk smärta:
Antidepressiva: tricykliska antidepressiva (tex amitriptylin), SNRI (selektiva serotonin- och noradrenalinåterupptagshämmare såsom duloxetin och venlafaxin)
Antiepileptika: gabapentin, pregabalin, lamotrigin, karbamazepin, oxkarbazepin
Opioider: morfin, oxikodon, metadon
Tramadol.
Även cannabinoider och topikal tillförsel av lidokain/capsaicin har smärtlindrande effekter vid specifika tillstånd.
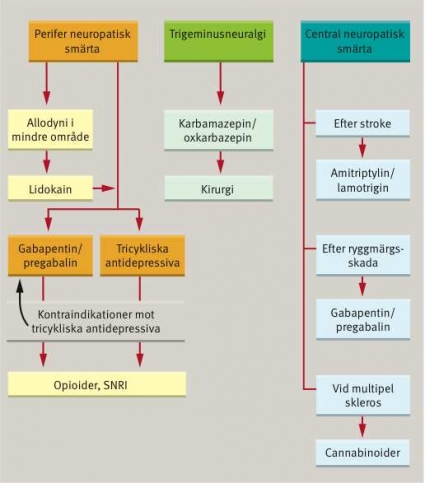
Med till buds stående medel i monoterapi kan neuropatisk smärta över de olika diagnostiska entiteterna på ett för individen värdefullt sätt lindras hos knappt hälften av patienterna [1]. Vi är fortfarande i stort behov av nya och effektivare strategier. Ordningsföljden för tillgängliga farmakologiska behandlingsstrategier saknar rational, och det finns generellt sett ingen information om hur olika strategier påverkar specifika symtom/statusfynd. EFNS-gruppens förslag till behandlingsalgoritm har adopterats av Läkemedelsverket och återges i Figur 1.
Genom systematiska översikter som använt konceptet kring NNT (number needed to treat, dvs antalet patienter som behöver behandlas för att en patient ska rapportera minst 50 procents smärtlindring efter korrektion för placebo/annan behandling eller responders till ingen behandling) [3] har vi relativt nyligen fått viss insikt i effekter på gruppnivå av olika preparat på spontansmärta vid olika typer av neuropatisk smärta [4-6]. En nivå för smärtlindring motsvarande 30 procent har på goda grunder också föreslagits [7] som en kliniskt signifikant lindring.
NNT-konceptet är enkelt och kan ge värdefull information för kliniska beslut, men dess fundament måste förstås av klinikern som ska använda det. Styrkan på slutsatserna som kan dras av systematiska översikter angående den kliniska effekten av en specifik behandlingsstrategi är kritiskt beroende av datakvaliteten i den vetenskapliga litteraturen. Används NNT med omdöme kan det utgöra en av flera faktorer för ställningstagande till val av terapi.
»Number needed to harm« (NNH) kan beräknas på liknande sätt som NNT och är en viktig parameter att inkludera vid det kliniska beslutsfattandet inför terapival. Såväl allvarliga som mindre allvarliga biverkningar ska vägas in.
Kliniska behandlingsstudier (exkluderande trigeminus- och glossopharyngeusneuralgi, där karbamazepin är förstahandsval) av patientpopulationer med samma underliggande sjukdomsetiologi har givit för handen en rad preparat med signifikant smärtlindrande effekt jämfört med placebo. Få studier har utförts där man jämfört substanser från olika preparatklasser.
Notabelt är att den övervägande delen av behandlingsstudierna utförts på två diagnostiska entiteter; smärtsam diabetespolyneuropati och postherpetisk neuralgi. I vilken utsträckning man kan tillåta sig att extrapolera resultat från dessa studier till andra diagnostiska entiteter är oklart, men det har föreslagits som en rimlig strategi vid perifera neuropatiska smärttillstånd [8]. Skälet till att man valt begränsade diagnostiska entiteter i behandlingsstudier är sannolikt den relativt höga prevalensen av dessa patientgrupper.
Antidepressiva ger äkta smärtlindrande effekt
Särskilt de tricykliska antidepressiva preparatens mångfasetterade verkningsmekanismer [9] kan vara skälen till deras positiva effekter på neuropatiska smärtor av varierande etiologi. Preparatgruppen har en lång historia inom ämnesområdet neuropatisk smärta, och amitriptylin var den första substans som visades vara effektiv i en randomiserad kontrollerad studie på patienter med postherpetisk neuralgi [10].
Det har klarlagts att det finns en äkta smärtlindrande effekt av tricykliska antidepressiva och inte enbart en stämningslägeshöjning som indirekt skulle kunna medföra smärtreduktion.
Amitriptylin har senare visats vara effektivt vid smärtsam diabetespolyneuropati [11] och central smärta efter stroke [12]. Biverkningar kan utgöra ett problem och består vanligen av muntorrhet, förstoppning, urineringsbesvär, kognitiva störningar, sedering, ortostatiska besvär och ackommodationsstörning. Lyhördhet för sexuella funktionsstörningar är viktigt i uppföljningen. Maprotilin har i begränsade studier visats vara effektivt vid postherpetisk neuralgi [13] och vid olika typer av smärtsam polyneuropati [14] och kan därför vara ett alternativ till amitriptylin när biverkningar omöjliggör fortsatt behandling.
Nortriptylin visades vara lika effektivt som amitriptylin vid postherpetisk neuralgi [15]. SNRI-preparat såsom duloxetin reducerar signifikant smärta vid diabetespolyneuropati [16-18]. Venlafaxin har relativt nyligen visats reducera vissa smärtkomponenter jämfört med placebo vid neuropatisk smärta efter mastektomi [19], smärtsam diabetespolyneuropati [20] och olika typer av smärtsam polyneuropati [21]. Ett fåtal studier vid smärtsam diabetespolyneuropati [22, 23] har visat på smärtlindring av SSRI-preparat (selektiva serotoninåterupptagshämmare) jämfört med placebo. Klinisk erfarenhet indikerar dock att SSRI-preparat inte är en värdefull strategi vid neuropatisk smärta.
Antiepileptika interagerar med natrium-/kalciumkanaler
Inom gruppen antiepileptika finns substanser som interagerar med natriumkanaler, såsom karbamazepin, fenytoin och lamotrigin. Även lokalanestetika (lidokain) [24, 25] och ett antiarytmikum (mexiletin) [26] interagerar med natriumkanaler och har tidigare använts för behandling av neuropatisk smärta. Karbamazepin är förstahandpreparat vid behandling av trigeminusneuralgi [27, 28] och den än mer sällsynta glossopharyngeusneuralgin. Även oxkarbazepin är effektivt vid dessa tillstånd och kan vara ett alternativ till karbamazepin vid biverkningsproblem [12]. Vid central neuropatisk smärta efter stroke rapporterades ingen effekt skild från placebo avseende karbamazepin [12].
Karbamazepin är inte välstuderat vid andra tillstånd, och det förefaller finnas konsensus hos neurologer med omfattande erfarenhet av behandling av neuropatisk smärta att preparatet sällan eller aldrig ger smärtlindring vid andra tillstånd än de klassiska neuralgierna inom huvud/ansikte/munhåla och svalg.
Lamotrigin, som minskar frisättningen presynaptiskt av excitatoriska aminosyror genom blockad av spänningsberoende natriumkanaler, har visats vara effektivare än placebo vid smärtsam HIV-associerad neuropati [29, 30], smärtsam diabetespolyneuropati [31], central smärta efter stroke [32] och möjligen för vissa komponenter av central smärta vid inkomplett ryggmärgsskada [33]. Använda doser varierar mellan 200 och 400 mg/dygn. En tidigare studie har också påvisat en signifikant smärtlindring som tilläggsbehandling till karbamazepin vid trigeminusneuralgi [34]. Risken för allvarliga hudbiverkningar måste beaktas. I den stund läkemedlet övervägs för behandling av neuropatisk smärta tillråds försiktig upptrappning enligt Fass-rekommendationer.
Lidokain tillfört systemiskt har förespråkats av vissa, men avsaknaden av rigorösa behandlingsprotokoll och den kortvariga effekten ger inte utrymme för att rekommendera omfattande användning. Möjligen kan lidokain och kanske också fenytoin försöksvis användas för intravenöst bruk i svåra akuta situationer med exacerbation av neuropatisk smärta.
Under det senaste decenniet har två preparat lanserats, gabapentin och pregabalin, med hög affinitet till den sk (alfa)2(delta)-subenheten hos spänningsberoende kalciumkanaler. Detta medför minskat upptag av kalcium, och i det presynaptiska scenariot betyder det minskad frisättning av transmittorer, tex glutamat. Detta medför i sin tur ett minskat bombardemang av postsynaptiska NMDA-receptorer och därmed minskad hyperexcitabilitet i postsynaptiska neuron. Pregabalin har starkare affinitet till (alfa)2(delta)-subenheten hos kalciumkanalen och tar gabapentinets plats vid konkurrens om receptorn.
Gabapentin har visats vara effektivt vid postherpetisk neuralgi [35], smärtsam diabetespolyneuropati [36], fantomsmärta [37] och neuropatisk smärta efter ryggmärgsskada [38]. Uppföljaren tilll gabapentin, pregabalin, har alltså liknande verkningsmekanism som gabapentin och har visat på smärtlindring överlägsen placebo vid postherpetisk neuralgi [39, 40], smärtsam diabetesneuropati [41], central smärta efter ryggmärgsskada och stroke [42, 43]. Pregabalin är det överlägset bäst dokumenterade preparatet mot neuropatisk smärta.
Eftersom »head to head«-studier saknas mellan de två preparaten, måste vi invänta sådana och under tiden noggrant utvärdera och jämföra preparatens effekter i klinisk praxis. Såväl gabapentin som pregabalin är enkelt att administrera, behöver inte monitoreras avseende plasmakoncentration och har en relativt låg incidens av allvarliga biverkningar. De sistnämnda är relaterade till CNS-störningar och utgörs vanligen av yrsel, ataxi, sömn- och minnesstörningar.
Interaktionsproblemen är få, men dosen måste justeras i relation till njurfunktion (kreatininclearance), eftersom preparaten inte metaboliseras i nämnvärd utsträckning.
Pregabalin kan ges i 2-dosförfarande och uppvisar ett linjärt förhållande mellan dosstorlek och plasmakoncentration, vilket inte är fallet med gabapentin, som ges i 3-dosförfarande.
Opioidernas effekt källa till internationell kontrovers
Opioider som terapi vid neuropatisk smärta har varit en källa till kontrovers på internationell nivå sedan slutet av 1980-talet. Baserat på den vetenskapliga litteraturen står det nu helt klart att opioider har smärtlindrande effekt vid neuropatisk smärta [44, 45]. Morfin och metadon lindrar smärtan vid postherpetisk neuralgi [46], och oxikodon har visats vara effektivt vid postherpetisk neuralgi [47] och smärtsam diabetespolyneuropati [48, 49].
Det saknas dock mycket kunskap kring långtidseffekter av opioidbehandling, och vi känner inte till om långtidsbehandling med opioider också resulterar i signifikanta livskvalitetsförbättringar. Riskerna avseende missbruk och effekter på tex endokrina och immunologiska system är också ofullständigt explorerade.
Tramadol, en svag återupptagshämmare av serotonin och noradrenalin med samtidig låg affinitet till my-receptorn, har visats ge smärtreduktion i doser upp till 400 mg/dygn vid smärtsam diabetespolyneuropati [50] och vid polyneuropati av varierande etiologi [51]. Någon slutgiltig värdering av konsensustyp avseende preparatets effekt vid neuropatisk smärta finns ännu inte.
Transdermal tillförsel av substanser för lindring av neuropatisk smärta har tilldragit sig visst intresse, och framför allt har man studerat detta vid postherpetisk neuralgi. Såväl capsaicin som lokalbedövningsmedel har undersökts. Sannolika mekanismer rörande smärtans uppkomst och underhåll måste här noga övervägas före behandlingsstart [52].
Läkemedelsstudier med begränsningar
I majoriteten av ovan nämnda studier har man inte i detalj försökt analysera subgrupper av patienter med liknande klinisk fenomenologi för att definiera gemensamma nämnare, vilka skulle kunna predicera ett positivt eller negativt behandlingsutfall. De studerade preparaten har olika (och potentiellt flera) verkningsmekanismer, och effekten är ofta partiell, vilket indikerar att ett flertal mekanismer är aktuella vid många av dessa tillstånd.
Intressant nog har enskilda preparat effekter på smärtor vid tillstånd med olika etiologier, och flera substanser med olika verkningsmekanismer kan ha effekt vid ett och samma etiologiska tillstånd. Detta antyder en logisk rational för användande av substanskombinationer och därmed behov av randomiserade kontrollerade studier med fokus på polyfarmaci avseende preparat som visat på behandlingseffekt i monoterapi, allt i en strävan att uppnå maximal smärtlindring vid alla typer av neuropatisk smärta.
Sådana ansatser har redan gjorts, och morfin i kombination med gabapentin har vistats vara något mer effektivt än båda substanserna givna som monoterapi [53]. Även behandlingskombinationer mellan läkemedel och stimuleringstekniker förefaller rimliga.
Gamla såväl som nya farmakologiska behandlingsstudier avseende neuropatisk smärta har i allmänhet designats för att monitorera endast spontansmärta. Att döma av det variabla kliniska uttrycket av neuropatiska smärttillstånd, förefaller det rimligt att föreslå att en diagnostisk entitet kan innehålla en rad olika möjliga patofysiologiska mekanismer för spontan- och stimulusutlöst smärta.
Framtida behandlingsstudier bör därför inte bara registrera spontansmärta, utan också finna en rational för att subgruppera patienter inom en diagnostisk entitet baserat på symtom/ statusfynd och därmed möjliga gemensamma mekanismer och använda tekniker för att kvantifiera dessa [54]. En sådan strategi kan underlätta identifiering av lindring av olika aspekter av den neuropatiska smärtan och därmed facilitera framtagandet av skräddarsydd behandling för olika tillstånd.
Den vetenskapligt baserade behandlingsarsenalen för behandling av perifer och central neuropatisk smärta har ökat påtagligt under senare år. Fortfarande saknas sannolikt effektiv smärtlindrande terapi i majoriteten av fallen. Man har inte heller lyckats definiera prediktorer för val av terapi i det enskilda fallet, och behandlingsstrategin kan fortfarande karakteriseras som »trial and error«-betonad.
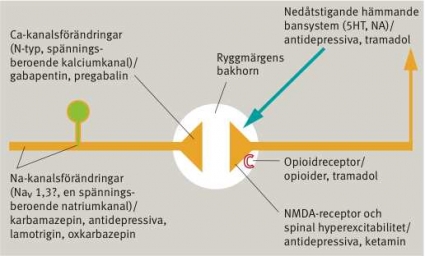
Principiellt kan man tänka sig två olika sätt för läkemedel att modulera smärtsystemets aktivitet vid neuropatisk smärta (Figur 2):
Måltavlan för läkemedlets verkningsmekanism uttrycks som en pivotal patofysiologisk mekanism i underhållet av smärttillståndet, tex substanser som verkar på jonkanaler.
Preparatets verkningsmekanism kan modulera symtom/ statusfynd utan att verkningsmekanismen är involverad i mekanismerna bakom tillståndets initiering eller underhåll, tex opioider.
Avslutningsvis förtjänar det att åter nämnas att Läkemedelsverket under slutet av 2007 publicerat riktlinjer för behandling av neuropatisk smärta, vilka till stora delar bygger på rekommendationerna från arbetsgruppen inom EFNS [1].
*
Potentiella bindningar eller jävsförhållanden: Författaren har under det senaste året fungerat som rådgivare åt Pfizer, Lilly, Neurosearch, Boehringer Ingelheim, Nolabs, Wyeth och Medtronic samt erhållit föreläsningsarvoden från Pfizer, Lilly och Boehringer Ingelheim.